项目文章|组蛋白磷酸化介导肝脏胰高血糖-PKA-CREB的糖异生程序以响应禁食
2023-04-18 17:49:16, 创新质谱组学 上海欧易生物医学科技有限公司

▲点击图片报名本期培训班
肝糖异生失调导致I型和II型糖尿病的高血糖。肝糖异生被认为是在禁食状态下维持血糖水平的主要事件。肝脏胰岛素抵抗则是这类疾病发病机制的主要环节, 其最明显的病理生理特点就是糖异生和糖原分解功能发生紊乱导致肝糖输出增多, 其中糖异生的作用尤为显著。
因此, 有效抑制肝脏过度糖异生, 减少内源性葡萄糖生成, 将是治疗糖尿病的重要靶标之一。尽管我们已经清楚糖异生活性的调节在很大程度上依赖于转录水平,但是糖异生基因的转录激活的具体机制还未被阐明。
2023年3月1日,中国科学院上海营养与健康研究所丁秋蓉团队在Molecular Cell在线发表题为Histone phosphorylation integrates the hepatic glucagon-PKA-CREB gluconeogenesis program in response to fasting 的研究论文。该研究发现了组蛋白磷酸化对激素信号有反应,并将信号传递给染色质以激活糖异生基因。具体而言:在饥饿状态下,胰高血糖素激活PKA信号通路,PKA随即被CREB招募到基因组糖异生基因调控区域,磷酸化H3S28。14-3-3ζ识别H3S28ph信号并招募RNA聚合酶II激活糖异生基因转录。
总之,作者揭示了激素信号激活的转录因子途径和染色质调节模块之间在控制代谢稳态中的相互作用和合作的密切性质,为糖尿病患者治疗提供了新的理论框架。

中文标题: 组蛋白磷酸化结合肝脏胰岛素-PKA-CREB介导的糖异生程序以响应饥饿
研究对象:小鼠肝组织,肝细胞
发表期刊:Molecular Cell
影响因子:19.328
发表时间:2023.3.1
合作单位:中国科学院上海营养与健康研究所
运用生物技术:RNA测序、CUT&Tag、ChIP-seq分析、4D-label free蛋白质组(由鹿明生物提供技术支持)
研究思路

主要结果
1.H3S28ph可以显著促进肝脏糖异生基因表达和糖异生
作者首先利用多种蛋白修饰抗体确认对禁食后组蛋白翻译后修饰的影响,发现H3S28ph信号显著增加,与肝脏CREB磷酸化的增加相当。

图1 | 组蛋白H3S28被磷酸化以响应低糖信号
进一步,作者使用RNA测序、CUT&Tag和ChIP-seq分析,以评估禁食和喂食状态下H3S28gh的RNA图谱和位置的全基因组变化。糖异生基因是对禁食反应中上调最多的基因,在禁食诱导的基因附近可以清楚地看到H3S28ph的增加,以及葡萄糖异生基因(如G6pc、Fbp1、Pck1和Pcx)附近观察到明显的H3S28ph信号。这些结果表明H3S28ph是葡萄糖异生基因附近对禁食反应的显性激活修饰。
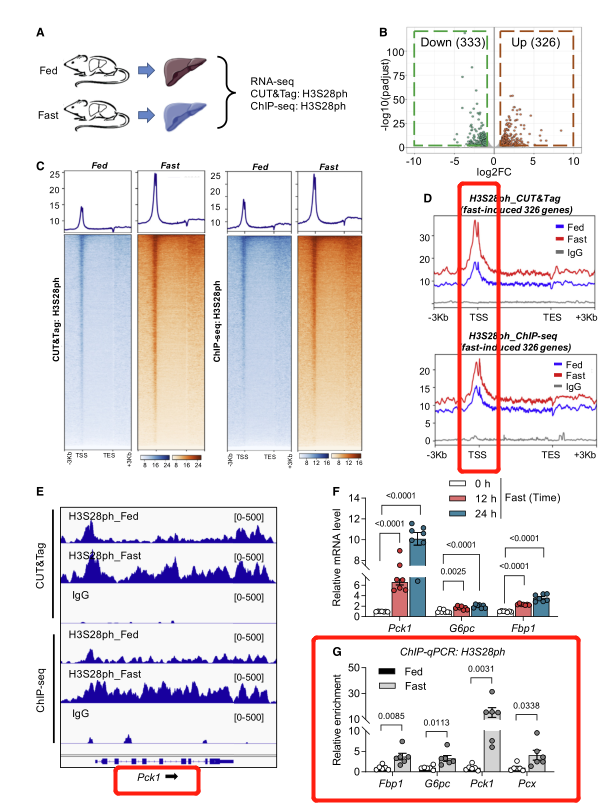
图2 | 组蛋白H3S28磷酸化定位在快速诱导基因附近
此外,通过肝脏特异过表达野生型H3.3(wt)和H3.3S28A(S28突变为丙氨酸以阻断磷酸化)和H3.3S28D(S28变异为天冬氨酸以模拟磷酸化),证明H3.3-S28D可以显著促进肝脏糖异生基因表达和糖异生过程。

图3 | 组蛋白H3S28磷酸化增强肝脏糖异生
2.14-3-3z识别H3S28ph并刺激肝脏糖异生基因转录
作者进一步探究优先结合H3S28ph并介导基因表达激活的因素。通过蛋白质组学锁定核定位增加的蛋白,并结合cut-tag确定14-3-3z信号在糖异生基因的显著富集,其分布模式与H3S28ph的信号几乎相同。Co-IP实验表明,内源性14-3-3z与肝组织中的RNA Pol II及其磷酸化形式(RNA PolⅡS5p)相互作用。
通过ChIP-qPCR糖异生基因附近的14-3-3z和RNA Pol II S5p的结合信号增加,而敲除14-3-3z后,RNA Pol II S5p富集和糖异生活性显著降低。这证实14-3-3z结合并识别H3S28ph,招募RNA Pol II以刺激转录。
3.胰高血糖素激活PKA信号通路,PKA随即被CREB招募到基因组糖异生基因调控区域,磷酸化H3S28
先前的研究已经建立Gcg-cAMP-PKA级联反应。因此,作者继续检验Gcg-cAMP-PKA级联调节H3S28ph的假设。在Gcg处理体内肝组织和体外原代肝细胞后,均观察到H3S28ph信号的显著增加。体外激酶测定表面增加PKA时,H3S28ph也显著增加。
当作者敲除PKA的催化亚基α时,糖异生活性下调,而H3.3S28D的表达可以显著恢复PKA缺失肝细胞中的葡萄糖生成和糖异生基因表达。这证实PKA磷酸化H3S28以响应禁食。

图4 | 14-3-3z读取H3S28ph
那什么决定了H3S28ph在葡萄糖异生基因上对禁食的特异性呢?作者发现H3S28ph结合了丰富的CRE基序,而CREB先前被鉴定为通过与CRE结合来调节糖异生基因转录的核心转录因子。在CREB耗尽的肝脏中,由于禁食,H3S28ph显著降低,PKA和H3之间的相互作用降低,有力地证明了CREB参与PKA的基因组募。

图5 | PKA磷酸化H3S28并通过H3S28磷酸化调节糖异生
4.PP2A作为H3S28ph的磷酸酶
先前研究表明PKA和PP2A(丝氨酸/苏氨酸蛋白磷酸酶)具有相似的识别基序和底物蛋白。为了检查PP2A是否是H3S28ph的磷酸酶,作者通过体外磷酸酶测定,和CUT&Tag分析证实PP2A抑制H3S28ph磷酸化。进一步地,肝脏PP2A耗竭阻止了H3S28ph对葡萄糖注射的去磷酸化反应,导致体内糖异生活性增加和H3S28ph、14-3-3z和RNA Pol II S5p信号在糖异生基因启动子处的富集显著增加。这些数据共同阐明了PP2A是抑制糖异生基因表达的H3S28ph磷酸酶。

图6 | CREB指导糖异生基因的H3S28磷酸化
研究结论
饥饿状态下,胰高血糖素激活PKA信号通路,PKA随即被CREB招募到基因组糖异生基因调控区域,磷酸化H3S28。14-3-3ζ识别H3S28ph信号并招募RNA聚合酶II激活糖异生基因转录。
而进食状态下,PP2A作为H3S28ph的磷酸酶抑制其磷酸化,继而抑制糖异生基因的表达。PKA和PP2A通过组蛋白磷酸化/去磷酸化参与调节染色质状态和基因表达,也可能对其他生物过程产生广泛的功能影响。
猜你还想看
END
Lemon 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
04-11
建议收藏!参考这些稳定性因素可大大降低ADCs开发过程的风险04-11 NanoTemper
FAQ系列1_Ligand梯度稀释04-11 NanoTemper
直播预告 | PR Panta助力ADC研发04-11 NanoTemper
FAQ系列2_结合buffer04-11 NanoTemper
这份证书,让你脱颖而出 | 福立仪器2024年NTC培训计划启动,赶快报名抢占先机!04-10
Peak微课堂 | 氢气发生器应用合集04-10 毕克气体
探索“哈希中源纪”,精美好礼随心兑!04-10
QbD1200+总有机碳分析仪在第三方医疗器械清洁度检测中的应用04-10
Aliben动态 | 兰州空间技术物理研究所李得天院士一行莅临艾立本科技考察调研04-10 艾立本科技
博赛德VOCs检测技术与ODS等新污染物检测前沿探究 · 全国巡回技术交流会之南京站即将拉开帷幕04-10 市场部
距离医疗新质生产力亮相CMEF还有一天!04-10
上海仪电·科学仪器诚邀您参加第61届中国高等教育博览会04-09
GE医疗中国携手国家传染病医学中心及上海感染与免疫科技创新中心搭建肝病全周期防控路径04-09
BDO一网打尽 | 过程监测篇04-09 福立仪器
赛默飞与您相约第三届中国国际氢能及燃料电池高峰论坛暨展览会04-09
赋能创“芯” | 赛默飞电子气体气相色谱分析解决方案04-09 飞飞
【线上培训】沃特世GPC/APC聚合物分析技术应用交流会04-09 沃特世技术服务
Empower控制质谱使用小贴士(四)| 培训讲座进行时04-09 沃特世技术服务
纤微影示,涵蕴起初 — 急诊篇 二04-09 岛津医疗


