Nature | 肠脑轴:16S+代谢+转录揭示间歇性禁食改变肠道菌群,促进神经损伤修复
2022-09-14 08:10:15, 多层组学定制服务 上海欧易生物医学科技有限公司

前言
神经轴突再生速率在哺乳动物外周神经系统神经元损伤后受到限制。运动和环境富集等因素可以促进轴突再生的信号通路。间歇性禁食(IF)可激活基因转录和蛋白质合成、线粒体代谢和神经营养素释放。然而,IF是否影响轴突再生能力仍有待研究。本篇以小鼠坐骨神经为对象,探究肠道细菌衍生代谢物吲哚-3-丙酸(IPA)对神经轴突的再生作用和恢复功能。
2022年06月,英国伦敦帝国学院脑科学系神经学部的Simone Di Giovanni 教授课题组在Nature(IF:69.504)期刊发表了题为 “The gut metabolite indole-3 propionate promotes nerve regeneration and repair ”的研究成果,通过GC-MS非靶向代谢组学、LC-MS/MS、16S rDNA扩增子测序、RNA转录组测序、免疫学等研究方法,发现了小鼠肠道菌群和代谢物特征,探究了神经功能恢复机理,描绘了损伤神经的再生和增加图谱,为小鼠的神经轴突再生和感觉功能恢复理论依据。

研究思路
研究方法
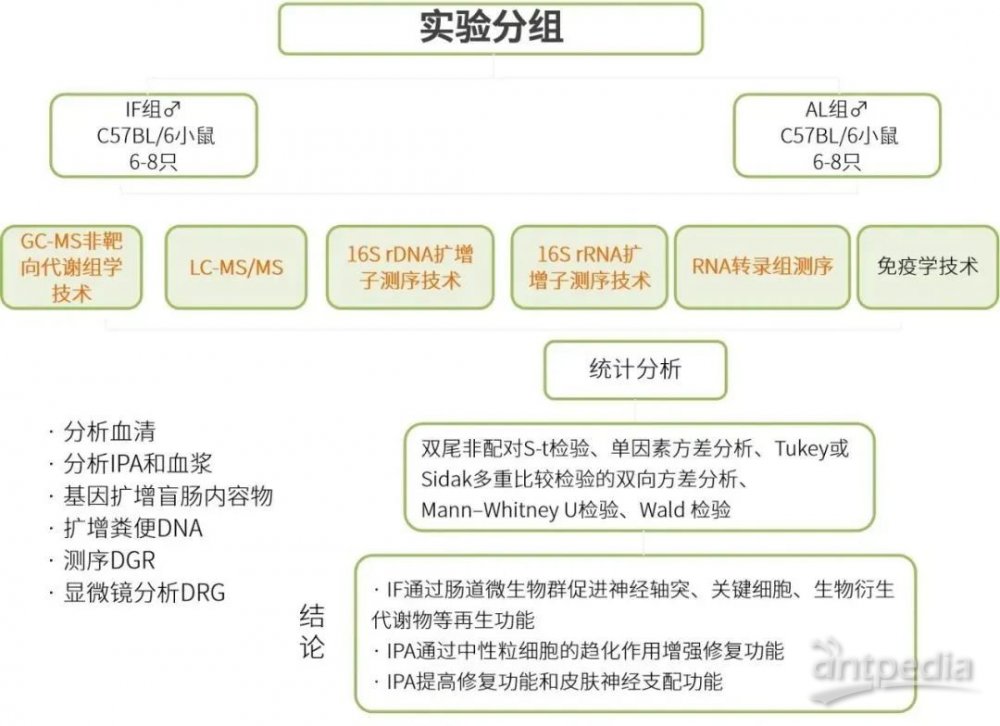
1. 实验分组
IF组:C57BL/6小鼠,6-8只,雄性
AL组:C57BL/6小鼠,6-8只,雄性
2. 技术路线
GC-MS非靶向代谢组学:分析血清
LC–MS/MS:分析IPA和血浆
16S rDNA扩增子测序:盲肠内容物
16S rRNA扩增子测序:粪便DNA
RNA转录组测序:DGR样本
免疫组织化学和免疫细胞化学:采用显微镜分析DRG,计数每个区域的细胞数量,测量背景强度或计算阳性染色的细胞百分比
3. 统计分析
双尾非配对S-t检验、单因素方差分析、Tukey或Sidak多重比较检验的双向方差分析、Mann–Whitney U检验、Wald 检验
研究结果
1. IF通过肠道微生物群促进的再生功能
SNC造模72小时后,与AL喂养组相比,IF喂养组的坐骨神经轴突再生速度显著更快(图1a-c和扩展数据图1a-c)。IF并未改变轴突再生的关键细胞(如施万细胞和巨噬细胞),也没改变DRG中的神经营养因子浓度。由此推测,施万细胞、巨噬细胞和神经营养因子并未在IF促进轴突再生的过程中发挥关键作用(扩展数据图1d-k)。
IPA是唯一受万古霉素显著影响的代谢物(图2e-k和扩展数据图2g-j)。使用万古霉素显著降低了革兰氏阳性菌(双歧杆菌、乳杆菌和生孢梭菌等能产生吲哚代谢物)的丰度,减少小鼠肠道菌群的多样性(扩展数据图3a-c和补充数据2-3),IF促进轴突再生的能力也被削弱。双向结果均提示革兰氏阳性菌可能是IF促进轴突再生的关键所在。为证实万古霉素对IF依赖性途径的影响,采用了Piphillin软件进行基因组数据预测(扩展数据图4和补充数据4)。色氨酸合成酶(TrpA)的IF依赖性富集,是将吲哚-3-甘油磷酸转化为吲哚(补充数据4),而万古霉素则是消除了这种富集。
2. IPA通过中性粒细胞的趋化作用增强修复功能
万古霉素的介入导致革兰氏阳性菌耗竭。C.s.fldC菌株或C.s.野生型(WT)菌株对肠道进行重新克隆,观察72h后SNC轴突再生情况(图3a-d)。用C.s.fldC重新克隆的小鼠血清,因为去除了IPA,导致轴突再生显著减少(图3b-d)。
每天灌胃20mg/kg IPA,显著增加了坐骨神经的轴突再生(图3e-h),而低剂量的IPA(10mg/kg)却不影响坐骨神经轴突的再生功能(扩展数据图5a-c)。血清和DRG的时间生物利用度曲线显示,12h内采集的IPA持续增加20 min。灌胃后1 h和6 h,DGR中的IPA浓度仍较高(扩展数据图5d-e)。腹腔注射给药IPA,评估SNC 72h后的轴突再生情况,发现血清中的IPA引起了神经元的增加和生长(扩展数据图5f-h)。
差异基因表达分析表明,IPA影响了DRG基因表达程序(扩展数据图6a-c)。编码IPA核受体PXR(Nr1i2)的基因表达增加(扩展数据5)。特别是IPA影响了与免疫调节基因本体(GO)类别相关的基因,其中最显著的是中性粒细胞趋化性(图4a-b)。IPA选择性上调Cd177和Cxcl1,可能是通过CXCR2的介导,而促进中性粒细胞向DRG趋化。IPA治疗增加了DRG组织内的中性粒细胞数量,但在神经挤压部位没有增加(扩展数据图6d-k和扩展数据图7)。接受IPA的小鼠和对照组小鼠的免疫细胞数量没有差异(扩展数据8)。用抗Ly6G单克隆抗体去除中性粒细胞,显著减少了IPA介导的轴突再生(扩展数据图7和9a-k)。值得注意的是,PXR缺失减少了中性粒细胞的数量和IPA依赖性再生,其程度与抗Ly6G单克隆抗体相似(扩展数据图9j-n)。
中性粒细胞可能是被CXCL1受体CXCR2的介导机制所激活(扩展数据图10a-b)。而抗CXCR2单克隆抗体,则损害了IPA依赖性的再生(图4c-g和扩展数据图10c-d)。
RNA转录组测序发现,DRG中IPA依赖的干扰素γ (IFNγ) 信号通路增加 (扩展数据图11)。为促进DRG神经元再生生长,可体内注射IFNγ(扩展数据图11d-e)。IFNγ 在DRG神经元胞体中表达,但在轴突中不表达。体内单独传递IFNγ可以增加DRG中几种再生信号的表达(扩展数据图11h-k)。
3. IPA提高修复功能和皮肤神经支配功能
通过热刺激反应评估生理感觉功能的恢复,机械性异常疼痛,可能是表皮神经支配不良的后果(图4g-j)。通过解剖观察,热伤害后,IPA不诱发坐骨神经损伤后的机械性异常疼痛,可通过改善表皮神经支配而诱导感觉功能的恢复(图4k-m)。
相关讨论
间歇性禁食(IF)促进小鼠坐骨神经挤压后的轴突再生,这种机制依赖于革兰氏阳性肠道微生物组和血清中肠道细菌衍生代谢物吲哚-3-丙酸 (IPA) 的增加。芽胞杆菌产生的IPA是有效的轴突再生必需物,在坐骨神经损伤后递送IPA,显著增了强轴突再生,加速感觉功能的恢复。坐骨背根神经节的RNA转录组测序分析表明,中性粒细胞趋化性在IPA依赖性再生表型中起了作用,并通过抑制中性粒细胞趋化得到证实。人体肠道菌群中也存在着生孢梭菌及其代谢物IPA,但这一机制对人体的适用性,仍需临床试验研究。
研究结论
革兰氏阳性肠道菌群生孢梭菌及代谢物吲哚-3-丙酸(IPA),通过免疫介导促进小鼠坐骨神经损伤后的神经轴突再生和感觉功能的恢复。间歇性禁食(IF)能够改变肠道菌群活性,促进IPA的产生并影响机体新陈代谢,而促进神经轴突再生、加速感觉功能恢复。
本篇文章运用通过GC-MS非靶向代谢组学、LC-MS/MS、16S rDNA扩增子测序、RNA转录组测序、免疫学揭示了间歇性禁食(IF)促进神经再生的潜在机制,及肠道菌群干预轴突再生的机制。通过对IPA的进一步研究,为细菌代谢物治疗神经性疾病及相关疾病奠定了基础。
参考文献
1.Scheib, J. & Hoke, A. Advances in peripheral nerve regeneration. Nat. Rev. Neurol. 9, 668–676
(2013).
2. Ferguson, T. A. & Son, Y. J. Extrinsic and intrinsic determinants of nerve regeneration. J. Tissue
Eng. 2, 2041731411418392 (2011).
3. Hutson, T. H. et al. Cbp-dependent histone acetylation mediates axon regeneration induced
by environmental enrichment in rodent spinal cord injury models. Sci. Transl. Med. 11, eaaw2064 (2019).
4. Mattson, M. P., Moehl, K., Ghena, N., Schmaedick, M. & Cheng, A. Intermittent metabolic switc-
hing, neuroplasticity and brain health. Nat. Rev. Neurosci. 19, 63–80 (2018).
5. Longo, V. D. & Mattson, M. P. Fasting: molecular mechanisms and clinical applications. Cell Me-
tab. 19, 181–192 (2014).
猜你还想看
1、8月“稳” | 恭喜鹿明生物蛋白代谢16篇项目文章发表,总IF:100+
2、Nat Med 新作|Olink蛋白质组学助力化疗免疫治疗一线转移性胰腺癌多组学免疫分析
3、项目文章 | 上海农科院林果所叶正文团队用iTRAQ蛋白质组学探究蟠桃果实内部褐变机制
4、Cell背靠背 | 重大突破!2篇Cell研究人类脑部肿瘤的免疫细胞图谱!
END
小妮子|撰文
小久|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点击“阅读原文”了解更多
04-12
技术分享 | 一文了解物理吸附与化学吸附的含义与异同04-12 安东帕康塔
展会预告|与您相约 CIBF@重庆04-12
行业应用 | 如何利用滤光箔片拓展的密度计测量光固化样品04-12 Anton Paar China
邀请函 | 安东帕MCR流变仪用户培训会_北京04-12
GC色谱柱垫圈选择指南04-11 珀金埃尔默
科研赋能:SP-ICP-MS与SC-ICP-MS技术的焕新升级之旅04-11 珀金埃尔默
国产光谱仪器与应用技术研讨会在海光公司成功召开04-11
海光邀您参加第十七届中国科学仪器发展年会(ACCSI 2024)04-11
让数据可控可计量 | 广电计量正式立项《数据资源控制及资产辨认的计量要求》团体标准04-11
质谱成像前沿探秘:专访再帕尔·阿不力孜教授与贺玖明研究员04-11 飞飞
邀您相聚金陵,聚焦合成生物学前沿分析技术04-11
环丙基的妙用大盘点:别只知道是麻醉剂!04-11
【邀请函】默克与您相约济南CPQC04-11
精美礼品等你来领!默克色谱柱使用者福利来啦04-11
爱色丽彩通x琅世 | 共启饰面行业色彩标准化新篇章04-11 爱色丽彩通
以旧换新 | eXact 2系列便携式色差仪产品升级优惠!04-11 爱色丽彩通
展会预告 | 爱色丽彩通诚邀您莅临2024 CHINAPLAS04-11 爱色丽彩通
直播报名 | eXact2新测量技术及应用场景全览04-11 爱色丽彩通
华西口腔岛津合作实验室:先进技术全面支持 口腔医学卓越发展04-11 分析测试百科网















