Cell背靠背 | 重大突破!2篇Cell研究人类脑部肿瘤的免疫细胞图谱!
2022-09-06 09:06:51, 多层组学定制服务 上海欧易生物医学科技有限公司

前言
脑恶性肿瘤发生在中枢神经系统内(胶质瘤),也可从中枢神经系统的其他部位浸润身体(转移)。高度免疫能抑制肿瘤微环境(TME),影响脑肿瘤生长。TME主要是由中枢神经系统微血管形成还是由恶性肿瘤本身形成及中枢神经系统肿瘤相关巨噬细胞(TAMs)的多样性、起源和功能尚不清楚。
Cell背靠背,两项脑恶性肿瘤研究成果发表在Cell上,来自路德维希癌症研究中心(Ludwig Cancer Research)和苏黎世大学(UZH)及苏黎世大学医院(USZ)的研究人员分别对脑瘤中的免疫细胞的类型、位置、功能等信息进行了详细分析,结果表明不同来源、不同种类甚至同一种类但不同级别的脑瘤中的免疫细胞种类、位置和功能等存在着巨大的差别,这为不同脑瘤的个性化治疗提供了基础和指导。
第一项研究中,来自路德维希癌症研究中心(Ludwig Cancer Research)的研究人员通过全面的对比分析,描述了大脑中出现的肿瘤(即胶质瘤)和从肺、乳房和皮肤转移到大脑的肿瘤的不同的免疫学特征。研究人员详细分析了肿瘤微环境(TME)中的不同免疫细胞的功能、位置和特征,这些免疫细胞抑制了免疫攻击、支持癌细胞生长并促进了癌症进展。

在第二项研究中,苏黎世大学(UZH)和苏黎世大学医院(USZ)的一组研究人员在Cell期刊发表的题为 “ Single-Cell Mapping of Human Brain Cancer Reveals Tumor-Specific Instruction of Tissue-Invading Leukocytesx”的研究成果,通过对脑癌组织的单细胞绘谱分析也发现了不同类型的脑瘤中不同的免疫细胞。这些非常精确的"肿瘤图谱"对于更好地了解肿瘤中的个体免疫成分和开发激活免疫防御反应的靶向免疫疗法是至关重要的。
文章通过高维单细胞质谱流式分析技术(CyTOF)、免疫荧光成像和RT-PCR等绘制脑肿瘤白细胞,选用免疫治疗方法研究脑肿瘤中TME内的免疫细胞,为进一步探索不同类型脑肿瘤中TME内的免疫细胞组成及免疫治疗结果提供参考。

本篇小鹿重点针对第2篇研究做重点分析,了解CyTOF单细胞质谱流式分析技术的具体应用实例:
研究方法
·纳入38例接受神经手术切除的胶质瘤、脑转移及癫痫(对照)患者的新鲜手术切除组织;
·质谱流式分析脑组织免疫细胞构成,并对总体免疫细胞水平进行多维评分(MDS);
研究结果
1. 流式细胞术揭示了脑肿瘤的白细胞组成
从38名接受神经外科手术的患者身上采集新切除的组织,用于淋巴瘤、BrM(转移性黑色素瘤、非小细胞肺癌和其他肿瘤)和癫痫治疗(图1A)。TME中设计两个CyTOF面板,单细胞水平上测量74个参数。第一个小组(图S2),结合抗体捕捉大脑TME中吞噬细胞的全谱,绘制主要白细胞群及其相对细胞频率。第二个小组是以淋巴为中心(图S3),研究淋巴隔室。
为了观察从不同脑肿瘤样本中分离的免疫群体,创建二维图进行观察(图1C、S2A)。免疫细胞图谱中,包括中枢神经系统驻留和入侵的TAMs/单核细胞、中性粒细胞、两个树突状细胞亚群、T细胞、自然杀伤细胞、B细胞和浆细胞(图1C-D)。癫痫非肿瘤对照的IDH1mut或IDH1wt胶质瘤中,TAM和单核细胞占白细胞的80%(±18%),而T细胞仅占13%(±10%)(图1E、S2B)。
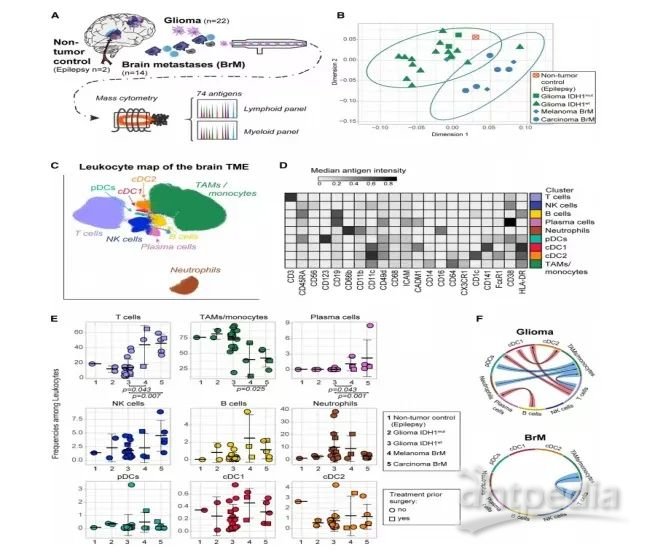
图1 | 流式细胞术揭示了脑肿瘤白细胞组成的独特变化
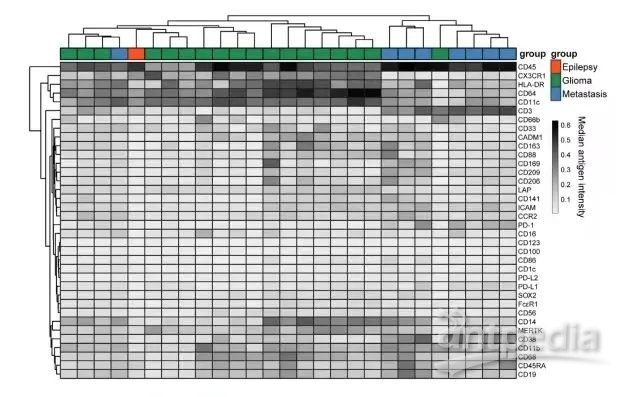
图S1 | 与图1相关,骨髓组中所有标记物表达的平均热图

图S2 | 与图1相关
中枢神经系统内的TAM可能来源于中枢神经系统内的小胶质细胞或来自侵入TME并转化为MDM的血源性单核细胞。FlowSOM用于TME和非肿瘤对照中CD64+、CD11c+、CD11b+、CD1c和CD66b细胞的鉴定。流式细胞仪测量CD11b+CD11c+CD66b-,将FACS数据叠加到CyTOF数据的参考图上,数据证实了细胞因子群体的表型和频率,并将CD49d和P2Y12进行分类(图2C-D)。为了表达CD49d,采用神经胶质瘤临床前模型结合遗传命运图Sall1进行表达。图谱将小胶质细胞(Sall1YFP- CD49d+)从其他吞噬细胞(Sall1YFP-CD49d+)和入侵的吞噬细胞中分离出来,并证实CD49d在CNS侵入的吞噬细胞(MDM)中优先表达(图2E)。
胶质瘤TME主要包含起源于小胶质细胞的TAM,而BrM具有更高的MDM侵袭性。IDH1mut胶质瘤的TME巨噬细胞组成与癫痫病例没有显著差异。单核细胞在所有样本中都以类似的低频率存在(图2F-G)。根据数据表明, IDH1mut肿瘤的TME主要由小胶质细胞来源的TAM控制。IDH1wt胶质瘤显示MDM TAM的侵袭性增加,与MGMT启动子的甲基化状态无关(图S3B)。

图2 |脑TME含有异质性单核吞噬细胞群

图S3 |与图2相关
2. TAM是由肿瘤类型驱动的,而不是局部组织微环境
通过Iba1和CD163的脑切片共同染色证实了,IDH1wt胶质母细胞瘤和BrM中与肿瘤相关的小胶质细胞的“反应性”表型。IDH1mut胶质瘤中的小胶质细胞的HLA-DR表达与IDH1wt胶质瘤、BrM中的小胶质细胞相似(图3A-B)。而IDH1wt弥漫性星形细胞瘤中的小胶质细胞保留了分支形状(图S4A)。利用Vortex建立力向图,用于绘制单核细胞/MDM图表与神经胶质瘤和BrM。单核细胞/MDM分化特征是CCR2和CD33下调,CD163和Mertk上调(图3C)。
FlowSOM分析四个MDM簇和一个单核细胞簇,通过IDH1mut和IDH1wt胶质瘤的MDM/单核细胞与黑色素瘤和癌BrM比较,以分析不同的MDM亚群轨迹和相对频率(图3D-E)。IDH1mut胶质瘤TME中侵入中枢神经系统的吞噬细胞主要由单核细胞和低频率的MDM组成,单核细胞向MDM的转变是取决于TAM室的肿瘤特异性,而不是中枢神经系统组织内单核细胞的行为(图3F-G)。

图3 | TAM指令由肿瘤类型而不是局部组织微环境驱动
采用标记物Iba1结合CD163或P2RY12来区分Iba1+CD163+MDMs和Iba1+CD163- 和Iba1+P2Y12+小胶质细胞(图4A-B、S4A)。Iba1+CD163 小胶质细胞弥漫分布于整个胶质瘤中,但通常局限于肿瘤边缘区域, BrM中不存在于肿瘤核心。此外,Iba1+CD163+MDMs和MDMs的CD206+、CD169+、CD209+亚群与胶质瘤和BrM中VE-cadherin阳性血管非常接近(图4B、S4A-D)。
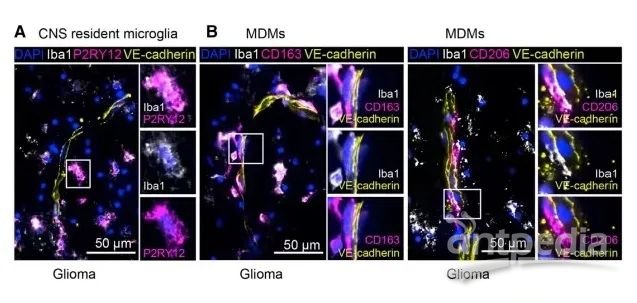
图4 |中枢神经系统驻留和入侵巨噬细胞的原位定位
通过测定TCGA-GBM数据库(多形性胶质母细胞瘤)中小胶质细胞标记物CX3CR1和MDM标记物CD163的表达水平,发现与小胶质细胞标记物相比,MDM标记物CD163CX3CR1与OS呈负相关(图5A)。为进一步确定TAM是否改善与临床疾病发展和生存的相关性,分析了小胶质细胞的特征表达(ITGAX(CD11c)、FCGR1A(CD64)、CX3CR1、TCGA-LGG和TCGA-GBM数据库中的P2RY12(P2Y12)和OS,结果显示没有任何相关性(图5B-C)。然而,MDMs不同基因特征却表明了MDM2/3 中的CD163、MRC1(CD206)、CD14和CD68与患者生存率的正相关性(图5D-E)。

图5 |胶质瘤患者的总体生存率与MDM特征的存在相关
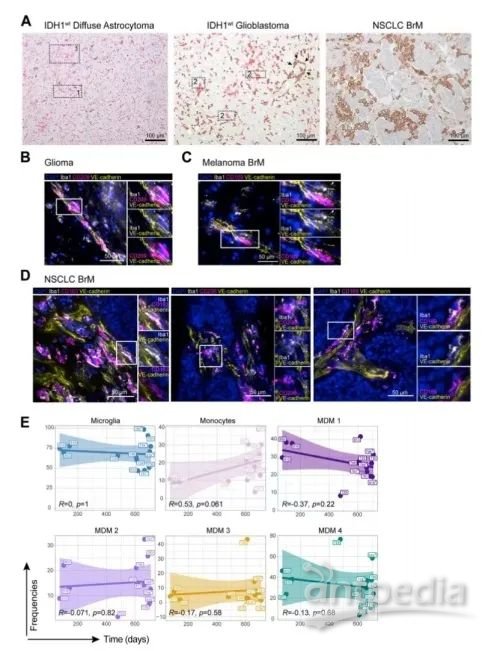
图S4 |与图4、5相关
除中枢神经系统驻留和入侵的巨噬细胞外,发现了脑TME中TAM亚群的多样性。我们认为,TAM在TME中发挥着独特的作用,在所有脑肿瘤类型的表型、定位以及与临床结果的相关性方面都存在很大差异。胶质瘤中以常驻吞噬细胞为主,转移性脑TME中以侵入吞噬细胞为主。
3. Tregs积累和T细胞衰竭是脑转移瘤TME的特征
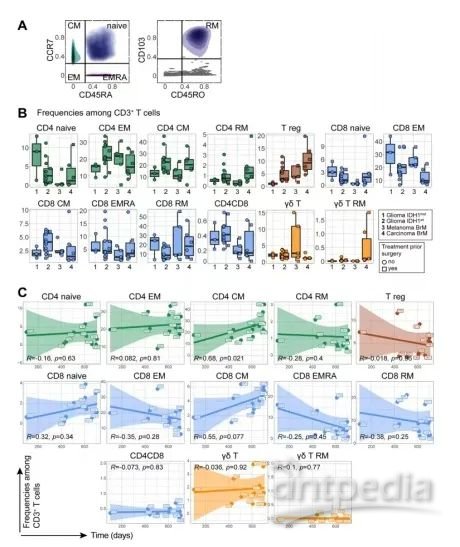
以淋巴小室为重点的细胞因子,鉴定了几种TIL表型,并描述了它们在胶质瘤和BrM中的激活状态。t-SNE和FlowSOM聚类的基础上,识别了CD4(CD3+CD4+FoxP3-)和CD8(CD3+CD8+)T细胞,Tregs(CD3+CD4+FoxP3+CTLA4+)、γδT细胞(CD3+TCRγδ+)、NK细胞(CD56+)、B细胞(CD19+CD20+)和浆细胞(CD19+和CD38high)(图S5A-C)。说明,原发性胶质瘤和转移性样本之间所有淋巴细胞和样本的相对频率具有可比性(图6A、S5D)。另外,没有观察到与MGMT启动子甲基化状态相关的淋巴细胞的频率变化(图S5E)。与IDH1mut相比,IDH1wt胶质瘤具有更高的Tregs频率。BrM中Tregs的相对频率最高,尤其是在癌TME中(图6A)。
T细胞存在于胶质瘤的TME和BrM之间,总的T细胞数相对频率没有显著差异。但在IDH1wt胶质瘤患者中,CD4-CM和CD8-CMT细胞频率与OS/随访天数呈正相关(图S6 B-C)。对其他T细胞标记物的进一步分析表明,共刺激受体(ICOS、CD27和CD137),共抑制受体(2B4、TIGIT和PD-1),黑色素瘤BrM中RM和EM CD8 T细胞的激活标记物CD38、效应物(CD57和颗粒酶B)增殖功能(Ki-67)(图6B-C、S7A)。与DH1wt胶质瘤相比,IDH1mut胶质瘤中的CD8 RM和EM T细胞的增殖和激活标记物表达较低。
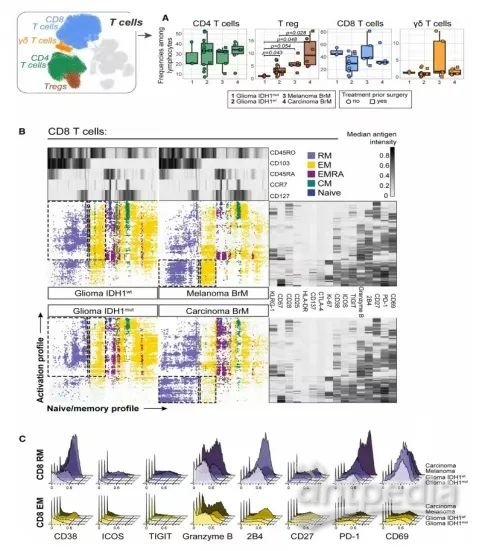
图6 | Tregs聚集和T细胞衰竭是脑转移瘤TME的特征

图S5 |与图6相关
图S6 |与图6相关
数据表明IDH1wt胶质瘤和BrM TME中Tregs的积聚,其中在癌BrM中的频率最高。在IDH1wt胶质瘤中,TME中CD4-CM和CD8-CM的积聚可能是更好的OS预后指标。分析标记显示EM和RM具有独特的表型特征CD8 T细胞。转移性TME由激活/耗尽的T细胞,而胶质瘤样本则显示出较低的水平激活标志物的表达。
4. 未成熟的NK细胞在胶质母细胞瘤中积聚
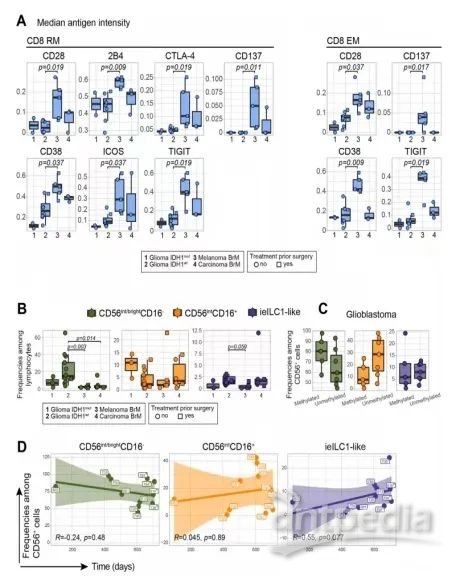
在CD56int/brightCD16+ 细胞中,发现了大量CD69+CD103+CD56+细胞,它们与上皮内ILC1样细胞(即ILC1样细胞)非常相似(图7A)。在IDH1wt胶质瘤中,观察到淋巴细胞中富集未成熟的CD56int/brightCD16+ NK细胞,而在IDH1mut胶质瘤和BrM中,主要是CD56int/brightCD16+ NK细胞(图7B、S7B)。根据MGMT启动子的甲基化状态进一步分析IDH1wt胶质瘤,CD56int/brightCD16+NK细胞的比例有增加的趋势(p=0.1)(图S7C)。对患者的CD56int/brightCD16+分析显示,BrM中2B4、CD38和Ki-67的趋势更高(图7C和7D)。IDH1wt胶质瘤中的CD56int/brightCD16+通过CD57和TIM3的表达进行区分,后者也在IDH1mut胶质瘤中观察到。
综上所述,NK细胞谱显示出肿瘤特异性,通过浸润性细胞毒性和未成熟NK细胞的比例突出显示。此外,也观察到了胶质瘤和BrM之间浸润的CD56int/brightCD16+ NK细胞的异质性。

图7 |未成熟NK细胞在胶质母细胞瘤中积聚
图S 7 |与图6、7相关
相关讨论
研究发现,脑肿瘤类型揭示了中枢神经系统驻留和入侵白细胞群的主要变化。同时发现胶质瘤TME中有大量的常驻吞噬细胞,不是由作为“免疫特权生态位”的中枢神经系统形成。IDH1mut、IDH1wt胶质瘤和BrM轴的骨髓源性浸润(如MDM和T细胞)持续增加,并增加了中枢神经系统驻留细胞(如小胶质细胞)在胶质瘤对应物中的优势。
研究讨论
通过对不同类型脑肿瘤内的免疫细胞进行单细胞质谱流式分析技术,确定脑肿瘤的TME的免疫细胞差异主要是由特定的肿瘤类型所决定。调节性T细胞(Tregs)的积累和T细胞的耗竭是脑转移瘤TME的特征。在IDH1突变型、IDH1野生型神经胶质瘤和BrM的免疫细胞变化轴上,来源于骨髓的MDM和T细胞延续增加;并且在神经胶质瘤中,CNS的残存细胞,如小胶质细胞的比例不断提升。自然杀伤细胞(NK)的细胞谱也显示肿瘤的特异性。
小鹿推荐
本篇文章通过CyTOF绘制脑肿瘤的白细胞分布图谱,显著区分脑胶质瘤和脑转移瘤,同时显示出肿瘤相关巨噬细胞(TAM)的特征。脑肿瘤TME的特定免疫标记是合理设计靶向免疫治疗的关键步骤,不仅促进了靶向免疫治疗的进一步研究,也为脑肿瘤的深入研究提供参考。
现鹿明生物推出质谱流式单细胞蛋白质组技术服务,在推出基于布鲁克tims TOF Pro2 4D蛋白质组质谱平台的单细胞蛋白质组后,再度推出基于质谱流式平台的新一代高通量单细胞蛋白质组技术服务。 鹿明生物引进Starion®星瀚质谱流式系统,具有高通量高分辨率超高速的特点,可实现在单细胞分辨率下同时对数十种目标蛋白的深度分析。进一步丰富鹿明生物单细胞多组学技术服务产品线,为科研工作者提供全面深入的科研技术服务。

参考文献
1.Aldape, K., Brindle, K.M., Chesler, L., Chopra, R., Gajjar, A., Gilbert, M.R., Gottardo, N., Gutmann, D.H., Hargrave, D., Holland, E.C., et al. (2019). Challenges to curing primary brain tumours. Nat. Rev. Clin. Oncol. 16, 509–520.
2.Amankulor, N.M., Kim, Y., Arora, S., Kargl, J., Szulzewsky, F., Hanke, M., Margineantu, D.H., Rao, A., Bolouri, H., Delrow, J., et al. (2017). Mutant IDH1 regulates the tumor-associated immune system in gliomas. Genes Dev. 31,774–786.
3.Amit, M., Laider-Trejo, L., Shalom, V., Shabtay-Orbach, A., Krelin, Y., and Gil,Z. (2013). Characteri-
zation of the melanoma brain metastatic niche in mice and humans. Cancer Med. 2, 155–163.
4.An, J., Wang, L., Zhao, Y., Hao, Q., Zhang, Y., Zhang, J., Yang, C., Liu, L.,
Wang, W., Fang, D., et al. (2017). Effects of FSTL1 on cell proliferation in breast cancer cell line MDA-MB-231 and its brain metastatic variant MDA-MB-231-BR. Oncol. Rep. 38, 3001–3010.
5.Bastian, M., Heymann, S., and Jacomy, M. (2009). Gephi: An open source software for exploring and manipulating networks. ICWSM 8, 361–362.
猜你还想看
1、Nature Medcine | IF: 87.241哥本哈根大学基于特定IHD微生物组和代谢组特征鉴别探索心脏代谢疾病机制
2、项目文章 | 南京大学赵丽娟课题组探究银纳米离子对水稻代谢谱、产量、土壤微生物群落的影响
3、Cell亮点:CyTOF单细胞质谱流式“撞见”COVID-19,科学家解释T细胞毒性加剧COVID-19重症风险
4、项目文章 | 中山大学附属第六医院研究团队运用多组学技术揭示剖宫产瘢痕憩室中宫颈微生物群与宿主基因调控的相互作用
06-28 德国耶拿
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
精准科仪 高效分析 | 福立2024气相色谱技能培训会·第一期成功举行!06-27 福立仪器
ICP-OES直接分析95%乙醇样品中的As、Cd、Pb、Sb迁移量06-27 德国耶拿
好礼来袭 | 分享您身边的特洁安身影06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
"全民禁毒宣传月,普立泰科亮神器!"06-26 普立泰科
高分离 高灵敏 高通量——福立液相LC5190重新定义分离需求06-26 福立仪器
医药行业指南:电位滴定仪选型攻略来啦~06-26
屹路同行 悦启新程06-26 屹尧科技
徕卡精准空间生物学解决方案 第四弹06-26 童昕、南希
【直播预告】第一届大湾区生物电镜制样讲习班06-26 徕卡显微系统
徕卡常规显微镜历经严苛的ISO9022标准测试06-26 徕卡显微系统
Viventis LS2 Live 光片显微镜发布会06-26 徕卡显微系统
前沿应用 | 经皮无创血糖检测中葡萄糖拉曼峰直接观测06-26 鉴知技术