一次读懂qPCR结果中的质控(Quality Control)
2023-03-24 13:22:22, 马克 赛默飞世尔科技生命科学产品
作为技术支持,在日常的工作中经常会遇到客户咨询:
我的qPCR结果中为什么有一个黄色的三角(图1),里面还有1,2,3,4这些数字,它们代表的含义是什么?
有这些提示的存在,会影响我的实验结果吗?我的结果还可信吗?
那么我又应该如何避免这些黄色三角提示呢?
今天,小编就和大家一起来聊一聊如何查看qPCR结果分析中的质控(Quality control ;QC),不同的质控提示代表的含义以及在平时的实验中如何减少/避免这些提示(本文主要以我们公司Applied Biosystems™品牌的常用机型 7500系列、QuantStudio系列以及StepOne / StepOne Plus系列为主)。
我们都知道,qPCR作为一种简单高效的定量方法,可以用于样本浓度定量、拷贝数定量、基因表达定量、熔解曲线、SNP分型分析等。正如我们日常购买的商品出厂前都要经过质检,我们ABI品牌的qPCR仪器自带的分析软件也对每次的实验结果有着一系列的质控参数,这些质控参数能够帮助我们更好的去判断和分析在加样、试剂、耗材、扩增反应以及仪器状态等方面是否存在异常。
接下来给各位老师介绍如何查看本次实验中存在哪些质控信息,以StepOne Plus仪器的一次结果为例,在结果分析界面,我们可以看到如图1所示,96个孔中都标记了黄色三角,里面标记的数字有的是“1”,有的是“2”,随后我们在Analysis 界面上
图1:在qPCR的结果分析界面,我们通常能看见样本孔中有黄色的三角提示,上面分别写有1、2、3的字样。

图2:StepOne Plus仪器上何查看本次实验质控提示的操作步骤(7500、QuantStudio 6/7 系列仪器查看方式类似)。
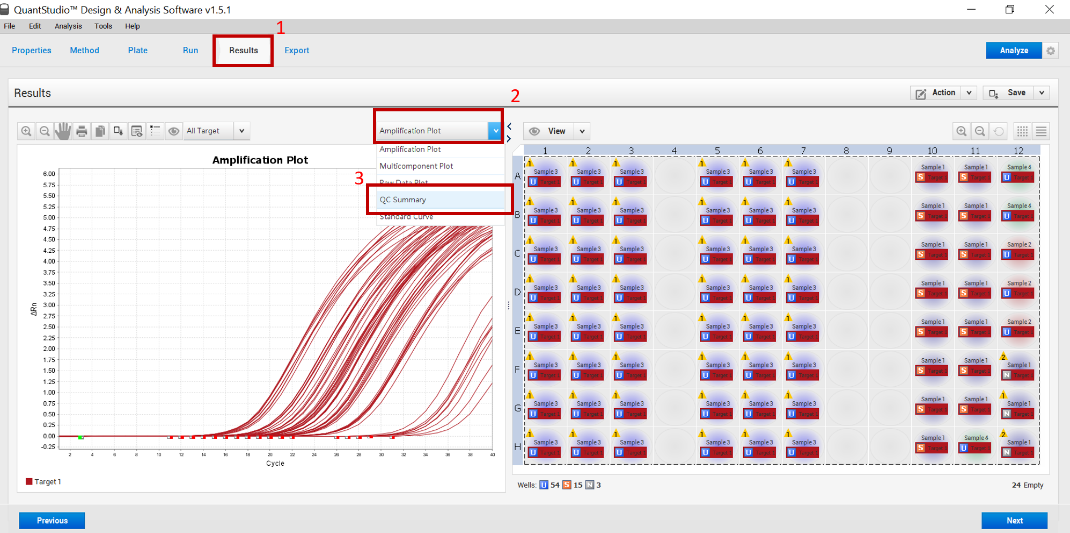
图3:QuantStudio 1/3/5分析软件上查看本次实验质控提示的操作步骤
接下来和大家聊一聊不同报错提醒的含义、存在的原因以及如何减少/避免。初步统计,我们一共有17种不同类型的质控提示,下面分别进行介绍:
01
AMPNC: Amplification in negative control,通过字面意思我们可以清楚的知道质控提示是因为阴性对照存在扩增(图4,通常Ct< 35.0)。针对这种情况,我们需要首先确认该孔是不是真的是阴性对照孔,有没有存在标记错误或者加样错误等因素,其次我们要去查看扩增的荧光曲线是否正常,可以通过多组分图(Multicomponent plot)中的扩增结果确定目的基因是否有扩增(图5)。如果确认存在扩增,那么就说明我们的扩增体系中存在污染,污染的可能性包括但不限于扩增试剂污染、耗材污染、实验室气溶胶污染等,解决的办法就需要我们替换所有的实验试剂,实验耗材,对实验室台面和加样枪进行去污染处理以及去除实验室气溶胶污染。

图4:软件提示D9、D10作为阴性对照孔有扩增。
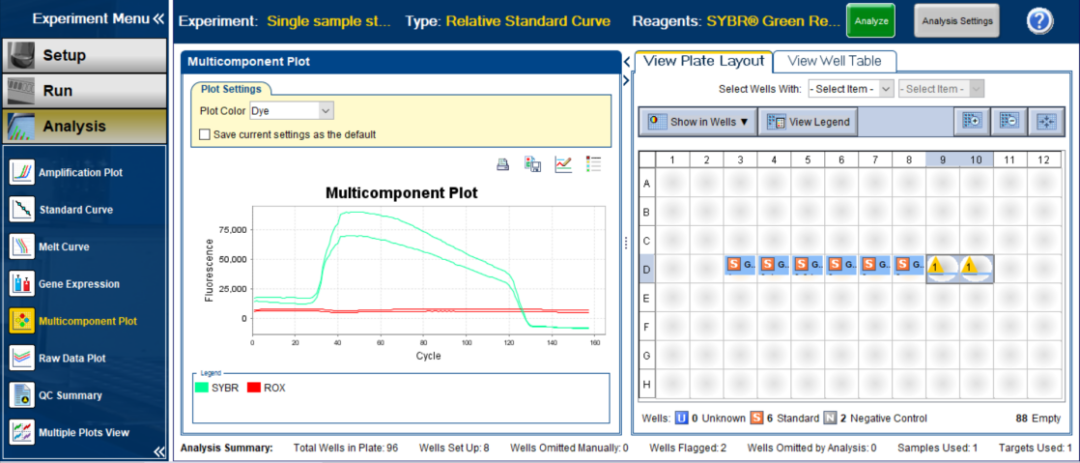
图5:经查看原始数据的多组分图,D9和D10孔确实是存在扩增,说明整个反应体系中有污染存在。
02
BADROX: Bad Passive reference signal, ROX作为参比荧光信号异常。Applied Biosystems™ 系列荧光定量PCR 仪器可以用ROX作为参比荧光染料,用以校正仪器系统以外的物理误差,比如均一化由于移液分装、蒸发、气泡导致的批内体积误差等。通常情况下,ROX作为参比荧光,在整个反应过程中荧光强度应该是保持不变的,因此,当反应扩增体系ROX 的荧光强度有明显的变化时(algorithm result > 0.6 ),就会提示该质控提醒。引起ROX信号波动的常见因素有:反应管体系配制后上机检测前没有充分的离心,管壁上可能有小液滴的残留,随着反应的进行,这些小液滴又回流到PCR管底,导致ROX信号的波动;反应管体系配制后有气泡存在,随着反应的进行,气泡在高温下破裂,该过程也会导致ROX信号的波动(如图6);封板膜或者管盖没有盖紧,导致反应过程中有体系的蒸发从而导致ROX信号的异常。如果这种提醒仅仅只是一两个孔存在,那么在我们实验中每个样本有足够重复的情况下可以选择“Omit”这些异常的反应孔,反之,则需要重新进行实验。
图6:由于反应体系中有气泡带来的荧光信号波动,QC summary中提示BADROX。
03
SPIKE:Noise Spikes,扩增曲线的荧光信号并不是常见光滑的 “S” 型曲线,这是由于相邻的两个或者多个荧光信号数据点由于荧光强度波动较大导致扩增曲线呈现 “锯齿状” 、 “波浪形”。通常情况下我们可以手动调节基线或者阈值线的位置进行重新分析,如果调整分析之后Cт值依旧异常,则可以选中该孔,
04
NOISE:Noise higher than others in plate,该提示意味着该孔在扩增过程中相较于其他样本孔存在较强的噪音信号。我们可以选中该孔,选择查看扩增图(Rn vs. Cycle and DRn vs. Cycle)和多组分图,以及与正常的样本扩增曲线进行比较查看。该提示的主要原因是因为反应体系中的扩增荧光信号或者参比荧光信号异常波动,波动的原因与上述“BADROX”中提到的原因相似,如果这种提醒仅仅只是一两个孔存在,那么在我们实验中每个样本有足够重复的情况下可以选择“Omit”这些异常的反应孔,反之,则需要重新进行实验,如果这种波动是在扩增的线性期或者平台期,一般情况下不会影响我们对Ct值的判读,则不需要重新进行实验(如图7)。
图7:由于荧光信号异常导致的NOISE提示(B7孔,橙色扩增曲线),和C6孔(绿色扩增曲线)相比,荧光信号的波动主要是位于扩增的平台期,一般不会影响我们对Ct值的判读。
05
OFFSCALE: Fluorescence is offscale, 荧光信号过强,超过了仪器的检测上限。出现这种提示的原因主要有以下几种情况:1. 反应体系中加入过量的引物、探针或者SYBR 染料,导致反应荧光强度过高而超过仪器的检测上限,这种情况我们可以通过减少引物、探针或者SYBR 的用量来解决;2. 某个孔报错提示为Offscale,这种情况大多是因为荧光物质污染了我们的反应板或者加热模块而引起的信号异常,需要我们对仪器进行背景校准,对仪器的加热模块进行清洁;3. 整个反应板都出现Offscale 提示,包括没有加样本的空孔,这种情况有可能是因为仪器光路采集系统有问题,需要联系我们的技术支持或者工程师进行判断、维护;4. 反应试剂中有其他的荧光物质干扰或者用了其他未校准的荧光染料 (图8)。

图8:客户使用仪器未预先校准的染料而导致仪器出现“Offscale”提示,右侧的荧光信号高达350万荧光单位。
图9:错误使用ROX浓度导致仪器出现“Offscale”提示, 在QuantStudio系列仪器上使用其他品牌的扩增试剂时,需要选用低浓度的ROX作为参比荧光。
06
HIGHSD:High standard deviation in replicate group,复孔之间的Cт值差异过大,此类型的质控提示是客户数据中常见的问题之一。通常我们的qPCR会针对每个样本进行3次以上的技术重复,根据每个复孔的Ct值计算出它们的标准差(Standard Deviation,SD),当复孔间的Ct值的标准差大于0.5时,软件就会提示“HIGHSD”。这种大部分情况都是由于实验操作不规范引起的,主要的原因包括:扩增体系配制之后,没有充分的离心,管壁上有小液滴的残留;反应的体系密封不当导致有蒸发;加样不准导致复孔间的反应体积不一样、某个复孔少加了某种反应试剂、配制好的扩增体系没有充分震荡混匀就分装到每个孔中以及模板质量不好,待测样本的浓度很低等因素(图10)。

图10:绝对定量实验时遇到复孔(E2,E3,E4)之间Cт值差异大,其中一个复孔的Cт值相较于另外两个复孔差异在3个Cт值左右,约等于10倍的浓度差异。客户每次配制体系都是用移液器吹吸混匀,怀疑是体系中试剂组分没有混匀导致的,遂建议采用斡旋震荡充分混匀、离心之后再分装到qPCR反应管中,解决了复孔间Cт值差异过大的问题。
07
NOAMP:No amplification,待测样本未扩增。当软件提示“NOAMP”时,我们要对该提示的反应孔进行查看确认,首先要确认该孔是不是我们的阴性对照孔,其次通过查看扩增图(Amplification plot)和多组分图(multicomponent plot)确认该孔是否有荧光信号的增加。如果个别孔存在“NOAMP”提示,有可能是因为样本本身质量不好或者浓度太低、或者是扩增的时候忘记加入某种组分导致扩增失败,这种情况就需要重新对该样本进行实验;如果本次实验包括阳性对照都出现未扩增的情况,那就要从试剂、扩增条件设置、以及仪器加热模块升降温是否正常等方面进行问题排查。
08
NOSIGNAL:No Signal in well,根据字面意思我们不难理解这个提示告诉我们这个孔信号极低或者没有信号。我们可以将该孔和其他正常样本孔同时选中,在多组分图中查看这两个孔的原始荧光信号强度,如果发现标记荧光和参比荧光都接近为零,且和未标记的孔相比,在ROX信号强度上表现出较大的差异,则说明该孔就是一个空的反应孔,里面并未含有扩增试剂(如图11);如果发现参比荧光信号和正常的反应孔强度相似,但是标记荧光未抬升(如图12),则说明该孔未发生扩增,需要去排查扩增失败的原因。
图11:H3孔多组分图中可以看出ROX和SYBR荧光信号都接近于零,说明该孔是空孔,不含有扩增试剂。

图12:G5孔和G6孔中,ROX参比荧光的信号强度类似,但是G5孔中的SYBR没有抬升,说明该孔未扩增,G6孔则是正常扩增。
09
OUTLIERRG:Outlier in replicate group,该项质控提示和上文讲到的 “HIGHSD” 类似,反应的也是样本技术重复之间的Cт值差异过大, 不同之处在于 “OUTLIERRG” 更偏向于说明在一组技术重复中存在某个复孔的Cт值偏离其他复孔的Cт 值,软件是根据改良后的格拉布斯(Grubbs)法进行判断,格布拉斯法是用于异常值判断的数学算法。具体是指在一组测量数据中,如果个别数据偏离平均值很远,那么这个(这些)数据称作“可疑值”。数据分析的时候可以将该“可疑值”从此组测量数据中剔除而不参与平均值的计算。图13中三个复孔的Cт值分别是: 25.94、25.96和25.17,经计算三个复孔之间的Cт SD值为0.45,尽管小于0.5,但是可以看出Cт值为25.17的样本孔结果明显偏离其他两个重复的Cт值,根据Grubbs 法进行判断之后,该值属于异常值,那么就建议客户在数据分析的时候将该值剔除从而确保结果的准确性。那么引起某个复孔Cт值偏差较大的原因有如下几种可能:1. 该反应孔内有污染,污染来源于耗材或者气溶胶等;2. 反应板密封不好,导致反应过程中扩增试剂有蒸发;3. 加样误差。
图13:D10、E10、F10是一个样本的三次技术重复,可以看到F10孔的Ct值为25.17。经过计算,属于异常值,因此软件提示OUTLIERRG。
10
EXPFAIL:Exponential algorithm failed,EXPFAIL表示指数期扩增失败,选中该孔,查看扩增图(Rn vs. Cycle and DRn vs. Cycle)和多组分图,以及与正常的样本扩增曲线进行比较查看。可能的原因有扩增太早、太晚、弱扩增或者无扩增,如果扩增曲线看上去没有太大的异常,我们也可以手动设置基线和阈值线,然后选择重新分析。图14和图15分别是扩增太弱或者扩增太早导致的EXPFALI,针对扩增太弱的样本需要加大反应模板的起始量或者优化反应体系;针对扩增太早的样本,通常是因为起始模板的浓度过高,建议稀释之后再重新进行实验。
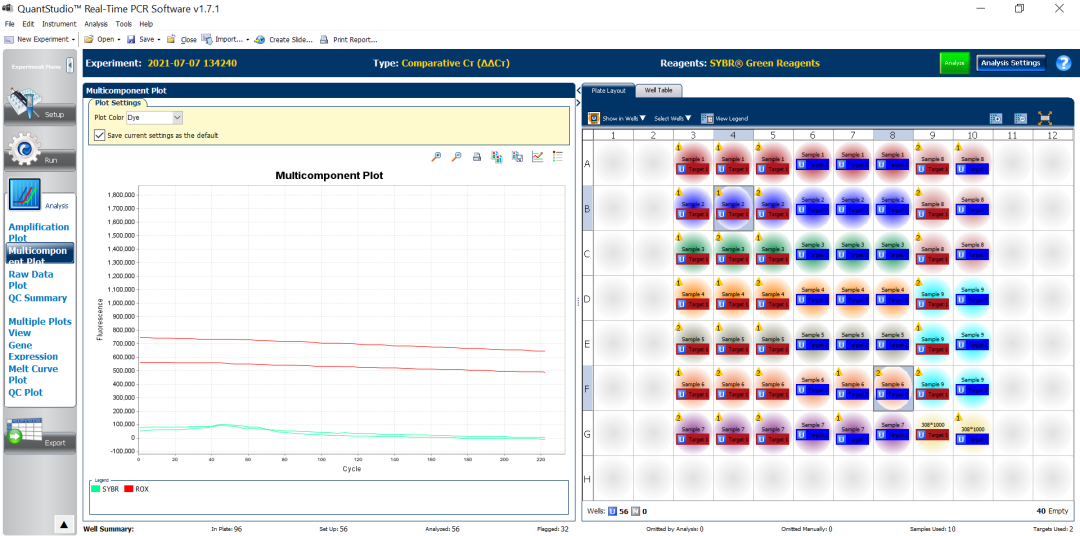
图14:由于扩增太弱导致软件提示EXPFAIL,从多组分图中可以看到SYBR的荧光信号没有明显的抬升。
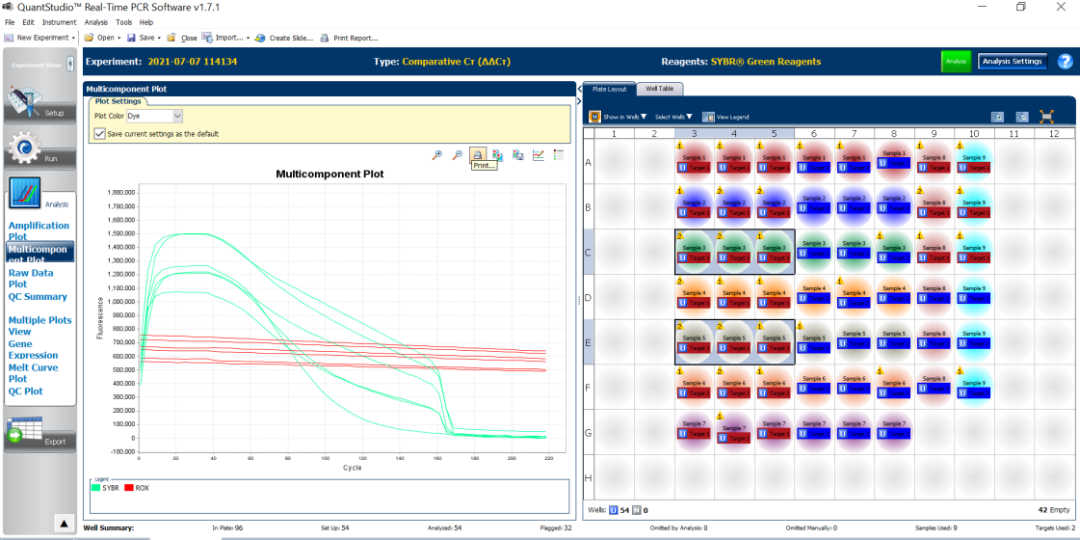
图15:扩增太早导致软件提示EXPFAIL,从多组分图中可以看到在扩增的早期SYBR的荧光信号已经开始抬升。
11
THOLDFAIL:Thresholding algorithm failed,默认条件下,定量PCR软件有自动设置基线和阈值线的功能,可以自动生成Cт值。这种计算方法得出的基线和阈值是建立在假设数据呈现出典型的扩增曲线的基础上。实验问题(例如污染、加样不准确、错误使用ROX参比荧光浓度(图16)等)会导致扩增曲线明显偏离正常的扩增曲线。这种情况下,软件自动设置基线以及阈值线的功能就会失败,需要手动调整基线和阈值线。如下的案例是在我们StepOne Plus仪器上进行的定量实验,实验结束后发现没有Ct值。经查看原始数据,在QC summary中有 “EXPFAIL”和“THOLDFAIL” 两种质控提示(图17)。查看扩增图和多组分图发现,本次实验中多数样本扩增很弱,这就导致我们的仪器在自动设置阈值线的时候就把阈值线设置的很低,Threshold 为0.0001(图18),这个时候需要我们手动调节阈值线,再重新分析即可。
图16:错误使用ROX浓度导致仪器质控提示:THOLDFAIL。我们可以选择取消“ROX”作为参比荧光,然后重新分析。
图17:StepOne Plus仪器上实验结束后,质控提示部分孔存在 “EXPFAIL” 和 “THOLDFAIL” 。
图18:从扩增图中我们可以看到,由于大多数样本没有扩增或者扩增很弱,导致软件自动设置的阈值为0.0001,这个时候需要我们手动调整阈值。
12
BLFAIL:Baseline algorithm failed,BLFAL表示软件的基线期算法失败。说明我们扩增曲线的基线期荧光信号异常,导致软件没有办法划分正确的基线起始点和终止点。以7500上的一次实验为例:客户反应部分样本没有Cт值,这些没有Cт值的样本均有提示 “BLFAIL” (图19),选中这些样本孔,查看多组分图发现这些没有Cт值的样本基线期荧光信号特别低,接近于0(图20)。正常来讲,反应体系中加了荧光染料,即使没有扩增也是有背景荧光的,这种背景荧光特别低的情况可能是客户使用了透光性不佳的耗材或者没有使用正确的反应适配器导致的,因此导致基线期荧光信号太低而基线期划定失败。

图19:部分样本显示“BLFAIL”,这种情况通常是由于使用了透光性不好的耗材或者没有正确的使用反应托架造成的。

图20:通过查看多组分图,这些孔基线期的荧光信号都在0以下,因此导致软件基线期 分析失败。
13
CTFAIL:Cт algorithm failed,CTFAIL表示软件Cт值计算失败,选中该孔,查看扩增图(Rn vs. Cycle and DRn vs. Cycle)和多组分图,以及与正常的样本扩增曲线进行比较查看。可能的原因有扩增太早、太晚、弱扩增或者无扩增,如果扩增曲线看上去没有太大的异常,我们也可以手动设置基线和阈值线,然后选择重新分析即可。
14
MTP:Multiple Tm peaks,有多个熔解-峰。选择SYBR染料法进行qPCR实验需要运行熔解曲线步骤以查看扩增产物是否单一。通常情况下,单一的熔解峰意味着扩增产物特异性好,而多个熔解峰就意味着有多个扩增产物。引起多个熔解曲线峰的原因有:1. 反应体系中有模板污染存在,需要我们更换试剂、耗材等并重新进行实验;2. 扩增试剂不稳定,例如使用的扩增酶不是热启动酶且体系配制好之后没有立刻进行PCR反应;3. 引物的特异性不好,导致扩增体系中有非特异性扩增或者引物二聚体,我们可以适当的增加退火温度看是否有改善,或者选择重新设计引物;4. PCR反应体系没有进行优化,包括引物浓度、酶浓度、Mg2+浓度、dNTP 浓度、Buffer的组分、反应体系的pH值、扩增的循环数等。此外,多色探针法熔解曲线,高分辨率熔解曲线(HRM)以及蛋白熔解曲线(PTS)实验,可能会涉及多个核酸产物/蛋白结构域,出现多个熔解峰通常是正常现象,忽略这个质控提醒即可。
15
CLUSTER# :Number of clusters outside expected range,这种提示通常在基因分型实验中会出现,主要原因是SNP分型实验需要根据扩增信号的强度通过聚类算法把样本分为野生纯合、杂合以及突变纯合,因此最后的分型应该有3簇,大于3簇或者小于2簇都会出现CLUSTER#提示。出现分簇失败的原因有:1. 检测的SNP次要等位基因频率(minor allele frequency ; MAF)太低,可以通过增加检测的样本量或者添加阳性对照来解决;2. 引物和探针的特异性不好,需要我们对探针或者引物序列进行优化;3. 反应中某个样本出现异常结果从而被单独的分为一个簇,这种情况下需要我们对该样本重新进行实验或者选择忽略(Omit)该样本然后重新分析。
16
PCFAIL:Positive control failed,阳性样本分型失败,这种提示只有在基因分型实验中出现,PCFAIL意味着在SNP分型实验中我们的阳性参照样本基因型和我们最终实验呈现的基因型分类结果不一致。这种情况主要有以下几种原因:1. 设置实验时错误设置了阳性样本的报告基团(例如:将FAM信号标记成了VIC信号),这种情况下我们可以在实验结束之后在plate setup里重新更改报告基团的类型,然后选择重新分析即可;2. 确定是否有加错阳性样本;3. 确认阳性对照的基因型是否正确;4. 反应体系中存在探针的非特异性结合,需要对引物/探针进行优化。
17
SMCLUSTER:Small number of samples in cluster,该质控提示只存在于基因分型实验中。在基因分型实验中,软件会根据实验结果采用聚类法把样本分为纯合野生型、纯合突变型以及杂合共3簇,当每簇分型的样本数少于2个时就会有该提示,主要的原因可能有:1. 本次实验样本数量过少导致每簇样本量不足2例;2. 本次实验检测的SNP 次要等位基因频率(minor allele frequency,MAF)过低,导致检测到的某一种基因型样本太少;3. 实验中某个样本检测结果异常,导致软件将其单独分为一簇,这种情况需要我们对本次实验分簇情况进行确认以及对该样本进行重复实验进行验证。
以上简单介绍了如何去查看qPCR软件中Quality Control 部分的内容,介绍了每种质控提醒的含义、可能的原因以及如何去减少/避免。了解这些质控提醒的含义有助于我们规范自己的实验操作以及对实验结果更好的解读。当然,大家在实验过程中遇到的质控提醒原因可能不仅限于上述描述,如果仍然遇到解决不了的问题,也欢迎您联系我们赛默飞的技术支持,我们将尽力给您提供帮助。
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱