Mol Cell | 深圳大学朱卫国团队揭示SIRT6去乙酰化ACSL5抑制非酒精性脂肪肝疾病机制
2022-10-21 21:28:03, 景杰生物 杭州景杰生物科技股份有限公司

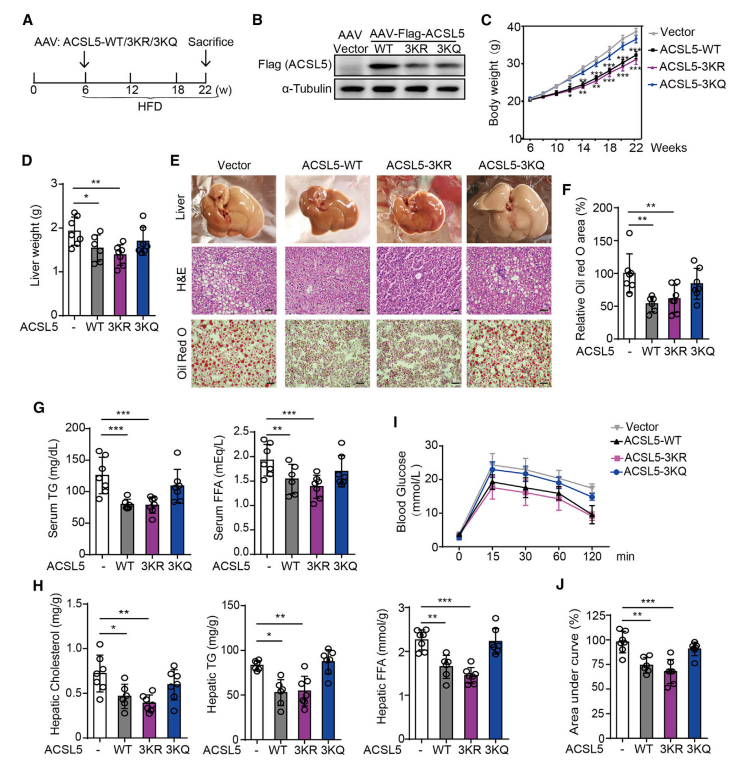
研究亮点:
1. 棕榈酸 (PA) 诱导SIRT6在细胞质中的积累并刺激其活性;
2. SIRT6 在棕榈酸盐存在下去乙酰 ACSL5;
3. 去乙酰ACSL5促进脂肪酸氧化并抑制脂质积累;
4. SIRT6-ACSL5改善小鼠高脂肪饮食诱导的NAFLD发展。





往期推荐
2022-09-23

2022-05-27

2022-05-05

2022-04-08


本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
景杰生物 的近期文章
其他厂商的近期文章
CNS争相报道能延寿50%还能治疗肿瘤的新明星:多胺的前世今生最全梳理!
03-28 麦特绘谱
绘谱学堂 | 4月10日15:00开讲《代谢组学助力心血管疾病研究》03-28 麦特绘谱
Cell Metab | 巨噬细胞的代谢支持维持结肠上皮细胞稳态03-28 麦特绘谱
非酒精性脂肪肝赛道大热!绘云生物走进精准医疗的“黄金时代”03-28 绘云生物
药物合成必杀技:玩转烯烃复分解反应【文末有福利】03-28 默克生命科学
成功讲座!默克与天津制药企业深入合作,助力行业布局03-28
焕新升级,科研赋能03-28 珀金埃尔默
解密生活饮用水中的铝含量:石墨炉原子吸收法的应用03-28 珀金埃尔默
实验室运营好帮手 | 珀金埃尔默租赁服务火热依旧03-28 珀金埃尔默
小“珀”图 | 一秒定输赢,揭秘F1赛车中的分析技术应用03-28 珀金埃尔默
复星、恒瑞、康方、科伦博泰……众多大咖齐聚2024中国医药创新100峰会03-28
是的,你的社区换新啦(点击有03-28
赋能新污染物标准升级,助力环保“新质生产力”提升03-28 飞飞
补铁要补三价铁还是二价铁?赛默飞带您细探究竟03-28 飞飞
重磅!首个毛发中滥用药物及其代谢物国标4月1日发布实施,55种!03-28 分析中心
新污染物检测特色分析技术——红外拉曼显微镜助力微塑料化学成像可视化分析03-28 创新中心
海外展会预告——莱伯泰科邀您相约慕尼黑国际分析生化博览会(analytica 2024)03-28
耗材专区 | EZscan,让热解析管的管理变简单!03-28
耗材专区 | EZsep™WAX固相萃取柱应用于肉制品中合成着色剂的检测03-28
特洁安TrojanUV Signa™助力夏威夷污水厂紫外线消毒升级03-28 特洁安
