Cell Discov | 单细胞多组学测序助力解析肾透明细胞癌的发病机制
2022-08-12 02:22:29, 欧易生物 上海欧易生物医学科技有限公司

前言
2022年7月19日,浙江大学医学院附属第二医院泌尿外科文甲明、王博涵团队联合西湖大学谢琦团队,于Cell Discovery(IF:38.079)在线发表了肾透明细胞癌(ccRCC)的单细胞转录组(scRNA-seq)和单细胞转座酶可及染色质测序(scATAC-seq)的最新研究成果。研究人员对三名患者进行了配对的scRNA-seq和scATAC-seq,并对另外一名患者进行了单独的scRNA-seq。该研究揭示了ccRCC的转录组和表观基因组特征,有助于理解ccRCC的进展以及确定潜在的治疗靶点。
研究背景
肾透明细胞癌(ccRCC)是肾细胞癌最常见和最具侵袭性的类型,超过三分之一的ccRCC患者在手术后复发并发生癌转移,转移性ccRCC患者的预后差。ccRCC的微环境由多种不同的细胞类型和结构成分组成,这些组成在癌症进展和耐药性中起关键作用,但ccRCC的细胞类型和潜在的基因调控特征尚不完全清楚。
本研究联合单细胞RNA测序(scRNA-seq)和单细胞转座酶可及染色质测序(scATAC-seq)揭示ccRCC的转录组和表观基因组特征,阐明了ccRCC的细胞异质性,鉴定出介导肿瘤发展和影响免疫细胞功能的关键调节分子,并确定了ccRCC潜在的治疗靶点。

期刊:Cell Discovery
影响因子:38.079
发表年月:2022年7月19日
材料:三名患者进行了配对的scRNA-seq和scATAC-seq,并对另外一名患者进行了单独的scRNA-seq
运用欧易生物技术:10X Genomics高通量单细胞转录组测序和单细胞ATAC测序
研究结果
1、ccRCC中的单细胞转录组和染色质可及性分析
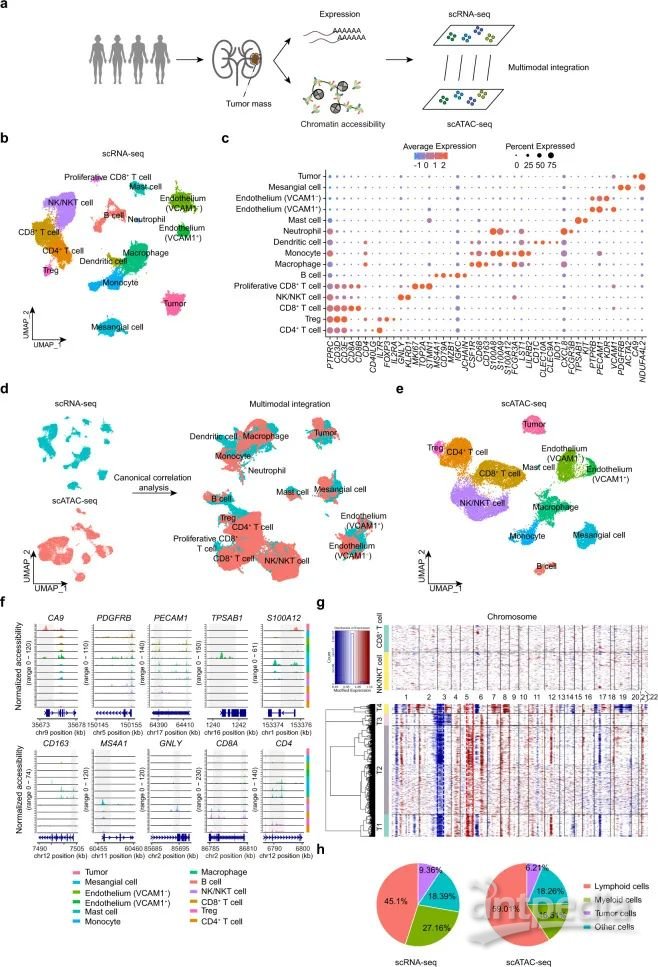
为了系统地解析ccRCC的异质性,研究对三名患者进行了配对的scRNA-seq和scATAC-seq,并对另外一名患者进行了单独的scRNA-seq(图1A)。经过质量控制过滤后,总共保留了来自scRNA-seq的38097个细胞和来自scATAC-seq的21272个细胞用于以下分析。基于经典标记基因,在scRNA-seq数据集中鉴定了15种细胞类型(图1B,1C)。对于scATAC-seq数据集,通过Seurat的标签转移算法和以监督方式注释的细胞簇计算预测分数(图1D)。发现大多数细胞类型都存在于两个数据集中,并且在scATAC-seq数据集中确定了12种细胞类型(图1E,1F)。
研究鉴定了5个主要淋巴细胞群:CD4 T细胞(CD4,IL7R,CD3D,CD3E)和CD8 T细胞(CD8A,CD8B,CD3D,CD3E),Treg细胞(FOXP3,IL2RA),自然杀伤细胞(NK)/自然杀伤T细胞(NKT)(KLRD1,GNLY)和B细胞(MS4A1 / CD20,CD79A)。髓系亚群包括巨噬细胞(CSF1R,CD68,CD163),单核细胞(S100A12,FCGR3A / CD16)和肥大细胞(TPSAB1,KIT)。非免疫细胞包括内皮细胞(PECAM1,PTPRB),系膜细胞(PDGFRB,ACTA2)以及两种不同的内皮亚群(图1C,1F)。
接下来,通过识别经典肿瘤标记CA9和拷贝数变异(CNV)来鉴定肿瘤细胞。在ccRCC的肿瘤微环境(TME)中,免疫细胞是数量最多,占总细胞的70%以上,而肿瘤细胞占比小于<10%。综上,研究整合scRNA-seq和scATAC-seq揭示了ccRCC的异质性。
2、ccRCC中肿瘤特异性调节元件
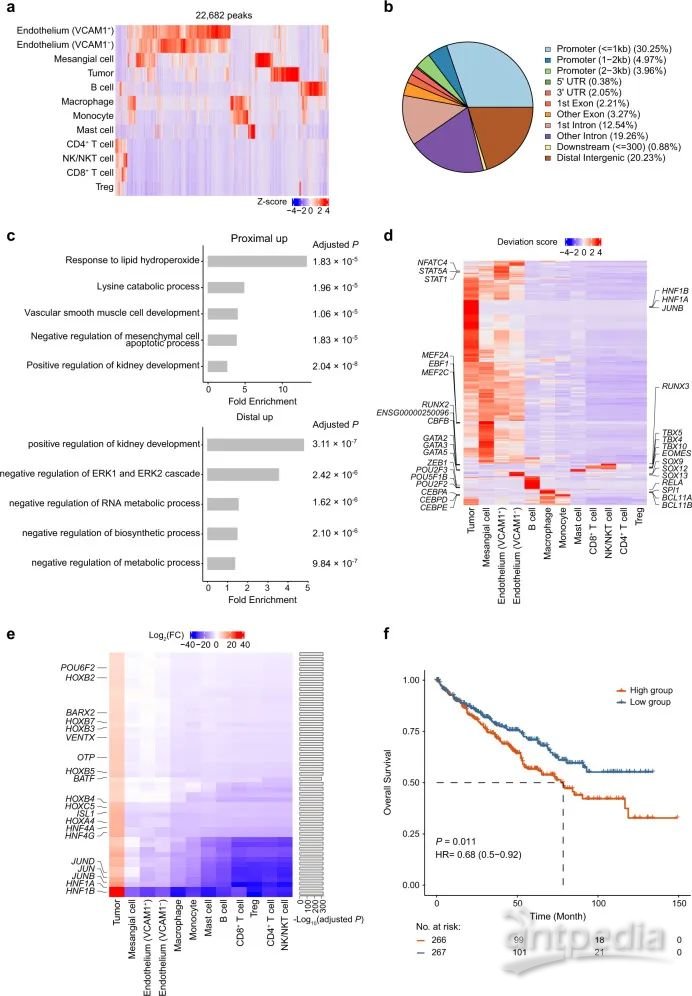
为了研究所有细胞类型之间染色质可及性的差异,首先使用MACS2在scATAC-seq数据中确定了212326个峰,其中约10.6%(22682个独特峰)在细胞类型之间表现出显着差异,这些位点被定义为差异可及性染色质区域(DARs)(图2A)。大多数DARs位于基因组的启动子和内含子区,并且DARs的分布在细胞类型之间相对保守(图2B)。此外,肿瘤细胞的DARs显著富集与代谢相关的生物学过程(图2C)。
接下来,研究应用chromVAR在scATAC-seq数据中推断转录因子(TF)基序的活性。差异TF的分层聚类揭示了细胞类型间共享的和独特的调控元件(图2D)。识别不同的谱系特异性TF进一步支持了细胞类型的鉴定结果。例如,TF T-BOX(EOMES,TBX5)仅在NK / NKT和CD8 T细胞群中富集;SPI127在巨噬细胞富集;CEBP在单核细胞富集;GATA229在肥大细胞富集。此外,两中内皮亚群在TF的富集上也表现出差异性(图2D)。
为了揭示肿瘤发生和发展过程中关键的TF,研究选择了49个仅在肿瘤细胞中高度富集的TF(图2E),如肝细胞核因子1(HNF1A,HNF1B),与肾脏发育障碍相关的组织限制性TF,HOX家族TF等。这些肿瘤特异性TF与癌症基因组图谱肾透明细胞癌(TCGA-KIRC)队列中肿瘤患者的预后相关。肿瘤特异性TF平均表达量高的患者其总生存期比平均表达量低的患者更短(图2F)。
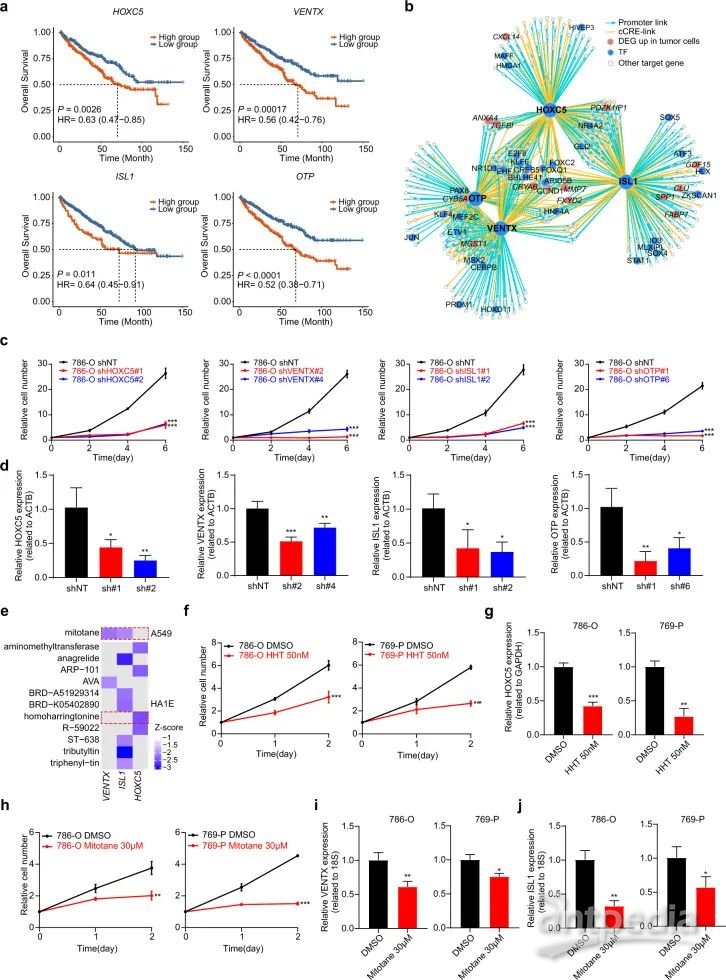
为了进一步研究和验证这些TF在ccRCC中的生物学功能,研究选择了四种TF(HOXC5,VENTX,ISL1和OTP),其表达水平与TCGA-KIRC数据集中较差的总生存率显著相关(图3A)。研究鉴定了这些TF的靶基因,其启动子或连接的候选顺式调节元件(cCREs)是可可及性的,并且在肿瘤细胞中含有TF结合基序。这4种TF调节多个肿瘤特异性基因,如FXYD2和CRYAB(图3B)。重要的是,敲除这些TF能显著降低肿瘤细胞增殖并增加了细胞死亡(图3C,3D)。
利用小分子化合物扰动数据库LINCS研究靶向这些TF的潜在药物,发现FDA批准的两种候选药物(高三尖杉酯碱和米托坦)可以显著降低HOXC5,ISL1和VENTX的表达水平(图3E)。经验证,这两种药物均能显著降低肿瘤细胞的增殖以及HOXC5,ISL1和VENTX在肾癌细胞系中的表达水平(图3F–3J)。总之,研究鉴定了肿瘤特异性调节元件,并验证了它们在促进肿瘤生长中的作用。
3、ccRCC中的恶性转录程序
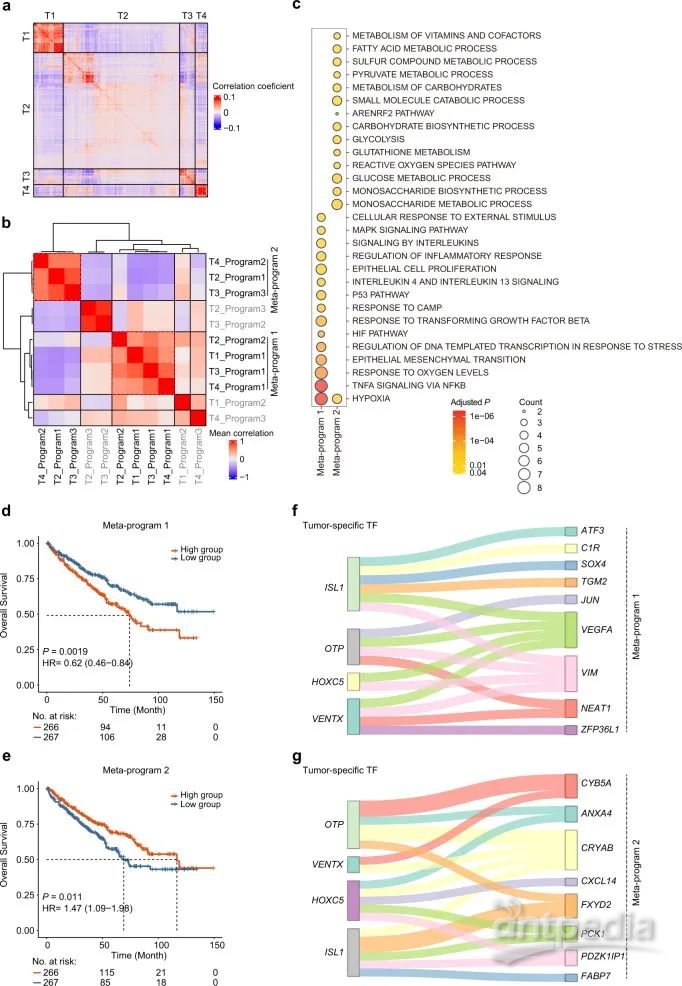
为了探索ccRCC内不同恶性细胞表达状态的差异,该部分研究关注来自4个样本的3564个肿瘤细胞。成对相关性分析揭示了这些肿瘤细胞不同的转录状态(图4A)。非负矩阵分解(NMF)进一步探究了肿瘤的异质性,研究确定了2个荟萃表达程序,它们在4个样本间包含高度相似的表达程序(图4B)。荟萃表达程序1的基因显著富集缺氧和MAPK信号等应激相关途径,而荟萃表达程序1的基因显著富集代谢相关生物过程,如糖酵解和单糖代谢(图4C)。
此外,高表达荟萃表达程序1的患者的总生存期比低表达的患者更短,而高表达荟萃表达程序2的患者有更长的总生存期(图4D,4E)。在荟萃表达程序1中,4个TF都表现出与VEGFA的作用关系(图4F);在荟萃表达程序2中,CRYAB(肿瘤细胞中第二重要的差异基因)由四个TF共同调节(图4G)。总之,研究在ccRCC肿瘤细胞中发现了2个主要的转录程序,并进一步确定了这2个转录程序可能调节的基因。
4、CCRCC中的CD8 T细胞聚类和特征分析
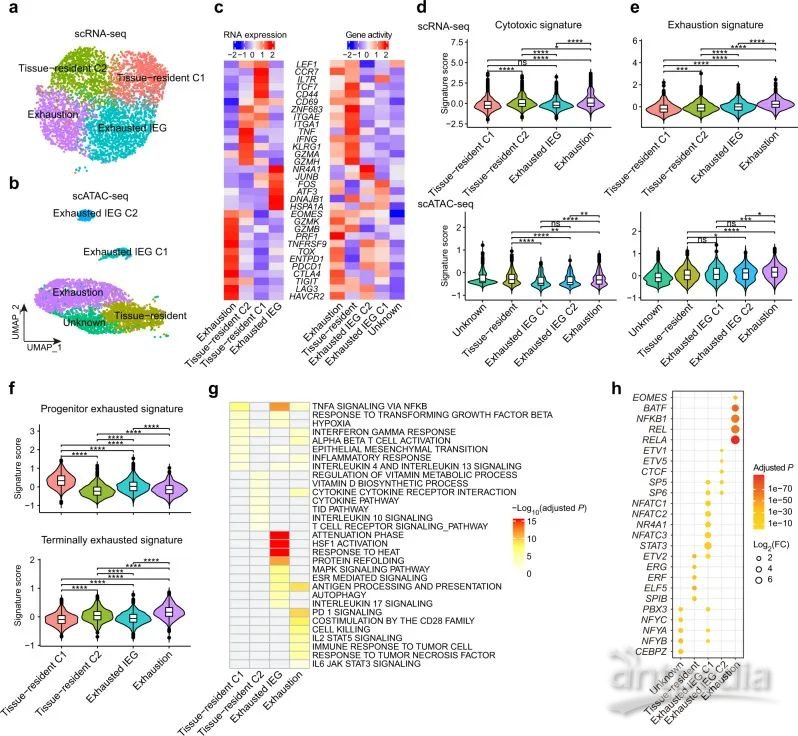
CD8 T淋巴细胞在抑制肿瘤进展方面起重要作用,研究进一步划分了scRNA-seq和scATAC-seq数据集中的CD8 T细胞亚群。在scRNA-seq数据集中确定了4个亚群,在scATAC-seq数据集中确定了5个亚群(图5A,5B)。其中组织驻留CD8 T细胞(CD69,ZNF683/Hobit,ITGAE / CD103,ITGA1 / CD49A)包括一个高表达效应分子(TNF,IFNG和GZMA)的细胞簇C2和一个高表达幼稚/记忆基因(IL7R,CCR7和TCF7)的细胞簇C1。IEG CD8 T细胞高表达激活后早期诱导的基因如HSPA1A,DNAJB1,JUNB和ATF3等(图5D)。
研究使用多个功能基因集进一步研究了CD8 T细胞亚群的功能特性,耗竭型CD8 T细胞的细胞毒性和耗竭的特征评分最高(图5D,5E)。组织驻留的C1细胞簇具有最高的祖细胞耗竭特征评分和最低的终末细胞耗竭特征评分(图5F),可能对抗PD1治疗的反应更好。对差异表达基因富集分析发现组织驻留C1细胞簇与炎症反应显著相关,组织驻留C2细胞簇与细胞因子和维生素代谢途径相关(图5G)。此外,与T细胞耗竭有关的TF EOMES和BATF在耗竭型CD8 T细胞中富集,两个IEG细胞簇受不同的TF调节(图5h)。
5、CCRCC中的巨噬细胞聚类和特征分析
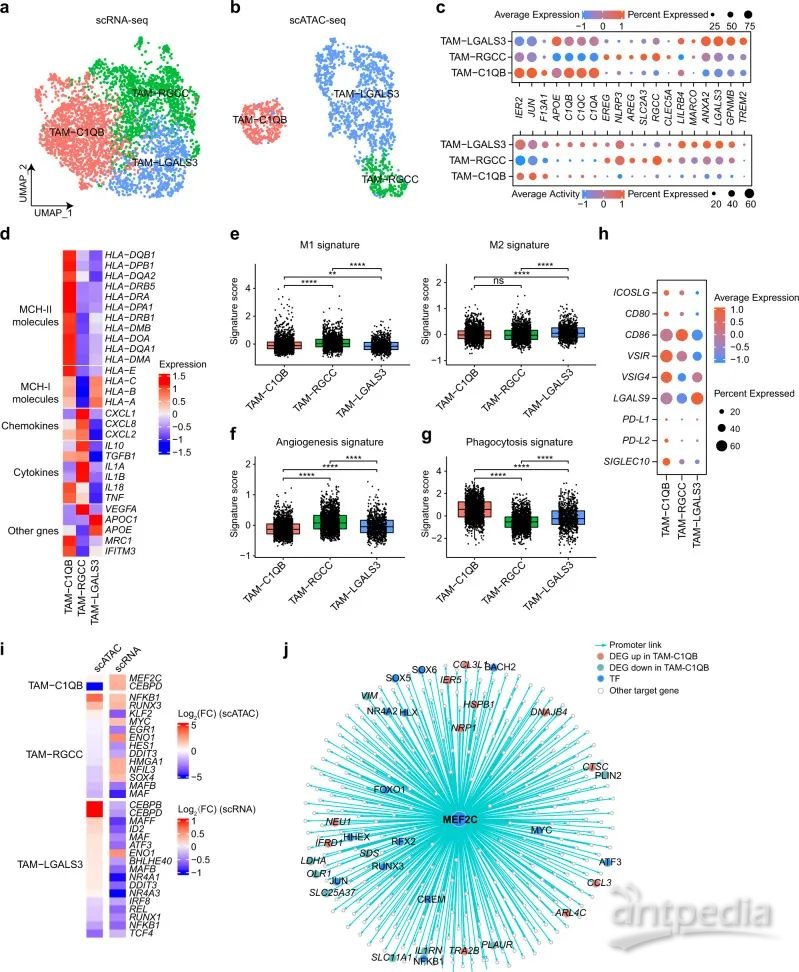
肿瘤相关巨噬细胞(TAM)是肿瘤中髓系的主要细胞类型,研究进行了类似于CD8 T细胞的聚类分析,并鉴定了3个TAM细胞簇(图6A–6C)。TAM-C1QB细胞簇表达补体基因,APOE,早期反应基因(IER2和JUN)以及MHC II类分子(图6D)。TAM-RGCC细胞簇表达高水平的RGCC和促炎基因(NLRP353、CLEC5A、IL1A/B)。TAM-LGALS3细胞簇表现为C1QB和C1QC的中间表达,但参与M2巨噬细胞活化的基因(ANXA254和LGALS355)高表达。
不同巨噬细胞亚型表现出功能差异,TAM-RGCC簇表现出最高的M1特征评分,而M2特征主要在TAM-LGALS3细胞簇中富集(图6E)。TAM-RGCC细胞簇具有较高的血管生成特征评分(图6F)。值得注意的是,TAM-C1QB细胞簇在scRNA-seq数据中显示出最高的吞噬作用特征评分,表明具有高吞噬活性(图6G)。然而,scATAC-seq数据没有显示出类似的趋势,可能是由于其数据的稀疏性。
此外,在TAM-C1QB和TAM-RGCC细胞簇中检出多个共刺激信号,但在TAM-LGALS3细胞簇中未检出(图6H)。四种TF(MEF2C,NFKB1,RUNX3和ENO1)的基因表达和活性均显著增加(图6i),MEF2C调节多个TF(FOXO1,NEU1和NRP1)和趋化因子(CCL3和CCL3L1)(图6J),与巨噬细胞的吞噬作用和血管生成有关。
6、ccRCC微环境中的细胞间通讯
研究应用CellPhoneDB研究了ccRCC微环境中的细胞间通信,内皮细胞具有最多的配体-受体相互作用对,而B细胞最少(图7a)。研究特别建立了肿瘤细胞的细胞间通讯(图7B),肿瘤细胞通过多种配体-受体与内皮、TAMs、增殖型CD8 T细胞和耗竭型CD8 T细胞进行通讯交流(图7C)。接下来,在髓系和淋巴系中选择了与肿瘤细胞相互作用次数最多的三个细胞亚群进行进一步研究,巨噬细胞迁移抑制因子(MIF)及其受体(CD44和CD74)介导的肿瘤细胞与TAM之间的强相互作用,在血管生成和免疫逃逸中起重要作用(图7D)。RPS19和C5AR1表达高的患者在TCGA-KIRC数据集中预后较差(图7E)。
此外,研究确定了肿瘤细胞和三个淋巴细胞亚群之间的相互作用(图7F),发现LTB和LTBR的高表达与TCGA-KIRC数据集中的患者不良预后相关(图7G)。
文章总结
本研究应用单细胞RNA测序(scRNA-seq)和单细胞转座酶可及染色质测序(scATAC-seq)揭示ccRCC的转录组和表观基因组特征。研究确定了由四个关键转录因子(HOXC5,VENTX,ISL1和OTP)介导的肿瘤特异性调控程序,这些转录组因子在癌症基因组图谱(TCGA)数据库中具有预后意义。研究综合分析了CD8 T细胞和巨噬细胞的染色质可及性和基因表达特征。此外,研究描述了由肿瘤微环境中配体-受体相互作用介导的细胞间通讯。总之,该研究深入了解了肿瘤异质性和潜在的调节因素,有利于未来选择更有效的临床治疗策略。
欧易生物提供了该项目的单细胞转录组和单细胞ATAC的测序工作。
猜你想看
1、JTM | 安徽中医药大学发现芪白平肺胶囊治疗慢性阻塞性肺病机制
2、Stem Cell Res Ther | 单细胞转录组测序助力解析hUCB-MSCs治疗宫腔粘连疾病机制研究
4、Stem Cell Res Ther | 单细胞转录组测序助力解析hUCB-MSCs治疗宫腔粘连疾病机制研究

END
排版人:小久
原创声明:本文由欧易生物(OEBIOTECH)学术团队报道,本文著作权归文章作者所有。欢迎个人转发及分享,未经作者的允许禁止转载。


点击“阅读全文” 收获更多精彩
08-10 优尼康
充“电”季预告 | 从电池材料到全电池表征的全面解决方案08-10 助力电池研发的
展会直击丨虹科实车上展,展会首日汽车行业解决方案备受青睐!08-10 虹科品牌部
石墨类负极材料中多种杂质元素电感耦合等离子体发射光谱仪分析方法08-10 管理员
应用方案┃肥料中镉含量的测定——原子荧光光度法08-10 管理员
药物制剂的开发流程08-10 基泰生物
从实验到数据分析,一文搞定“单细胞免疫组库”08-09
【揭秘】加速植物基因功能研究的关键指导要点08-09
中药入血成分分析经典研究案例 | 教你写好成分分析文章08-09 质谱创新组学
精讲视频丨故障排除——前沿峰08-09
大奖揭晓丨 Rxi-SVOCms 气相色谱柱荣获2022 年度科学家选择奖08-09 Restek
解决方案丨用更快速、准确的方法改进空气样品中醛酮的分析08-09
梦想提现丨Let's go! Let's do! Let's shine!08-09 Restek
免费试用丨Topaz衬管,兔出重围!08-09
国仪量子携手清华磁共振实验室为您答疑解惑!顺磁小课堂第十八期08-09 范莹莹
新品上市!国仪量子高速扫描电子显微镜HEM600008-09 CIQTEK
AutoChrom辅助进行SFC方法开发的案例08-09 ACD/Labs
785nm便携式拉曼光谱仪08-09
MS2000光纤光谱仪在玻璃透射率检测中的应用08-09
三通道显微拉曼操作教学视频08-09