GUT | 国家癌症中心崔巍联合多组学技术团队发表血清代谢组肠癌早筛新机制
2021-09-10 01:26:52, 多层组学定制服务 上海欧易生物医学科技有限公司

点击上方“蓝色字体”关注我们
蛋白组学、代谢组学服务专家

(点击图片了解详情)
● 前言
2021年8月,国家癌症中心中国医学院科学院肿瘤医院崔巍研究员与专业多组学技术团队合作在医学一区消化道领域国际期刊《GUT》期刊发表了题为 “Integrated analysis of the faecal metagenome and serum metabolome reveals the role of gut microbiome- associated metabolites in the detection of colorectal cancer and adenoma ”的研究成果,通过非靶向代谢组、靶向代谢组以及AFADESI-MSI空间代谢组学(详情请戳 “了解”)研究方法,整合了宏基因组的数据,发现了可用于腺瘤及结直肠癌诊断的代谢标志物,建立的相关预测模型显示出较高诊断准确性,为结直肠癌早期诊断奠定坚实基础。
“了解”)研究方法,整合了宏基因组的数据,发现了可用于腺瘤及结直肠癌诊断的代谢标志物,建立的相关预测模型显示出较高诊断准确性,为结直肠癌早期诊断奠定坚实基础。

中文标题:粪便宏基因组和血清代谢组的整合分析揭示肠道微生物组相关代谢物在结直肠癌和腺瘤检测的作用
研究对象:人粪便、血清、组织
发表期刊:Gut
影响因子:23.059
发表时间:2021年8月
发表单位:国家癌症中心中国医学院科学院肿瘤医院
运用生物技术:AFADESI-MSI空间代谢组学、LC-MS非靶代谢组、宏基因组、靶向代谢组学
其中宏基因组由欧易生物完成,空间代谢组学由贺玖明教授团队提供技术支持
● 研究背景
结直肠癌(CRC)的早期诊断是提高患者生存率的有效方式。目前临床常用的非侵入性和入侵式检测方法因其准确率低或对患者造成伤害,大规模使用仍受限制。因此,发展无创且准确的检测方法变得尤为重要。
腺瘤或结直肠癌患者的肠道菌群组成会发生显著改变,这些变化的菌群可调节局部免疫反应,产生的代谢物可调节肿瘤的发生和进展。肿瘤细胞状态的代谢变化更容易被观察到,因此是检测肿瘤发生的潜在生物标志物。同时肠道细菌产生的代谢物可进入身体循环并发挥调节作用,可与CRC密切相关的血清代谢物深入研究。
在本研究中,作者对血清代谢组学和粪便宏基因组测序的结果进行整合分析,确定了一组与肠道微生物群密切相关的CRC和腺瘤患者的血清代谢物,并基于代谢物研发了肠道微生物组相关血清代谢物 (GMSM) 策略,可准确区分CRC和腺瘤患者(统称为结直肠异常)与正常健康个体。
●研究技术路线
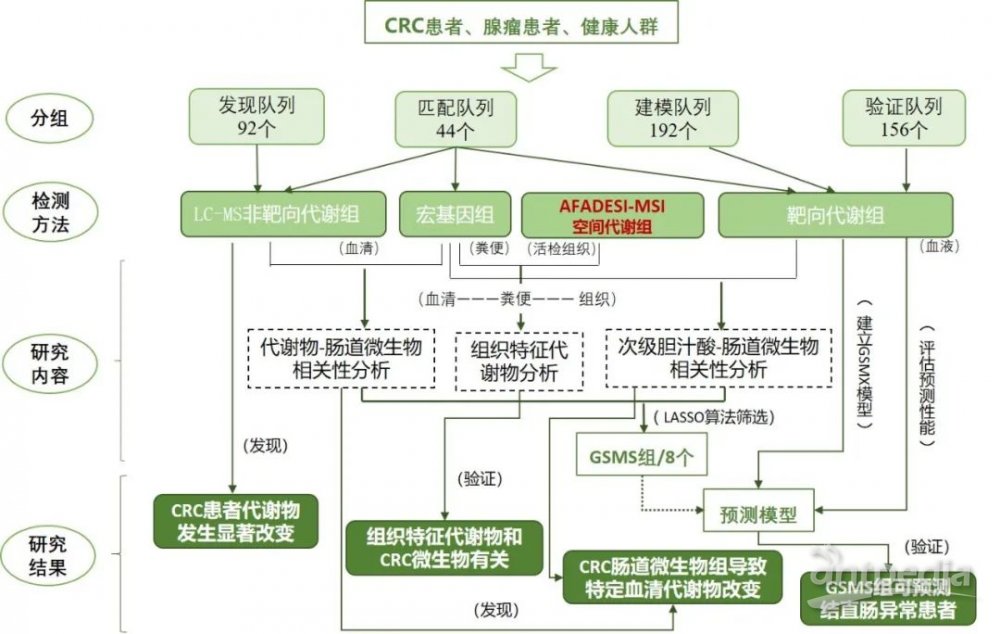
(点击图片查看详细研究策略)
● 研究方法
1、研究队列:四个研究队列(发现队列、建模队列、验证队列、血清和粪便匹配队列),每个队列中均有不同数量的正常人群(蓝色)、腺瘤(红色)和CRC 患者(绿色)样本。
2、非靶代谢组分析:血清和粪便样本中提取的代谢物,进行LC-MS非靶代谢分析
3、靶向代谢物分析:血清中游离胆汁酸和脱氧胆汁酸
4、宏基因组测序和分类:提取粪便样本DNA,使用鸟枪法进行宏基因组测序,并进行肠道微生物组的分类和功能分析。
5、空间代谢组分析:9对人类结直肠组织样本(包括晚期腺瘤或CRC以及癌旁组织)进行AFADESI-MSI空间代谢组学分析
6、肠道微生物组-血清代谢组相关分析
使用血清和粪便匹配集中的33名结直肠癌患者进行肠道微生物组与血清代谢物之间的相关性分析
7、为CRC的GMSM组选择的代谢特征进行验证
● 研究结果
1、血清样本的非靶向代谢组学分析揭示发现队列中结直肠癌和腺瘤患者的代谢物发生显著改变
为研究血清代谢组与结直肠腺瘤或癌症之间的关系,作者对发现队列样本进行非靶向代谢组学分析(图 1A)。对不同组人群比较(C vs N、A vs N 和 C vs A,图 1D)后发现显著改变的代谢物,揭示了腺瘤和癌症患者具有相似的代谢模式,而正常人群可以与这两种人群明显区分开来。进一步比较发现,C vs N 比较组与 A vs N 比较组中寻找到的特征代谢物有明显的相似性,表明在腺瘤阶段肿瘤就已经诱导了血清代谢组显著变化(图1E)。这些显著改变的特征代谢物(共1426个)被作者称为“结肠直肠异常相关代谢物”,其中885个可以被鉴定。基于这些代谢物,可以明确区分结直肠异常患者(C和A组)和正常个体(图1G)。
注:发现队列分为三个组,正常健康人(N,n=31)、腺瘤患者(A,n=12)和 CRC 患者(C,n=49)(图1B)。

图1 | 与正常人群相比,结直肠癌 (CRC) 和腺瘤患者血清代谢组学的总体变化
2.结直肠异常患者血清样本中显著改变的肠道微生物组相关代谢物研究
CRC相关的肠道微生物组导致血清特定代谢物的改变
1)粪便肠道微生物组与血清代谢组的整合分析
为进一步研究肠道微生物组与结直肠异常相关血清代谢物之间的关联,并确定这些微生物组相关代谢物对预测结直肠异常的潜在贡献,作者在血清和粪便匹配队列(44个样本)进行了微生物组-代谢组整合分析,获取血清样品的代谢组谱和粪便样品的宏基因组谱(图2A)。从宏基因组数据中发现引起CRC的关键病原体-产肠毒素细菌脆弱拟杆菌 (ETBF) 表达升高(图2B,红色)。其他几种促进 CRC的微生物均显著上调(图2B,红色),而长双歧杆菌等益生菌在 CRC 患者中下调(图2B,蓝色)。
2)血清中特定胆汁酸代谢物的靶向分析
次生胆汁酸代谢与肠道微生物组和CRC进展密切相关,因此作者分析了结直肠异常患者与正常个体的游离初级胆汁酸 (CA) 和脱氧胆汁酸 (DCA) 丰度的变化。在结直肠异常患者中,CA和DCA的血清浓度上调,相关性分析揭示了肠道微生物群与这些胆汁酸的关联。
3)空间代谢组技术揭示活检组织中特征代谢物与CRC相关微生物有密切联系
作者使用空间代谢组技术(AFADESI-MSI)检测了结肠直肠组织中的肠道微生物组相关代谢物是否发生改变。九对来自结直肠腺瘤/肿瘤和癌旁活检组织,对其代谢物的相对含量进行比较(附图S3)。与邻近的正常组织相比,肿瘤/腺瘤组织中代谢物N,O-双-(三甲基甲硅烷基)苯丙氨酸的丰度显著上调,在结直肠异常患者的血清中也观察到类似的变化。在33名结直肠异常患者中,该代谢物与梭菌属和丹毒丝菌属细菌在内的几种微生物有显著正相关性,且这些微生物的相对丰度在结直肠异常患者中也上调,表明CRC 相关微生物组重编程可能对这种代谢物的生物合成有正向调节作用,而该变化也可在血清代谢组中反映出来。

附图S3 | 直肠腺瘤/肿瘤和癌旁活检组织的质谱成像结果和相关代谢物的相对含量比较


图2 | 通过粪便宏基因组和血清代谢组整合分析,研究结直肠异常患者肠道微生物组与相关血清代谢物的显著变化
3.GMSM组可以预测发现队列中结直肠异常患者
基于已经发现的322 对GMSM,使用 LASSO算法识别检测结直肠异常的关键代谢物生物标志物(图3A)。总共32个代谢物被筛选出来,其中8种代谢物被准确定性,并在非靶向和靶向代谢组学数据显示出一致的上调或下调趋势,表明可以使用不同的方法准确测量这些代谢物(图3A、B和表1)。
作者评估该代谢物组在区分发现队列中的正常个体和结直肠异常患者的预测准确性。非靶向代谢组学分析结果可以准确区分发现队列中的正常个体和结直肠异常患者,曲线下面积 (AUC) 可达0.95(图3C)。靶向代谢组学确定的8种代谢物的AUC为 0.95(图3E),与非靶向代谢组学分析中获得的结果相似。PCA 图显示,使用非靶向和靶向代谢组学分析,正常个体和结直肠异常患者之间存在明显区别(图 3D、F)。这8种代谢物在区分血清和粪便匹配队列中的腺瘤/CRC与正常个体方面也表现出显著的准确性,AUC为 0.96(图3G)。发现了一个由8个GMSM 组成的数据组,称为 GMSM组,具有检测结直肠异常的潜力。
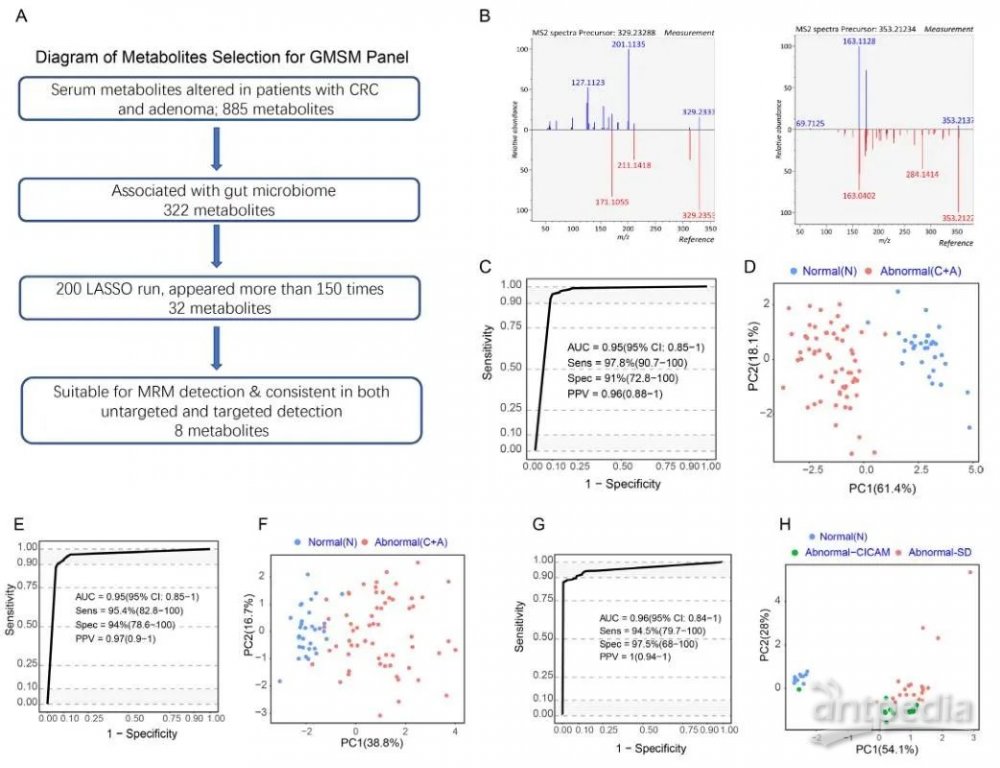
图3 | 肠道微生物组相关的血清代谢物组可以预测结直肠异常
表1 |非靶向和靶向代谢组学分析中GMSM数据对的代谢物及其血清丰度和方差

4.基于GMSM组的预测模型在验证队列中检测腺瘤和CRC 患者的检测结果
根据发现队列中鉴定的代谢物组,在建模队列中(72名正常个体和120名结直肠异常患者)使用靶向方法测量8种GMSM代谢物的丰度,并用逻辑回归方法生成预测模型,并在建模队列的AUC达到0.98(图4A)。生物标志物评分为 0.438时(图4B),建模队列中的敏感性为 96.7%,特异性为 90.3%,此时标志物准确度最高。
随后作者在验证队列(103个结直肠异常患者和53个健康个体)中评估GMSM模型的性能,其AUC达到0.92、灵敏度为83.5%、特异性为84.9%(图4C)。作者还检验了该模型在验证队列中结直肠异常患者从腺瘤到癌症晚期阶段的特异性表现。对于早期/中期(I/II期)CRC患者,AUC为0.93;而对于晚期(III/IV期)CRC患者,AUC达到0.91(图4D)。使用先前建立的最高准确度临界值,对结直肠腺瘤早期/中期 CRC(I/II 期)的敏感性分别达到 63.2% 和 88.2%,特异性84.9%。这些数据暗示了GMSM模型在早期检测CRC方面的潜力。

图4 | 基于CRC GMSM组的预测模型显示出对腺瘤患者及早期/晚期CRC患者良好的诊断价值
5.GMSM模型在预测结直肠异常方面优于临床生物标志物CEA和FOBT
为了比较临床使用的标志物CEA和GMSM模型检测CRC和腺瘤的效率,作者评估了两种标志物在验证队列中的表现。CEA的评估结果表明,其AUC为 0.72、敏感性为 35.8%、特异性为86.4%。相比之下,GMSM模型的AUC达到了0.92、灵敏度83.5%,特异性84.9%,远高于CEA(图 5A、B)。
作者还将GMSM模型与目前用于CRC筛查的 FOBT/FIT分析进行了比较。发现89名接受过 FOBT/FIT测试的患者,其中58 名FOBT/FIT测试阳性,敏感性为 65.2%,与之前的报告水平相当。这些结果表明本研究的GMSM模型优于检测CRC的FOBT/FIT测试。

图5 | 比较 CRC GMSM 模型和CEA生物标志物的检测效率
● 相关讨论
本研究利用代谢组学分析开发的CRC和腺瘤检测模型,表现出比目前临床使用的生物标志物CEA和最近报道的蛋白质标志物及cfDNA突变的血浆生物标志物更高的准确性。GMSM组是一种非侵入性的CRC和腺瘤检测方法,与之前报道的代谢组(仅比较正常和CRC个体之间的血清代谢组)结果相比,本研究的 GMSM 组由一些特征代谢物组成,这些代谢物是CRC相关的肠道微生物组改变的结果。
最新证据表明,肠道微生物组可能通过不同的机制诱导肿瘤发生和CRC进展。本研究中发现CRC患者的产肠毒素细菌脆弱拟杆菌(ETBF)升高,脆弱拟杆菌毒素使结肠上皮细胞HT29/c1和T84中的SMO上调,导致产生SMO依赖的活性氧 (ROS) 和诱导DNA损伤。此外细菌的几种代谢产物(例如次级胆汁酸)也与CRC相关,结直肠异常患者的血清中游离胆汁酸(CA)和脱氧胆汁酸(DCA)浓度上调。相关性分析揭示了肠道微生物组与胆汁酸之间的关联,胆汁酸产生的ROS和活性氮物质导致DNA损伤,进而促进肠道致癌。因此通过GMSM可以获得更有特异性的结肠肿瘤检测策略,GMSM组在独立验证队列灵敏度可达83.5%、特异性可达84.9%,高于其他血清标志物。
最新发表的一项研究声称,基于粪便样本的11个微生物标志物,可以将结肠直肠腺瘤患者与正常个体区分开来(AUC=0.80)。而血液中的代谢物与各种生理或病理条件下的肠道微生物组有关。因此通过粪便样本的代谢组学和宏基因组学整合分析,可以了解来自结直肠腺瘤和早期/晚期 CRC 的特定肠道微生物组和代谢物特征。
本文作者也使用相关性分析揭示了受肠道微生物群的影响的血液代谢物。首先确定了一系列与肠道微生物组(包括 F. nucleatum/B. longum菌,已经被证明促进/抑制CRC生长)相关的代谢物。其次进行了两项实验进一步评估本研究中肠道微生物组与血清代谢物之间的关联。再者,对CA或DCA与肠道微生物组之间关联分析表明,CA和DCA的浓度与具有胆汁酸催化活性的微生物种高度相关。接着,CRC 患者血清和肿瘤组织中改变的特定代谢物(例如微生物代谢物 N,O-双-(三甲基甲硅烷基)苯丙氨酸)在血清和结直肠异常组织中均增加。这些代谢物与一些特定细菌之间的正相关性表明潜在的肿瘤发生了相关微生物组的重编程,微生物种的变化可通过血清中代谢物的检测进行监测。通过正常人和CRC人群粪便宏基因组和血清代谢组的整合分析,作者发现了结直肠异常与血清代谢特征之间的关联,据此建立的基于代谢物的预测模型,显示出用于准确检测CRC的潜力。
● 研究结论
CRC 患者的肠道微生物组重编程与血清代谢组的改变有关。本研究通过非靶向代谢技术发现885种血清代谢物在CRC和腺瘤中发生显著改变,包括8种肠道微生物组相关的血清代谢物(GMSM组)。这8种代谢物可通过靶向和非靶向代谢组学技术重复检测,并准确区分CRC/腺瘤与正常样本。基于GMSM组的模型用于预测CRC和结直肠腺瘤,建模队列中的曲线下面积(AUC)为0.98,在验证队列中AUC为0.92,结果明显优于临床标志物癌胚抗原(AUC=0.72)。GMSM组在腺瘤(AUC=0.84)和早期 CRC(AUC=0.93)的AUC数据显示出该方法在这两组样本中具有较高的诊断准确性,显示出GMSM在CRC和腺瘤检测的良好应用基础。
小鹿推荐
肿瘤的早期诊断标志物的发现对于癌症的诊断、治疗、预后甚至靶向治疗都具有重大价值。理想的诊断标志物应具有非侵入性和诊断准确的特点,本研究提出的8个GMSM标志物组就符合上述特点。虽然该发现还需进行更严格的验证,但已经展现出让人振奋的临床应用前景。而这篇文章使用非靶代谢组-肠道菌群宏基因组整合分析寻找潜在标志物、靶向代谢组学技术验证发现结果、AFADESI-MSI空间代谢组技术从另一维度对结果进一步确认,一整套“宏基因组+代谢组技术组合拳”打得行云流水,不仅最大程度发掘了代谢组学技术的应用潜力,多组学联合分析的思路也非常值得相关研究者借鉴。本文作为临床生物标志物发掘的典型案例,值得进一步研读与关注。
.
文末看点|lumingbio
上海鹿明生物科技有限公司多年来,一直专注于生命科学和生命技术领域,是国内早期开展以蛋白组和代谢组为基础的多层组学整合实验与分析的团队。目前在肠道微生物功能研究可运用4D-LFQ宏蛋白组+肠道代谢-p500对肠道微生物的蛋白质和代谢物进行系统的定性定量分析。为微生物群落的结构组成、基因-蛋白功能、蛋白途径、微生物-环境互作研究提供新的研究思路;
鹿明生物作为AFADESI-MSI空间代谢组学技术的先导者,已经完成心脏、脑、肿瘤、肠道、肝脏、肾脏、皮肤、种子、根等几十种组织样本的空间代谢组学检测及分析,涵盖神经系统、生殖发育、肿瘤代谢与肿瘤免疫、分子病理诊断、药物成像及毒性机制研究等多个领域,截止2021年9月,共计近千例样本经验,积极助力50+医院、高校的科研工作。欢迎长按扫描下方我二维码咨询鹿明生物技术工程师~

参考文献:
1.Doubeni CA, Corley DA, Quinn VP, et al. Effectiveness of screening colonoscopy in reducing the risk of death from right and left colon cancer: a large community- based study. Gut 2018;67:291–8.
2.Medical Advisory Secretariat. Fecal occult blood test for colorectal cancer screening: an evidence- based analysis. Ont Health Technol Assess Ser 2009;9:1–40.
3.Forones NM, Tanaka M. CEA and CA 19-9 as prognostic indexes in colorectal cancer. Hepatogastroenterology 1999;46:905–8.
4.Mandel JS, Bond JH, Church TR, et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. N Engl J Med Overseas Ed 1993;328:1365–71.
5.Kim NH, Lee MY, Park JH, et al. Serum CEA and CA 19-9 levels are associated with the presence and severity of colorectal neoplasia. Yonsei Med J 2017;58:918–24.
猜你还想看
END
嫣然 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
03-22 光电行业都会关注
芯一代精益智造迎来万升产能!回顾毫厘2024EBC,卓越层析介质为下游纯化注入新活力03-22
虹科直播 | 发动机失火怎么办?3月28日晚,全国技术能手教你免拆定位故障根源!03-22 虹科Pico示波器
5万亿设备更新大幕开启,屹尧衡昇助您发动创新引擎03-22
响应设备更新政策丨奥谱天成极完善拉曼光谱产品清单请查收03-22
第二届国际单细胞及空间组学大会,3.29青莲百奥邀您共赴鹏城之约!大会门票限量派发→03-22
Opentrons Flex™ 核酸提取工作站:协同工作,助力高质量基因组 DNA 提取与纯化03-22 Opentrons
CACLP 2024 展会速递 | Opentrons 的亮眼表现全在这里了!03-22 Opentrons
更高通量,更智能化 | Opentrons Flex 助力生命科学实验室更新换代03-22 Opentrons
党建活动|高质量党建推动新质生产力发展,全面赋能医疗服务升级03-22
革新发展,高效赋能 | 开元弘盛助力高校设备更新03-22
兰友科技与润和软件达成战略合作,助力推进生态环境监测体系数智化建设03-22
精准施力!美析仪器整体解决方案助推新一轮大规模设备更新!03-22 管理员
提能增效|华质 · 原位质谱支持大规模设备更新——选型方案03-22 华质君
行而不止,期待再聚 | 第十八届慕尼黑上海光博会完美落幕03-22 普敦科技
领跑新质生产力 | 普敦科技推出“以旧换新”活动03-22 普敦科技
【文献汇编】NGS助力终结结核病03-22
标准解读 | 世界卫生组织《结核分枝杆菌耐药相关基因突变目录(第2版)》解读03-22 裴少君和欧喜超
天美生命科学实验室设备 | 助力教育科研设备换新03-22 天美
GLMY创想仪器丨携光谱分析仪参加湖北省铸造年会03-22 国产精密仪器厂家