技术分享丨如何准确测定目标物含量?带你揭秘4种滴定定量测试手段
2023-12-11 14:58:30, 先进制造事业群 1有限公司



滴定基本原理是通过已知浓度的标准溶液,与样品中的目标元素离子反应,由指示剂或电位突跃指示终点,根据消耗滴定剂的体积,计算目标物含量,由于滴定剂的消耗量与目标物的量根据反应方程式存在定量关系,因此滴定法也称为容量法。

滴定根据对终点判断的手段可以分为指示剂滴定和电位滴定,前者根据实验人员对指示剂颜色变化来判断终点,后者是根据反应完成时体系出现的电位突跃指示终点。而根据原理来区分,可以分为酸碱滴定、络合滴定、氧化还原滴定和沉淀滴定。
酸碱滴定是滴定中应用较广泛的定量方法,适用于酸、碱及两性盐类(如碳酸钠、碳酸氢钠、乙酸钠等)的定量,以及水质、油品等样品的酸值和碱度的测试。
依照布朗斯台德酸碱理论[1],凡是能给出质子的分子或离子就是酸;而能够结合质子的分子或离子就是碱。
酸和碱的强度分别用酸解离平衡常数(Ka)和碱解离平衡常数(Kb)表示:
Ka=[A-][H+]/[HA]
Kb=[OH-][B+]/[BOH]
以强酸为例,盐酸在水中完全电离,所以Ka(HCl)>1;
而部分弱酸如乙酸,其Ka(HCl)=1.8*10-5,在水中为部分电离。

氢氧化钠滴定盐酸曲线
酸碱滴定实验可以用滴定曲线表示。当我们以氢氧化钠滴定盐酸时,体系初始的pH值较低,随着加入的碱越来越多并接近与盐酸的量1:1时,pH值在极小的体积区间(±0.02mL)内出现急剧增大,达到平衡后趋于平缓,而pH出现突跃时滴定剂的量则为反应的终点。
而由于大部分酸碱反应都是无色的,我们需要借助相应的手段来指示酸碱反应的终点,这个时候我们就会用到酸碱指示剂,酸碱指示剂多数是有机的弱酸或者弱碱,由于其自身也会参与到质子的传递,从而发生结构上的变化并从其颜色上体现出来,因此指示剂在酸性或碱性环境下会呈现不同颜色,即酸式色和碱式色。

酸式色和碱式色的转化
以酚酞为例,它在体系中pH大于8.2的时候呈红色,当pH小于8.2的时候呈无色。然而并不是所有的酸碱指示剂都有颜色分明的酸碱指示色,比如甲基橙从酸到碱是红色变为黄色,对于终点的判断容易产生来自实验员的主观判断差异。因此,必要时我们也可以借助电位计来指示反应的终点。

酸碱滴定常用的指示剂变色范围及酸碱指示色[2]
络合滴定广泛应用于样品中常量及微量的金属离子及元素的滴定,如水中的硬度(钙镁)、聚合氯化铝的含量及锌铜镍等元素含量的测定。
络合滴定反应涉及到两个重要概念,分别是中心离子和配位体,中心离子是原子核外围有空余轨道并可容纳电子的离子(金属离子),而配位体则是其能提供孤对电子的物质。
众所周知,氯化银在水中以沉淀形式存在,而在氨水中则可以溶解。这是因为虽然氯化银本身难溶,但是其存在沉淀平衡能电离出微量的银离子,银离子由于失去一个电子其外围为空轨道,而氨(NH3)中的氮原子外围存在五个电子,其中三个电子与氢原子以共价键(N-H)的形式结合,剩下两个电子以孤对电子的形式存在。因此,Ag+和NH3能以配位键的形式结合形成银氨络离子,使氯化银溶于氨水。

氯化银与氨水的反应平衡
在络合反应中,涉及到较多的络合剂属于氨羧络合剂,是指同时存在氨基和羧基的物质,其中较常见的为乙二胺四乙酸(EDTA)及其盐类,EDTA可以与绝大多数的金属离子以1:1形成稳定的络合物。而在实际的络合滴定中,由于EDTA的二钠盐在水中的溶解性较好,所以EDTA二钠也就成为了络合滴定反应中较常用的络合剂。
然而,在滴定体系中,除了我们预期的目标离子与EDTA络合的主反应外,还会存在其他影响测试结果的副反应。由于EDTA属于有机弱酸,其在溶液状态下存在六级解离,体系中的酸碱度会影响EDTA参与解离(副反应)的程度,因此,我们需要控制体系中的pH,以减少副反应对滴定的影响。
此外,由于EDTA与多数金属离子都能络合,我们还需要考虑体系中杂质离子消耗EDTA而造成的干扰,所以我们可以使用掩蔽剂,避免受到杂质离子的影响。
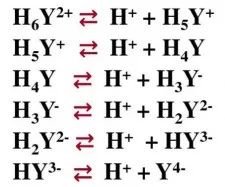
EDTA在溶液中存在六级解离平衡

EDTA滴定钙的方法简述[3]
在实际的络合滴定中,通过使用缓冲溶液或酸碱调整体系pH,针对样品中存在的金属离子,加入相应的掩蔽剂屏蔽杂质离子的干扰,使用已知浓度的EDTA二钠标准溶液,以络合指示剂(铬黑T、钙试剂、二甲酚橙等)的颜色变化指示终点,根据标准溶液的消耗体积来计算目标离子的含量。
氧化还原滴定的应用面非常广,理论上样品自身具有相对的氧化还原性,并具备使用氧化还原反应定量的条件,无机和有机体系均有应用。常见的如碘量法(食品中的过氧化值,消毒剂中的有效氯,金属离子铁铜锡等)、水质中的COD、肥料中的有机质、颜料中的二氧化钛等。
氧化还原滴定的基础是氧化剂和还原剂发生化学价变化的反应,化学价降低的一方为氧化剂,化学价升高的为还原剂,根据所发生氧化还原反应的定量关系,计算目标物(反应物的其中一方,氧化剂或还原剂)的含量。

使用碘量法测定有效氯的基本原理[4]
常见的氧化剂主要是高价态的化合物,如高锰酸钾、重铬酸钾、氯酸盐及次氯酸盐等强氧化剂,而常见的还原剂主要是低价态的化合物,如硫代硫酸钠、草酸钠、硫酸亚铁、硫酸亚铁铵等。值得注意的是,反应物的氧化性和还原性只是在特定反应下所呈现的特点,具有相对性。
氧化还原反应的终点判断有多种方式,有的反应物本身可以同时作为指示剂,如碘量法可以通过碘单质与淀粉产生深蓝色,高锰酸钾与草酸钠反应可以通过紫色消除来判断。此外也可以使用二苯胺磺酸钠、亚甲基蓝等专用指示剂。
在化学领域中,我们都知道氯化银以沉淀的形式存在,然而生成氯化银的反应并不是单向的。氯化银实际上是一种难溶电解质,在溶液中存在着沉淀平衡。沉淀平衡可以用溶度积Ksp表征,溶度积数值的大小反映了难溶电解质的溶解能力。
如氯化银的溶度积Ksp(AgCl)=[Ag+]*[Cl-],当体系中银离子浓度乘以氯离子浓度大于Ksp(AgCl)时,沉淀平衡向沉淀产生一侧进行,体系产生氯化银沉淀。
假设一个体系中存在氯离子,我们加入硝酸银,体系会生成氯化银沉淀而呈现白色浑浊,硝酸银继续添加,沉淀会继续产生,现象为白色浑浊的加深,但是由于不存在明显反应终点的现象,我们不能以此通过硝酸银的消耗量计算氯离子的含量。
对于同种离子组成的不同的沉淀,他们之间存在着沉淀转化的现象,即形成沉淀的物质存在一种向更低Ksp沉淀转化的趋势[5]。

氯化银向铬酸银转化的反应方程式

常见沉淀化合物的溶度积Ksp和溶解度[6]
利用沉淀转化的原理,以硝酸银作为滴定剂,以铬酸钾为指示剂,体系中先形成氯化银沉淀,随着银离子浓度的增加,氯化银沉淀(白色)转化为铬酸银沉淀(砖红色),以体系出现砖红色为反应终点,我们可以通过计算得到氯离子的含量。
另外,我们也需要关注体系中的pH,如用铬酸钾作指示剂滴定银离子时,需要保证体系pH为6.5-10之间,过酸铬酸根会出现歧化转化成重铬酸根,过碱银离子则会形成氢氧化银。在实际的应中,沉淀滴定主要用于测定如氯、溴、碘等离子的定量。
综上所述,四种滴定方法,各有其适用和不足的地方。如酸碱滴定适用于大部分呈现酸碱性的目标物,但是如果体系中存在多种酸性或碱性的物质则没办法区分,另外,对于有机弱酸等不完全电离的物质,酸碱滴定也并不适合。
对于络合滴定,其能对多种金属离子进行定量,在实际滴定过程中我们控制了酸碱度和屏蔽了干扰离子,这种方法对目标物的指向性是很高的,定量结果也更加可靠,尤其适用于混合体系中的金属离子测定。
氧化还原滴定与酸碱滴定有点类似,是根据目标物和滴定剂相对的氧化还原性来反应的,对目标物的指向性不高,体系复杂的时候可能并不适合,但是由于氧化还原反应普遍存在,使得其在化学领域得到了广泛应用。
沉淀滴定针对的目标元素离子范围相对较窄,但在保证了体系化学环境的条件下,其定量具有针对性,是对主量的氯、溴、碘等元素离子定量的主要手段。
按照以上所述,针对不同测试项目以及不同的需求,可选择不同滴定手段,归纳总结如下:

[1] 徐家宁,张丽荣,王莉.无机化学核心教程(第二版)[M]. 科学出版社,2015.
[2] HG/T 4015-2008,化学试剂 酸碱指示剂pH变色域测定通用方法[S].
[3] GB/T 19281-2014, 碳酸钙分析方法[S].
[4] GB/T 19106-2013,次氯酸钠[S].
[5]韦京松.溶液酸度与难溶弱酸盐溶度积的关系式及其应用[J]. 广西农学院学报, 1986(01): 125-127.
[6] 孟凡盛.难溶电解质的计算溶解度小于实测溶解度的原因分析[J]. 化学教学, 2015(8): 87-90.
END

轻松一点,赞和在看都在这儿!

04-22
ACCSI2024珂睿科技入围科学仪器行业投资潜力榜单并荣获成长潜力企业奖!04-19 珂睿marketing
宁波市政协主席陈龙一行莅临华仪宁创考察调研04-19
鄞州区人民政府副区长陈建恩带队赴华仪宁创开展企业帮扶现场办公会04-19
多因子实验操作二三事,轻松get高通量数据!!!04-19 赛默飞生命科学
高压均质技术在处理淀粉中的应用04-19 SCIENTZ
湖北省一天科技有限公司选购我司HS-STA-001同步热分析仪04-19
科普知识丨聚酰胺PA塑料的机械物理性能04-19
我司HS-STA-002同步热分析仪落户中国-东盟科技创新公共服务平台04-19
广东广纺检测技术股份有限公司二次选购我司炭黑含量测试仪04-19
【展会通知】2024年陕西省药学会第三届药品质量控制与检验技术大会04-19
世界地球日将至,与Detelogy一起守护地球!04-19 得泰仪器Detelogy
华谱科仪携S6000高效液相色谱仪亮相中国医药全产业链新资源大会04-19 华谱科仪
24节气|匠心随春风,天隆燃智造04-19
全域感知,“育”见环博 | 谱育科技再赴上海环博会之约04-19 点击关注→
光谱学常用术语04-19
融合创新,质领未来 | 青源峰达“THz+ & IC+”双生态亮相2024第十七届中国科学仪器发展年会04-18 SHINE
动物健康应用攻略第六期 | 猪轮状病毒专题(二)猪轮状病毒 A、B 和 C 型的多重逆转录qPCR鉴定04-18 赛默飞基因科学
近期热招职位 | 春暖花开之际,来和我们做同事吧04-18
来真的,揭秘药物销量榜“药王”诞生04-18