Sci Immunol | IF:30+,微生物衍生的代谢物TMAO驱动免疫激活并促进胰腺癌患者对免疫检查点阻断的反应
2022-10-15 06:32:56, 多层组学定制服务 上海欧易生物医学科技有限公司

前言
胰腺导管腺癌(PDAC)是一种高致死率的癌症,预后不佳。由于高度免疫抑制的肿瘤微环境(TME),免疫疗法不能改善PDAC患者的临床表现。而有研究表明,肠道菌群可以决定癌症的进展和免疫治疗反应,比如来自长期PDAC患者(可能具有一定的抗肿瘤因子参与)的肠道菌群具有一定的抗肿瘤作用。这种抗肿瘤作用可能与TME的免疫反应有关。肠道菌群可以产生多种代谢物,比如促炎代谢物氧化三甲胺(TMAO),由食物中胆碱经肠道菌的胆碱TMA裂解酶转化为TMA,而后TMA进入门静脉,在肝脏中氧化为TMAO。研究表明,TMAO可以激活免疫。因此,本篇作者采用多组学的方法对TMAO抗肿瘤的效果及机制展开研究。
2022年9月,费城Wistar研究所的Rahul S.Shinde团队在Science Immunology(IF:30.63)发表了题为“The microbiome-derived metabolite TMAO drives immune activation and boosts responses to immune checkpoint blockade in pancreatic cancer”的研究成果。该文章使用非靶代谢组学、转录组学(RNA-seq)及单细胞转录组学(scRNA-seq)、荧光流式对TMAO对PDAC肿瘤生长以及巨噬细胞的影响展开研究。
研究思路



研究结果
1、肠道微生物衍生的TMAO驱动PDAC中TME的免疫激活并减少肿瘤生长
首先作者采用抗生素甲硝唑改变小鼠肠道菌群,以观察肿瘤生长的变化。结果发现甲硝唑可以明显增加肿瘤大小(图1A)。通过对小鼠血清的非靶代谢组学分析发现,受影响最大的是TMAO,平均减少了约73倍(图1B)。通过腹腔注射外源TMAO或者TMA,发现肿瘤大小和重量明显减少。
通过荧光流式分析发现,TMAO或TMA处理后,肿瘤相关巨噬细胞(TAMs)中主要组织相容性复合体I类(MHCI)、MHCII和CD86等刺激性标志物的表达增加;同时,抗炎标志物Arg1的表达明显减少,共同表明向免疫刺激性TAM表型转变(图1E和F)。效应性T细胞的激活大幅增加,表现为IFN-γ+TNF-α+CD8+和CD4 T细胞的百分比增加,以及CD8+和CD4v+T细胞上的激活标志物CD44增加(图1G)。
此外,血清中的TMAO水平与IFN-γ+TNF-α+CD8+ T细胞的百分比呈正相关,与肿瘤重量呈负相关。此外,TMAO也激活了小鼠外周器官及淋巴组织的免疫。这些结果说明TMAO或TMA可能通过重新配置肿瘤环境,使其处于免疫激活状态而抑制肿瘤生长。诱导外周组织的免疫激活可能有助于TMAO的肿瘤抑制作用。
随后作者通过向食物中增加胆碱来验证这一结果。通过非靶代谢组学分析发现,补充胆碱的小鼠中TMAO和TMA的水平增加,且与PDAC尺寸的明显减少有关(图2A和B)。而且,补充胆碱导致的免疫刺激作用与直接给予TMAO相似。具体来说,在TAMs上MHCI和MHCII等刺激标志物的表达明显增加(图2c)。也观察到其他先天性免疫细胞的激活标记增加,包括CD11b+Ly6ChighLy6G-单核骨髓源性抑制细胞(MDSCs)(M-MDSC)、CD11b+- Ly6ClowLy6G+多核MDSCs(PMN-MDSC)和抗原呈递的CD103+树突状细胞(DCs)。这些分析还显示了活化的CD8+和CD4+T细胞的明显增加,如IFN-γ+TNF-α+CD8+和CD4+T细胞百分比的增加与活化标志物CD69的增加有关(图2D和图S4D和E)。而TMAO的产生取决于肠道菌群酶CutC/D的活性。
为研究CutC/D酶活性是否是TMAO抗肿瘤作用所必需的,作者使用CutC/D酶抑制剂氟甲基胆碱(FMC)抑制CutC/D活性。结果发现,FMC处理后明显降低了循环TMAO水平,与甲硝唑相似(图2F)。与对照组相比,FMC治疗还与PDAC负担的明显增加有关(图2G)。此外,FMC明显增加了Arg1的表达,同时减少了TAMs上的MHCII,表明TAM免疫刺激表型的整体减少(图2H)。CD103+DCs的免疫刺激表型也减少了,表现为MHCI和IL-12p40表达的减少(图S4G)。最后,IFN-γ+TNF-α+CD8+和CD4+ T细胞的百分比明显下降,这表明效应性T细胞反应下降(图2I)。这些数据表明,TMAO诱导的TAMs和其他免疫细胞的免疫刺激表型至少部分是由于肠道细菌酶CutC/D的活性。
3、TMAO驱动了PDAC免疫浸润中的抗肿瘤转录作用
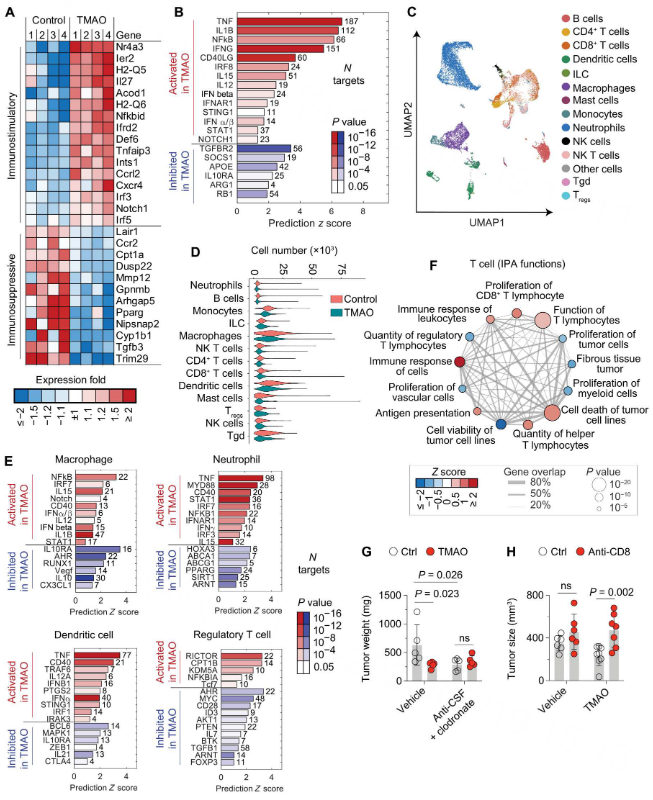
接下来,作者为了解TMAO对TAMs的影响,采用转录组学RNA-seq对TAMs进行研究。结果发现,TMAO处理组的1736个基因转录物发生了明显的变化,与对照组相比向免疫刺激状态的转变相一致。上调的基因包括许多参与炎症的基因,如Nr4a3、H-Q5、H2-Q6、Irf3、Irf5、Acod1、Def6和Ccrl2(图3A)。下调的基因包括Trim29、Tgfb3、Cyp1b1、Pparg和Mmp12(图3A)。
为进一步了解TMAO对肿瘤浸润性免疫细胞的转录影响,作者采用scRNA-seq对CD45+免疫细胞进行分析。结果发现,多个免疫细胞亚群被分隔成14种具有不同转录谱的细胞类型(图3C)。此外,发现免疫刺激标志物增加,包括I型IFN反应性转录调节器(如NF-κB、IRF7和STAT1)、炎症细胞因子(如IL-15、IL-12、IFN-β和IL-1β)和成本刺激分子(如CD40),而免疫抑制标志物(如AHR、VEGF和IL-10)则减少(图3E)。另一方面,TMAO也影响了T细胞的转录谱,被激活的功能包括CD8+T淋巴细胞的增殖、细胞的免疫反应、抗原表达和肿瘤细胞系的细胞死亡,被抑制的功能包括调节性T淋巴细胞的数量、肿瘤细胞的增殖、纤维组织肿瘤和骨髓细胞的增殖(图3F)。
为进一步了解TMAO的抗肿瘤作用是否需要TAMs和/或CD8+T细胞的参与。作者在PDAC小鼠中使用抗CSF1加氯膦酸钠耗尽巨噬细胞,发现耗尽TAMs后,与对照组相比,TMAO不再减少肿瘤负担,这表明TAMs可能参与了TMAO的抗肿瘤作用(图3G)。这些结果表明,TMAO通过重新配置TME中的免疫细胞,使其处于更活跃的状态,从而抑制了肿瘤的生长。
4、TMAO介导巨噬细胞获得免疫刺激表型
随后,作者想确定TMAO是否对巨噬细胞的功能表型有直接影响。通过使用脂多糖或同时添加IFN-γ在有TMAO存在或者不存在的情况下,处理小鼠骨髓来源的巨噬细胞(BMDM)。结果发现,TMAO提高了促炎症细胞因子(IL-6和IL-12p40)的分泌,减少了抗炎症细胞因子IL-10的分泌。
通过RNA-seq,作者发现巨噬细胞暴露于TMAO后,超过1500个基因的表达发生了明显的变化。被激活的途径包括哺乳动物雷帕霉素(mTOR)信号、IFN信号,以及一氧化氮和ROS的产生,被抑制的途径包括PPAR信号、sirtuin信号和PTEN信号。
为了解TMAO在肿瘤环境下对巨噬细胞的影响,作者将BMDM暴露在没有或有TMAO的PDAC肿瘤调理介质(TCM),随后通过RNA-seq分析发现,TMAO促使与免疫抑制(包括Cxcl5、Arg1、Ccl22和S100A9)、基质金属蛋白酶(包括Mmp8、Mmp9和Mmp13)和细胞外基质重塑(包括Col7a1和Vcan)有关的基因表达明显下降。相反,TMAO增加了免疫刺激基因的表达(包括Ccl5、Clec12a和H2-DMa)。体内TMAO也明显增加了TAMs中I型IFN途径的调节因子(如IRF7、IFN-β、STING1和STAT1)(图3B和E)。总之,这些结果表明,TMAO诱导了一种免疫刺激性巨噬细胞表型,这种表型与I型IFN反应的增加有关;这种I型IFN反应的增加可能是TMAO抗肿瘤作用的一个关键机制。
5、TMAO增强了I型IFN反应并以I型IFN依赖的方式发挥抗肿瘤作用
为了验证TMAO对I型IFN的激活效用。作者采用I型IFN的已知激活剂如ISD、poly(dG:dC)等刺激BMDM。结果发现,ISD等激活剂导致I型IFN反应基因的表达增加(图4C)。TMAO诱导Irf7、Irf5和Ifnα1对ISD和poly(dG:dC)的表达(图4C),但只诱导Ifnβ1对poly(dG:dC)的表达(图4C)。TMAO还增加了活化标志物的表面表达,包括CD86、MHCII和PDL1,以及用ISD刺激后MHCII+PDL1+巨噬细胞的百分比(图4D)。这些结果表明,TMAO增强了I型IFN反应,并可能通过刺激I型IFN途径促进获得免疫刺激巨噬细胞表型。
6、TMAO直接改变了巨噬细胞表型以支持T细胞反应及降低PDAC负担
为验证TMAO刺激的巨噬细胞是否也能抑制PDAC的生长,作者采用TMAO刺激的巨噬细胞治疗患有肿瘤的小鼠。结果发现,与未经处理的对照组相比,接受对照组巨噬细胞的小鼠的肿瘤负担略有增加(图5C)。与接受对照组巨噬细胞的小鼠相比,接受TMAO刺激的巨噬细胞的肿瘤负担平均下降了2.4倍以上(图5C)。接受TMAO刺激的巨噬细胞的小鼠显示出强大的活化特征,与接受对照巨噬细胞的小鼠相比,CD8+和CD4+T细胞上的IFN-γ、Ki-67、CD103和CD44明显上调(图5D和E)。这些结果共同表明,TMAO将巨噬细胞塑造为一种表型,增强了效应性T细胞反应,减少了PDAC生长。
7、人类巨噬细胞汇总也发现了TMAO的促炎作用
随后,作者在人类巨噬细胞上验证TMAO的促炎症作用。发现,在TCM刺激的巨噬细胞培养物中加入TMAO,可显著增加促炎症基因(包括IFNR1、IL-6、CCL-5、TNFA和IL-1B等)的表达,并显著降低抗炎症基因IL-10的表达(图5F)。这些结果表明,TMAO也推动了人类巨噬细胞的促炎症反应,并可能在人类中以类似于在小鼠中观察到的方式发挥作用。
8、TMAO使PDAC对免疫检查点治疗敏感并提高PDAC小鼠生存率
由于在PDAC小鼠中施用TMAO或TMA,或在饮食中补充胆碱,都会明显增加PD1+Tim3+CD8+T细胞的肿瘤浸润(图6A和B),这表明,将TMAO与anti-PD1或anti-Tim3结合起来,可能比单独使用任何一种干预措施都更有效。因此,作者对此展开研究,发现单独的anti-PD1并没有减少肿瘤负担;然而,与单独的TMAO或对照组相比,anti-PD1加TMAO的组合确实明显减少了肿瘤重量(图6C)。与单一治疗或未治疗的对照组相比,联合治疗组的骨髓细胞(包括TAMs、MDSCs和CD103+ DCs)的细胞表面标志物MHCI明显增加,这表明联合治疗增加了这些细胞群的免疫刺激表型(图6D)。这与显著的效应性T细胞反应有关,包括CD44+Ki-67+以及IFN-γ+TNF-α+CD8+和CD4+T细胞百分比的明显增加,表明T细胞的大量增殖和激活状态(图6E)。此外,胆碱代谢物TMAO或TMA与ICB(anti-PD1加anti-Tim3)相结合时,可改善PDAC对ICB的反应性和肿瘤小鼠的生存率(图6G和H)。
9、产TMA菌群丰度及CutC基因表达与PDAC患者对治疗反应增强有关
最后,作者通过分析以往研究中PDAC长期生存者和短期生存者中的肠道菌群,发现,与短期生存者相比,长期生存者中Bacillus和Paenibacillus的相对丰度明显更高(图7A)。由于本文之前的研究表明,作者假设肿瘤对anti-PD1的临床反应可能与含有CutC的细菌的存在或粪便微生物组中CutC基因的表达相关。通过利用他人的研究数据发现,与PD1无反应者相比,反应者中含有CutC的Bacillus的相对丰度更高(图7B)。还发现,18个细菌菌株的anti-PD1反应和CutC表达之间的重要关联,包括Clostridium tetani、Clostridium tepidum、Clostridium culturomicium、Enterococcus asini、Enterococcus sp. DIV1298c和Enterococcus phoeniculicola(图7C)。这些菌株属于两个细菌科,即梭菌科(Clostridiaceae)和肠球菌科(Enterococcaceae),与无反应者相比,它们在反应者中含量丰富(图7D)。此外,反应者中CutC的表达明显增加(图7E),而且CutC的高表达与anti-PD1后总生存率的提高明显相关(图7F)。这些结果共同表明,含有CutC的细菌的存在和CutC基因的表达与癌症患者的生存率提高和对anti-PD1的反应有关。
相关讨论
肠道微生物衍生的代谢物TMAO和抗PDAC肿瘤免疫反应之间有一种未曾预见的联系。TMAO诱导了巨噬细胞的免疫刺激表型,增强了效应性T细胞的功能,并使PDAC对ICB有反应。在临床上,含有CutC的细菌与anti-PD1的反应改善有关。
小鹿推荐
TMAO可以说是近年来比较热的小分子代谢物,大多研究均与其促炎的作用有关,比如TMAO与动脉粥样硬化等。本研究创造性地将TMAO与PDAC肿瘤联系起来,采用多组学联合的手段,如非靶代谢组学、转录组学及单细胞转录组学,发现TMAO可以通过促炎的作用发挥抗肿瘤功能,并深入探讨了TMAO抗肿瘤的机制。这一发现为深入理解肿瘤治疗机制,肿瘤与炎症的关系,以及TMAO与肿瘤免疫的关系提供了新的思路和见解。

详情请咨询鹿明生物技术工程师
猜你还想看
1、Nat Commu | 蛋白质组学+脂质组学探究多胺对非酒精性脂肪肝的预防机制
2、Science关注 | 通过高分辨率质谱成像技术和单细胞转录组技术揭示鞘脂控制真皮成纤维细胞异质性
3、ARD | 风湿病顶级期刊!体外质谱技术揭示银屑病关节炎滑液的骨髓促炎特征
4、Anal Chim Acta亮点 | 许国旺课题组在高通量单细胞代谢组学研究中取得的新进展
END
Dr.Husky|撰文
小久|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点击“阅读原文”了解更多
04-08
哈希高品质供水水质分析与检测技术论坛04-08
应用专家服务周丨福建站04-08
相约厦门丨2024年度华东地区(电子)显微学学术交流会04-08
限时优惠 | 警惕"两虫"危害!守护饮用水安全04-07
喜讯 | 广电计量成为亚马逊SPN服务商 助力跨境企业出海!04-07
走进实验室 | 3分钟,带您了解测绘计量!04-07
走进实验室 | 天津广电计量服务能力介绍,看完就知道!04-07
聚焦新材料,新材料(磁性材料)分析测试解决方案技术研讨会暨“全国分析测试技术联盟”成立会议圆满落幕04-07
新锐产品 │ 海光原子吸收E50荣获“仪器设备新锐产品”殊荣04-07
2024青岛分析测试学会盛会即将开幕04-07
致力创新 │ 海光荣获“北京市企业技术中心”称号04-07
海光邀您参加第二十五届全国光谱仪器学术研讨会04-07
原子荧光光度计培训班欢迎您参加!04-07
德国斯派克常州用户交流会期待您的莅临04-07 市场部
会议回放|screenIT™ - 以 CRYSTAL POWDERDOSE 简化催化筛选04-06 力扬 NIKYANG
千里莺啼绿映红,巢湖观鸟公益行04-04 WAYEAL皖仪
科技驱动 中国智造 | 皖仪科技即将远航,亮相慕尼黑Analytica 2024国际舞台04-04 WAYEAL皖仪
清明 | 护净水清泉,润世间万物04-04
气清景明 万物赋新04-04