项目文章 | 山西农大虾青素减肥降脂的作用机制成果见刊Food&Function
2022-02-10 15:06:34, 小维 武汉迈特维尔生物科技有限公司


雨生红球藻中的虾青素通过调节高脂饮食小鼠的脂质代谢和肠道微生物群减轻肥胖
期刊:Food & Function
影响因子:5.396
时间:2021.8
单位:山西农业大学农学院分子农业与生物能源研究所

2021年8月,山西农业大学农学院在Food & Function发表了名为“Astaxanthin from Haematococcus pluvialis alleviates the obesity by modulating lipid metabolism and gut microbiota in mice fed high-fat diet”的研究论文。本研究利用生理生化-组织染色-脂质组学-微生物组学的技术和方法,研究虾青素(AST)减肥降脂的作用机制。结果显示,AST通过调节脂质代谢和优化厚壁菌与拟杆菌的比例和抑制肥胖相关致病微生物组的丰度来缓解HFD引起的肠道微生物组失调,而促进与糖脂代谢相关的益生菌的丰度,从而达到减肥降脂的作用。这为开发高质量的AST功能性食品和饮食活性物质在肥胖症中的应用提供了理论基础。
肥胖是一种全球性的慢性疾病流行,归因于脂肪组织中脂质的异常积累。雨生红球藻中的虾青素(AST)是一种天然的类胡萝卜素,具有抗氧化、抗脂肪生成、抗糖尿病等功效。在这里评估了AST在预防肥胖和调节肠道微生物群组成以抵抗高脂肪饮食下的不良影响方面的功效,以阐明其在高脂饮食喂养的小鼠中的功效和机制。迈维代谢为本研究提供了肠道菌群+脂质组联合分析服务。



1、虾青素纯化——AST的高效液相色谱纯化
从图1C中,可以看到有三个主要的峰,trans-AST (12.203),虾红素(13.432)和9 cis-AST (15.914)。各化合物的峰面积如下: trans-AST (831.90)、虾红素(47.40)和9 cis-AST (13.10)。AST的分离和纯化步骤如所示(图1A和图1B)。AST纯度=(831.90+13.10)/(831.90+47.40+13.10),得分±94.69%;trans-AST的比例达到93.22%,而9 cis-AST的比例仅为1.47%。AST的个较高纯度可以满足进一步研究的要求。
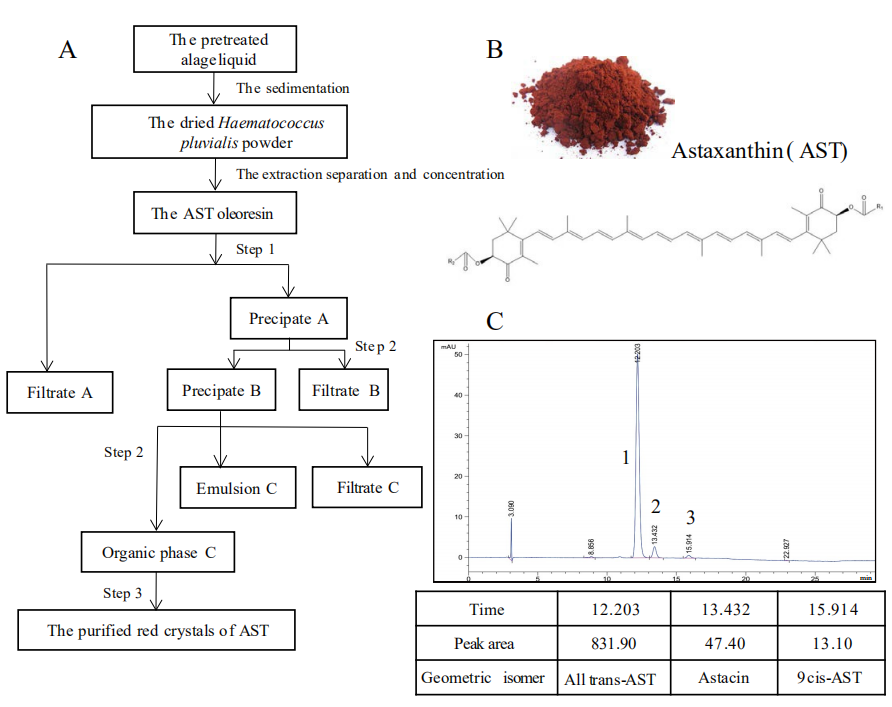
图1 AST的分离纯化步骤及AST的高效液相色谱分析
2、表型统计——补充AST可降低HFD诱导小鼠的体重和脂肪量
为了证明AST是否表现出抗肥胖效果,连续12周喂食HFD的雄性C57BL/6小鼠作为肥胖模型。在接下来的三周HFD干预后,最终体重、体重增加和相对脂肪组织重量高于正常饮食组的相应值,同时能量摄入和食物效率比更高(p < 0.05)。这些结果表明,通过喂食HFD(表1)来加速肥胖模型。结果显示,当与HFD-alone相比时,HFD + ASTM和HFD + ASTH组显示最终体重、体重增加和食物效率比显著降低(p < 0.05),而每日能量摄入没有明显变化。此外,HFD + ASTM和HFD + ASTH组与单独喂食HFD的相比,小鼠肾周和附睾脂肪组织的重量显著降低(p < 0.05)(表2)。奥利司他干预后,同样的效果 (减少最终体重、体重增加、肾周和附睾脂肪组织)显著实现,这可能是由于其药理活性。结果表明,AST能以剂量依赖的方式降低体重增加、食物效率比和相对脂肪组织重量。此外,与HFD组相比,经AST治疗后,肝脏重量分别显著下降至66.5%和59.5%(p < 0.05)。在六组中,除肝脏外,其他器官重量没有显著差异,这表明喂食HFD的小鼠没有器官损伤,AST没有明显的副作用,这与之前的研究一致。基于以上所述,食用50 mg/kgBW和100 mg/kgBW的AST可以通过抑制小鼠的食物利用来有效降低其体重和脂肪积累。


3、生理生化指标——AST对HFD小鼠血脂和生化指标的影响
本研究提出了六项血清功能指标。如图2所示,与ND组相比,HFD组小鼠表现出血脂异常,表现为TC (图2A)、TG(图2B)和LDL-C(图2C)水平显著升高(p < 0.05)和HDL-C水平降低(图2D)。有趣的是,补充AST不仅剂量依赖性地显著降低了TC、TG和LDL-C的水平(p < 0.05),而且显著地促进了HDL-C的水平(p < 0.05)。与HFD组相比,ASTH组中TG、TC和LDL-C的水平分别降低了45%、20%和16.8%,而HDL-C的水平在增加了54.5%。尽管奥利司他组血清甘油三酯和总胆固醇水平分别降至50.6%和67.6%,但其他生化参数无显著差异。结果显示AST显著改善总胆固醇和甘油三酯与HDL-C水平呈剂量依赖关系(p < 0.05)。值得注意的是,每组中ALT(图2E)和GOT(图2F)的个水平都略有不同。

图2 AST补充剂对血清TC (A)、TG (B)、LDL-C (C)、HDL-C (D)、GOT (E)、ALT (F)浓度的影响
4、组织病理学——AST对小鼠肝功能和组织病理学的影响
肉眼观察小鼠和其肝脏都都表现出AST和奥利司他有效降低肥胖小鼠的体重(图3A和图3B)。伴随着甘油三酯和总胆固醇水平的增加,HFD组小鼠的肝脏逐渐变成棕色,这可能表明非酒精性脂肪性肝病和其他代谢紊乱。有趣的是,与HFD组相比,高浓度的AST显著降低了50%和60%的肝甘油三酯水平和37%和45%的肝总胆固醇水平,分别为 (p < 0.01)(图3C和图3D)。此外,与HFD组相比,奥利司他能够降低肝脏甘油三酯和总胆固醇,分别降低36.7%和51.6%, (p < 0.01)。H&E染色和油红O染色分别显示肝脏的病理改变、脂质含量和分布。肝细胞结构正常轻度脂肪浸润,肝板排列有序,提示ND组未见病理标志。HFD诱发肝组织炎性浸润和脂肪变性,从图3中明显观察到典型的细胞病理现象,如中央静脉充血和肝窦扩张。与HFD组相比,3个剂量的AST对肝脏损伤均有明显的拮抗作用,减轻了肝脏脂肪浸润,膨大和细胞坏死数减少。其中,HFD+ASTL组和HFD+ASTM组仍可观察到中心静脉充血现象,而HFD+ASTH组肝索和肝板的排列相对正常。奥利司他组的肝损伤和中央静脉充血现象也可以观察到。与正常饮食相比,HFD显著诱导了肝细胞中大量的脂肪积累和分布,然而脂质积累集中在奥利司他组。经不同剂量的AST治疗后,肝的脂质含量逐渐降低。在HFD+ASTH组,脂质分布明显减少。这些结果表明AST的剂量依赖性消耗减少了脂滴,并且肝组织中的胆固醇积累接近ND组。

图3 AST补充剂对肥胖小鼠的影响
5、脂质组学分析——补充AST可改善肝脏脂质代谢
如PCA (图4A和图4B)所示,可以观察到ND组和HFD组之间的分离,而HFD + ASTH组与HFD组分离,这表明AST的补充改善了脂质代谢的紊乱。为了探索群体分离的水平,通过OPLS-DA分析获得了两个多变量模型来理解脂质变化,验证参数分别为ND对HFD的适合度(R2X=0.451和R2Y=0.983)和可预测性(Q2=0.657),以及HFD对HFD + ASTH的适合度(R2X=0.559和R2Y=0.995)和可预测性(Q2=0.953)。结果表明,在ND对HFD和HFD对HFD + ASTH (图4C和图4D)中观察到OPLS-DA评分图的清晰分离,这表明脂质代谢紊乱由HFD诱发,并由AST减弱。如火山图分析所示(图4E和图4F),筛选出不同的脂质生物标记候选物。使用FC ≥ 2或≤ 0.5和VIP ≥ 1的标准,HFD组和HFD + ASTH组之间有279种脂质发生了显著变化,其中大多数显著(p < 0.05)种下调。

图4在ND对HFD组和HFD对HFD +哮喘组中分析的不同脂质种类
为了进一步研究脂质生物标志物是否与AST的生物活性相关,使用UPLC-ESI-MS平台来分析脂质组成的差异。在肝组织中总共检测到1058种脂质,包括299种甘油三酯、68种甘油三酯、30种游离脂肪酸、33种神经酰胺(CER)、9种胆固醇酯(CE)、99种磷脂酰胆碱(PC)、90种磷脂酰乙醇胺(PE)和其他。如图5A所示,HFD组的TGs、DGs、FFAs、CERs、Eicosanoids、Pes、PSs、PGs、LPCs、and LPGs水平显著升高(p < 0.05),表明小鼠的脂质代谢严重紊乱。有趣的是,在高剂量摄入AST后,TG、PC、CE、DG和SM类的总水平显著降低(p < 0.05) (图5B)。结果表明,HFD引起的脂质代谢紊乱在AST治疗后得到部分改善。此外,聚类热图(图5C)显示了257种脂质种类的显著差异,包括130种TGs、13种Pes、5种CARs、2种CEs、22种DGs、18种PCs等, HFD与HFD + ASTL组比较,表明低限度的AST摄入稍微调节了脂质成分的形成。如图5D所示,在HFD +奥利司他对比HFD + ASTH中,筛选到到210个生物标志物,其中101个下调的脂质和109个上调的脂质。奥利司他和AST处理对脂质的影响不同,观察到20种具有显著差异的代表性脂质,包括15种TGs、2种FAs、1种PG、1种PI和1种PE。结果表明,AST和奥利司他的组成和功能可能是代谢产物不同的原因。

图5脂质聚类分析和KEGG富集分析
对ND、HFD和HFD + ASTH组进行差异脂质分析。与ND组相比,27种脂质异常增加,包括23种甘油三酯、3种CEs和1种CAR,而HFD + ASTH组这些脂质显著降低(p < 0.05),同时CEs、DG和PCs也减少(未列出)。此外,在ND与HFD组和HFD与HFD + ASTH组之间选择了13个重要的脂质 (表3)。与ND组相比,HFD组BA(石胆酸-3-硫酸酯)、CAR(肉碱C18:2)和两种二十烷类的含量较低,而三种CEs [CE (16:1)、CE (18:1)和CE (20:1)]和五种TG[TG(17:0/18:1/18:1)、TG (15:0/18:1/22:1)、TG (9:0/1)的含量较高。因此,这些结果表明,13种脂质,包括1种BA、2种类花生酸、3种CEs、5种TGs和2种CARs,可能是负责AST降脂作用的潜在生物标志物。

6、KEGG富集分析
KEGG富集分析为参与脂质物种差异的生化和信号转导途径提供了线索。结果表明,37条代谢途径集中在ND组和HFD组之间的条目,可归因于五个项目:生物系统(13)、代谢(11)、人类疾病(8)、环境信息处理(2)和细胞过程(3)。与ND组相比,喂食HFD的小鼠在甘油脂代谢、胆固醇代谢、脂肪消化和吸收、产热、胰岛素抵抗和脂肪细胞途径的脂解调节方面明显具有破坏作用,而AST补充和奥利司他干预都改善了这些症状(图5E-F)。
7、微生物组分析——补充HFD和AST引起的肠道微生物群结构变化
为了阐明AST治疗对HFD诱导的肥胖小鼠肠道微生物群的贡献,采用了16S rRNA测序分析。通过PCoA和NMDS分析确定了6组的OTU丰度,较好地反映了各组肠道结构的差异。PCoA分明显区分了HFD组和ND组;此外,AST处理组和奥利司他处理的组也清楚地与HFD组分离(图6A和图6C)。PCo1占总变异的43.19%。基于维恩图(图6B)中每个比较组的交叉点,观察到195种常见的差异代谢物,并且每个比较组具有独特的差异代谢物。因此,就微生物多样性而言,差异代谢物可以清楚地区分AST治疗与其他组。

图6比较组中重叠和独特的代谢物
关于微生物群落,Chao1指数常用来表示丰富度,Shannon和Simpson指数表示多样性,Pielou的均匀度指数用表示均匀度。Chao1指数越大,群落越丰富。同样地Shannon和Simpson指数越高,群落的多样性就越大。结果显示了肠道微生物群落的多样性指数(表4)。与ND组相比,HFD组的Chao1指数显著增加,而Shannon和Simpson指数和Pielou均匀度的水平没有观察到明显差异。所有疗法均显著提高各项指标(p < 0.05)。结果表明,AST能提高肥胖小鼠肠道微生物的丰度和多样性。

8、微生物组分析——AST干预调节了HFD喂养小鼠肠道微生物群的特定门
门丰度图(图6D)显示,分析了与体重调节相关的肠道微生物群,其中厚壁菌门和拟杆菌门都是主要细菌。从食物中吸收热量导致厚壁菌门和拟杆菌门的比例变化,是体重增加或减少的部分原因。当肠道中厚壁菌门多于拟杆菌门时,身体增加了热量的摄入,导致肥胖。与ND组相比,而HFD组厚壁菌门的丰度降低,拟杆菌门的丰度增加。有趣的是,与HFD组相比,补充AST的小鼠厚壁菌门的丰度显著降低(p < 0.05),但拟杆菌门的丰度增加。然而,这一现象在HFD +奥利司他组中被完全逆转。此外,AST补充还提高了放线菌的丰度,降低了变形菌的丰度,而奥利司他对富集菌更有效。图6E描绘了科水平丰度。与ND组相比,HFD组细菌菌群发生了6次显著变化,其中脱硫弧菌科、丹毒杆菌科和乳球菌科的相对丰度显著增加(p < 0.05),而有益拟杆菌科、理研菌科和毛螺菌科的相对丰度降低。
表面上,AST补充组的细菌相对丰度与HFD组相反,尤其是S24-7和拟杆菌。奥利司他干预后,丹毒杆菌科和脱硫弧菌的丰度显著增加(p < 0.05),这与AST治疗的明显不同。根据肠道微生物群的热图,关于益生菌在喂食HFD的小鼠中的促进功能,奥利司他在富集双歧杆菌中更有益,而AST+ ASTH对副杆菌和乳杆菌科具有更有益的效果(图6E)。结果表明,奥利司他调节肠道微生物群的机制不同于AST的机制,AST可能作为脂肪酶抑制剂。
聚类热图和LEfSe分析评估富集的细菌,在科、纲、目和属的水平上鉴定每组的中等差异生物标志物(图7A)。图7B显示31个相对丰度最大的单元,包括软壁菌门、疣粒菌门、双歧杆菌、杆菌、丹毒丝菌、柔膜细菌、拟杆菌_TM7_3、拟杆菌_RF39、乳酸杆菌、白粉菌属、根瘤菌、CW040、毛癣菌等。如图7C所示,在HFD诱导组中,德哈氏菌科的丰度显著增加(p < 0.01),这可能部分地诱导了结肠炎的发病机制。与HFD组相比,有26个细菌群落因摄入AST而发生变化,并且细菌群落中理研菌科、S24-7、Olsenella和Coriobacteriales的丰度增加(图7D)。与奥利司他相比(图7E),高剂量的AST增加了S24-7、拟杆菌科、乳杆菌科和Akkermansia的相对丰度,但降低了双歧杆菌的丰度。

图7微生物群落分析
9、qRT-PCR——补充AST对肝脏脂质代谢相关基因表达的影响
为了探索AST对肥胖的潜在机制,通过qRT-PCR进一步研究与脂质代谢相关的基因的转录水平(图8A和图8B)。定性和定量分析均发现,与ND组相比,HFD组的基因表达水平(包括AdipoR1、PGC-1α、PPARα、AMPK和LXRα)受到显著干扰(p < 0.05),而这些基因在HFD + ASTH组显著上调。此外,补充AST显著降低了调节脂肪生成的转录因子SREBP1c的表达及其下游的FAS和SCD-1的表达(p < 0.05),这两者与脂质和胆固醇的合成密切相关。

图8ND、HFD和HFD +ASTH组AMPK/SREBP1c代谢途径中相关基因的表达水平

本研究利用生理生化-组织染色-脂质组学-微生物组学的技术和方法,研究虾青素(AST)减肥降脂的作用机制。结果如下:
1、表型统计分析显示,高脂饮食诱导小鼠体重和脂肪增加;而AST可以有效地改善高脂饮食引起的小鼠肥胖症状;
2、生理生化指标分析显示,高脂饮食会引起小鼠血脂相关指标异常,而补充AST可以改善血脂异常;
3、组织病理学观察显示,高脂饮食增加肝脏中脂滴积累,而补充AST后显著降低脂滴积累;
4、脂质组学分析显示,高脂饮食引起小鼠脂质代谢紊乱,而AST能减弱这种代谢异常水平;
5、微生物组学分析显示,AST调节高脂饮食引起的肠道微生物群落变化,进而调节脂肪酶活性来降低肥胖;
6、qRT-PCR分析显示,AST调节脂肪生成相关基因的表达,进而调节脂质和胆固醇的合成。
综上所述,AST为开发高质量的功能性食品和饮食活性物质在肥胖症中的应用提供了理论基础。
99%的代谢组学研究者都在阅读下文:
●项目文章 | IF=22!新冠患者肠道微生物功能受损的后遗症研究
●重磅综述 | 如何完善微生物组与疾病之间的证据链?从相关性到因果关系的5个层次

我就知道你“在看”

03-21 四方仪器
展会第一天 | 现场火热,明日W5.5300展位精彩不容错过!03-20
设备更新!杭州大微国产高端微生物设备选型方案03-20 DW
选型指南|助力提升教学科研水平03-20 Don Lin
新质生产力 赋能助科研 ——精微高博仪器助力大规模设备更新03-20
以旧换新行动方案|赛默飞基因科学多平台方案全面助力03-20 赛默飞基因科学
中科科仪亮相SEMICON China 2024,助力半导体产业蓬勃发展03-20
新版交通部行业标准配套试验设备推荐系列之集料篇03-20 公路部
日月阳阴两均天,玄鸟不辞桃花寒03-20
技术分享 | 在线颜色测量的意义是什么?03-20 爱色丽彩通
线下活动报名 | 爱色丽 x 上海金属包装协会联合活动03-20 爱色丽彩通
爱色丽 x 琅世 | 邀您共赴广州interzum材料展03-20 爱色丽彩通
喜大普奔丨国家喊你更新仪器设备啦!03-20
基于脂质纳米颗粒的递送系统——mRNA疫苗的竞争领域03-20
邀您看展→上海禾工科学仪器有限公司参展第十六届重庆国际电池技术交流会/展览会03-19
TOP10出炉!2023科学仪器行业十大杰出雇主投票,人气榜单公布03-19 珂睿marketing
5万亿设备更新!珂睿科技助力国产科学仪器设备高质量发展03-19 珂睿marketing
《换新方案》,为大力发展“新质生产力”做出GE医疗中国的贡献!03-19
改善峰形,提升灵敏度,六大“金刚”齐亮相!03-19 产品市场部
上海市委常委、浦东新区区委书记、中国(上海)自由贸易试验区管委会主任朱芝松率队到安捷伦走访调研03-19