Cell Metabolism | 空间代谢组学探究MYC、SREBP1与肿瘤发生的能量机制探索
2022-01-06 19:46:38, 多层组学定制服务 上海欧易生物医学科技有限公司

● 前言
斯坦福大学Dean W. Felsher课题组在Cell Metabolism发表的题为“The MYC Oncogene Cooperates with SterolRegulated Element-Binding Protein to Regulate Lipogenesis Essential for Neoplastic Growth”的研究成果,通过空间代谢组学、CHIP、RNA-seq、NMR和IHC等技术研究癌基因MYC促进肿瘤发生机制,发现MYC与胆固醇调节元件结合蛋白(SREBP1)协同调节脂质生成,从而促进疾病的发生。

中文标题:MYC癌基因与固醇调节元件结合蛋白协同调节肿瘤生长所必需的脂肪生成
研究对象:小鼠
发表期刊:Cell Metabolism
影响因子:27.287
合作单位:斯坦福大学
运用生物技术:空间代谢组学、CHIP、RNA-seq、NMR和IHC等
● 研究背景
MYC是一种原癌基因,在细胞增殖、凋亡、分化等多种细胞生物学过程中发挥作用,其易位、扩增或表达异常常与多种肿瘤的发生发展有关。近年来关于MYC在脂质代谢中的研究很多,据了解MYC与脂肪酸合成相关酶密切相关;致癌基因MYC刺激细胞生长需要脂质来组装新的细胞膜,但是否仅由MYC调节还是与其他因素协同调节尚不清楚。因此本文主要是揭示MYC诱导的癌症中脂质生成的机制。
● 研究思路

● 研究结果
1. MYC调控脂肪生成
作者对P493-6B细胞淋巴瘤系(BCL)进行了全基因组表达谱、核突变和ChIP分析,发现MYC诱导增加了包括ACLY、ACACA、FASN和SCD1及其相关蛋白在内的脂肪酸(FA)合成基因的mRNA表达,在MYC诱导的肝细胞癌(HCC)、急性白血病(T-ALL)和肾细胞癌(RCC)的三种体内转基因小鼠模型中也有类似表达。还发现MYC与这些FA合成基因的启动子结合并启动mRNA转录,如甲羟戊酸和胆固醇途径基因的启动子。

图1 | MYC上调脂质代谢基因
2.MYC激活并与SREBP1协同诱导脂肪酸合成
为了了解MYC和SREBP1之间的相互作用,作者首先,对这两种蛋白进行ChIP和re-ChIP分析,证明MYC和SREBP1都可以发现与FA合成基因启动子中的相同DNA分子结合(图1)。SREBP1的敲低也降低了FA合成基因的表达,但不降低MYC基因的表达。其次,ChIP的MYC与启动子结合,不仅调节FA合成基因的表达,还调节糖酵解和谷氨酰胺分解基因的表达。因此,MYC似乎会依次调节参与脂质合成的基因:首先诱导葡萄糖和谷氨酰胺,然后诱导FA合成相关基因。通过RNA测序(RNA-seq)发现,增加MYC水平会引起糖酵解、谷氨酰胺分解和FA合成。
作者还发现MYC结合胆固醇生物合成基因的启动子,诱导胆固醇生物合成的关键酶,并调节SREBP1。此外,通过RNA-seq和Western Blot分析,证明MYC调节BCL和HCC中的HSREBP1和SCAPIN。这表明MYC通过直接结合和SREBP1调节脂肪生成。
为了确定FA合成是否可以由MYC独立于SREBP1进行,作者在一个容易转染的细胞系EC4(MYC诱导的HCC细胞系)中通过siRNA敲除了SREBP1。结果表明,SREBP1的敲除降低了FA合成基因,但对MYC基因表达没有任何影响。
以上结果表明MYC可以与不依赖于SREBP1的FA合成基因的启动子结合,但这种结合不足以促进这些基因的表达。此外,MYC驱动SREBP1的表达和启动子结合。MYC诱导SREBP1表达,MYC和SREBP1结合到FA合成基因启动子上以诱导转录。因此,MYC和SREBP1在前馈转录环中协同调节FA合成。

图2 | MYC上调脂质代谢基因
3. MYC调节的葡萄糖和谷氨酰胺代谢有助于脂肪生成
作者使用NMR对C原子进行示踪实验,发现MYC驱动葡萄糖和谷氨酰胺的C参与脂肪生成(图3)。采用空间代谢组学检测小鼠模型以及人BCL细胞中的FA,发现MYC肿瘤中不饱和脂肪酸(FA(18:1))的丰度增加。进一步发现13C-油酸酯在MYC诱导的BCL细胞未发生代谢,而13C-葡萄糖增加了不饱和FA中的标记碳。当MYC失活时,细胞中3H标记的棕榈酸酯氧化速率明显变高。MYC-ON和MYC-OFF的BCL细胞中的油酸酯均未被氧化。因此,MYC可能在抑制FA氧化的同时上调FA的合成。
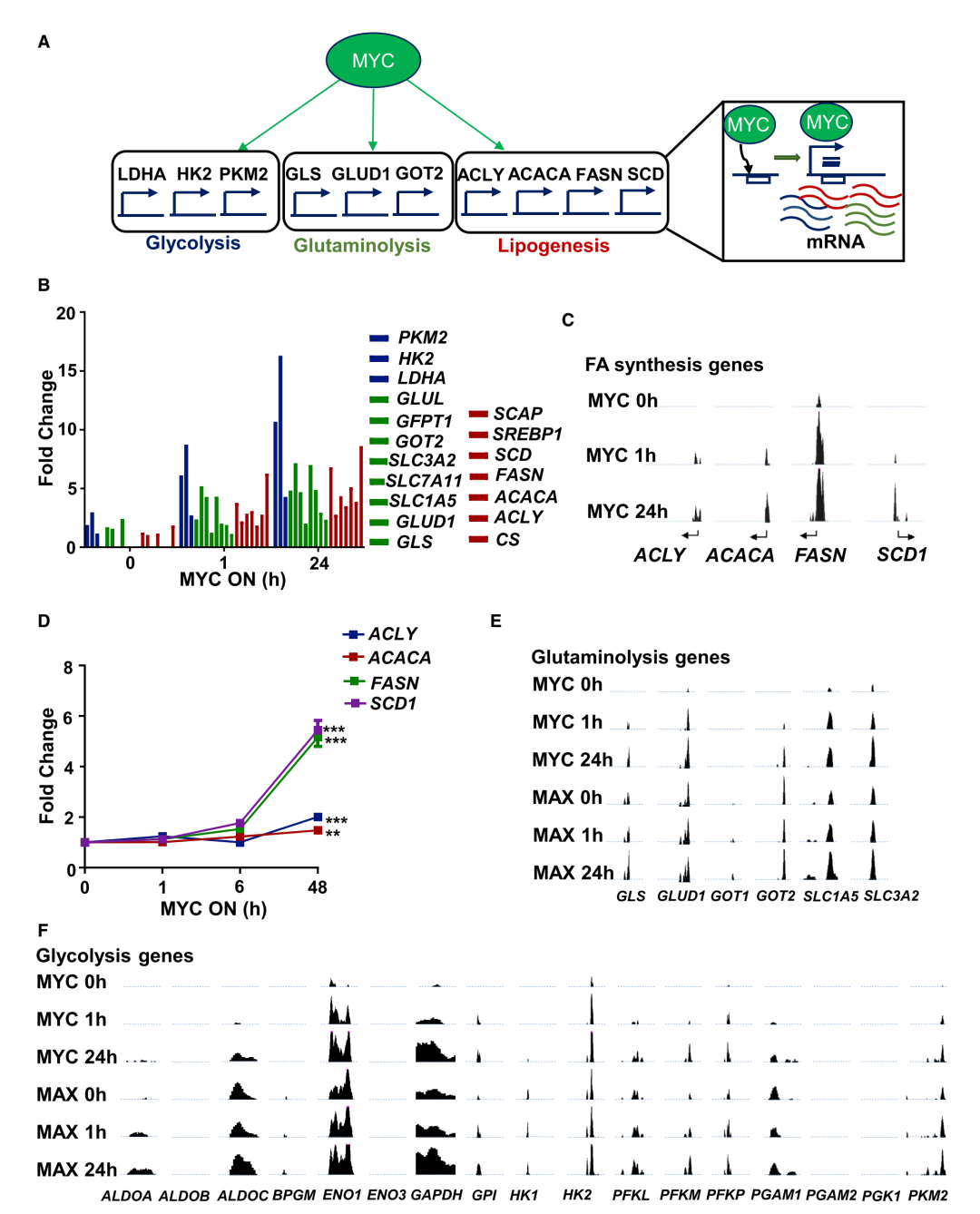
图3 | MYC协调糖酵解、谷氨酰胺解和脂肪生成
4.MYC调节体内复合脂质合成
通过空间代谢组学测量了四种转基因小鼠模型(肺癌(LC)、RCC、HCC和T-ALL)中甘油磷脂(GPs)的含量,发现在不同的肿瘤中,MYC诱导改变了磷酸酰甘油(PGs)的丰度(图 4A),能够增加了大多数PG物质。MYC失活后,PG丰度恢复到基础水平(图 4B)。PGs由磷脂酸(PA)通过向3-磷酸甘油中添加两种FA形成,因此,PG诱导可以建立在MYC促进的FA增加的基础上。然而,在体内PGs相对于其他GPs的相对优先合成,这意味着MYC有除FA合成之外的其他方式调节脂肪生成。

图4 | MYC诱导的HCC、RCC、T-ALL、LC细支气管和腺瘤的脂质特征
5.MYC具有促进PG合成的作用
通过空间代谢组学检测到正常肾脏与MYC诱导的肿瘤之间的GPs丰度(m/z:700–1000),发现两组存在显著差异,尤其是m/z在865的显著增加。酰基侧链较短(18个碳或更少)的PG在MYC激活的前15天呈现增加趋势,然后开始减少,但酰基侧链较长的PG含量持续增加(图 5)。MYC失活后,这些差异在很大程度上是可逆的。

图5 | 空间代谢组学检测到的PG动态变化图
6.MYC诱导PG合成并拉长FA链
通过体外实验证明,MYC的诱导和MYC失活能够增加和降低了PG合成基因的mRNA(图6 C)。并且MYC活化还上调了FA延长酶ELOVL2和ELOVL6的mRNA表达丰度(图6D)。结果显示,MYC参与调节FA生成和相关基因的表达。

图6 | MYC诱导PG合成
7.MYC以组织依赖的方式改变甘油磷脂酰肌醇代谢
研究表明,MYC对磷脂酰肌醇(PI)代谢具有组织特异性。作者通过空间代谢组学检测到RCC和T-ALL中,MYC可逆地降低了PI;但在LC和HCC中,MYC反而增加了这些物质(图 7)。可能是由于肺表面富含PG和PI,MYC才会增加了LC中的PI含量。作者推断,MYC通常能够增加PGs含量,但以组织特异性方式差异调节其他GPs,如PIs。

图7 | MYC与PG合成、延长酶基因结合调节PIs
8.肿瘤发生需要MYC调节脂肪生成
最后作者对脂肪生成在MYC诱导的肿瘤发生中的作用进行了探究,通过空间代谢组学、IHC和Western Blot等方法证明通过体外抑制FA合成可以抑制MYC诱导的脂肪生成,从而抑制了RCC、HCC和BCL的增殖(图 8)。

图8 | 抑制脂肪酸的合成可以降低癌症的增殖
● 研究结论
结果表明,原癌基因MYC与SERBP蛋白共同调节肿瘤生长所必需的脂肪生成,MYC诱导SREBP1,然后二者共同激活脂肪酸合成并利用葡萄糖和谷氨酰胺促进脂肪链的延伸。
小鹿推荐
通过空间代谢组学技术,能够观察到MYC诱导后不同癌症的体内脂质组学变化,准确地绘制MYC特异性脂质代谢的位置,因此可以利用这一癌症的致命弱点,用于新的抗脂质药物研究开发。
.
文末看点|lumingbio
在获得空间代谢组学AFADESI平台原创团队全力支持下,截止2021年9月,鹿明生物已经完成共计近千例样本经验,包括心脏、脑、肿瘤、肠道、肝脏、肾脏、皮肤等十几种组织样本空间代谢组学检测及分析,检测物质涵盖胆碱类、多胺类、氨基酸类、肉碱类、核苷类、核苷酸类、有机酸类、碳水化合物类、胆固醇类、胆酸类、脂质类等多种类代谢物。欢迎各老师长按扫描下方二维码咨询~


长按扫码咨询鹿明生物技术工程师
猜你还想看
END
叮当 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
10-19 NanoTemper
北大瞿礼嘉团队又一Cell力作!Monolith再次助力植物有性生殖机制研究获得突破!10-19 NanoTemper
NanoTemper周年庆宠粉进行时,福利不缺席!10-19 NanoTemper
生殖健康检测技术迭代,CE平台凭什么出圈?10-19 赛默飞基因科学
DW行业解决方案|中药材中微生物质量控制检验10-18 DW
大深度·真三维丨TRT-V8000隧道超前地质预报产品发布会暨用户交流会10-18 专注进步的
限时促销 | 高通量筛选蛋白的不二之选10-18 赛默飞生命科学
手把手教学!EPR基础实验视频第五期:TEMP捕获单线态氧实验10-18 CIQTEK
国仪量子携手清华磁共振实验室为您答疑解惑!顺磁小课堂第26期10-18 范莹莹
学术交流|第二十一届全国等离子体科学技术会议即将召开,卓立汉光邀您共聚广州(展位号C05)10-18 光电行业都会关注
明日开讲 |中国科大—樊逢佳教授:量子点的诞生,更有多重直播福利,欢迎预约!10-18 光电行业都会关注
【聚焦激光】TDLAS应用波长计推荐10-18 聚焦光电前沿领域
喜报!上海天美、天美天平双双荣获2023年度上海市专精特新企业!10-18 天美
喜报!上海天美、天美天平双双荣获2023年度上海市专精特新企业!10-18 天美
突破溶出局限,以流池法助力口溶膜制剂研发10-18 力扬 NIKYANG
3招有效“摸鱼”,找回眼睛好状态!10-18
《坚如磐石》爆火,利培酮的用药监测方案您知道吗?10-18 珂睿marketing
会议预告|第十二届李曼中国养猪大会即将召开,天隆邀您共聚长安10-18
以质量求生存 凭创新谋发展 上海美析精彩亮相第60届高博会10-18 管理员
年末大促开始啦!千万别错过!!!10-18