16S+代谢组学助力发文医学一区行业顶刊《Gastroenterology》
2021-01-28 11:17:41, 多层组学定制服务 上海鹿明生物科技有限公司

点击上方“蓝色字体”关注我们

前言
上期小鹿针对16S+代谢组学在植物中的应用(详情请戳 项目文章EST | GC-MS代谢组学助力南京大学赵丽娟课题组再登环境科学TOP期刊)对AgNPs生态影响提供了全新研究视角,本期小鹿从医学角度出发探讨16S+代谢组技术在医学研究中的应用。
项目文章EST | GC-MS代谢组学助力南京大学赵丽娟课题组再登环境科学TOP期刊)对AgNPs生态影响提供了全新研究视角,本期小鹿从医学角度出发探讨16S+代谢组技术在医学研究中的应用。
本篇为2020年2月发表于Gastroenterology杂志(IF= 19.233)医学一区标题为“Lactose and Fructo-oligosaccharides Increase Visceral Sensitivity in Mice via Glycation Processes, Increasing Mast Cell Density in Colonic Mucosa”的研究论文,该研究运用16S+代谢组学方法首次探讨了FODMAP增加腹部敏感性的机制,发现由微生物代谢物引起的糖基化反应是减轻IBS患者腹痛症状的关键。
标题:乳糖和低聚果糖通过糖基化过程增加结肠粘膜的肥大细胞密度,从而增加小鼠内脏敏感性
期刊:Gastroenterology
影响因子:19.233
发表时间:2020年2月
运用生物技术:16S rRNA基因测序,LC-MS非靶向代谢组
研究背景
肠易激综合症(IBS)是一种功能性胃肠道疾病(FGID)和异质性疾病,其特征为腹痛、腹胀、肠蠕动不规律以及大便稠度的变化。有4种明确的亚型,腹泻(IBS-D)或便秘型IBS(IBS-C),混合排便习惯(IBS-M)或未分类(IBS-U)。近年来低FODMAP饮食(可发酵的寡糖,二糖,单糖和多元醇)已成功用于减轻IBS症状,但对IBS的作用机制了解不多。
在这项研究中,作者验证了这样的假设,在某些FODMAP的发酵过程中,醛类物质的产生增加了非酶促糖基化反应,可以直接或间接诱发IBS症状。作者在动物模型中使用乳糖和低聚果糖作为FODMAP的代表,通过激活AGER来评估长期增加FODMAP摄入量对内脏敏感性和低度炎症的影响。作者还研究了肥大细胞对这种慢性干预的影响 ,发现肥大细胞是IBS症状的关键参与者,易受AGER激活。
技术路线

实验方法
1.实验分组
(1)乳糖组:口服乳糖组;生理盐水对照组;
(2)乳糖组/吡哆胺组:口服乳糖组;口服吡哆胺组;口服乳糖+吡哆胺组;口服生理盐水对照组;
(3)低聚果糖组:口服低聚果糖组;口服低聚果糖+吡哆胺组;口服生理盐水对照组;
2.生理/病理分析
腹部敏感性、免疫荧光、肥大细胞计数、AGER表达、肠道炎症验证;
3.粪便微生物组分析
16S rRNA基因测序
4.代谢组学分析
LC-MS非靶向代谢组分析
实验结果
1.服用FODMAP后敏感性提高
与对照组相比,用乳糖喂养3周可增加内脏敏感性(图1)。乳糖与吡哆胺一起服用可有效逆转乳糖对基础内脏敏感性反应的作用。后爪的机械刺激实验表明低聚果糖显著提高了腹部敏感性,吡哆胺可降低增加的腹部敏感性(图2)。

图1 | 饲乳糖/吡哆胺腹部敏感性
饲乳糖/吡哆胺3周后,随着扩张量的增加,内脏敏感性增加;
(灵敏度表示为最大平均控制响应的百分比,N = 12)
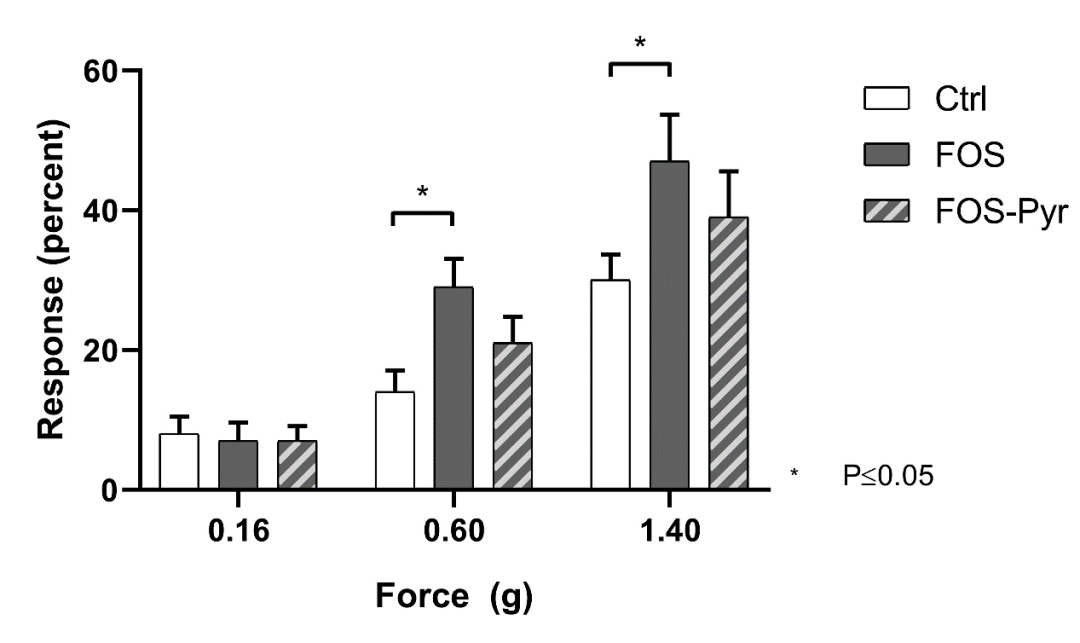
图2 | 添加或不添加吡哆胺低聚果糖的敏感性
在饮食中添加或不添加吡哆胺(1 mg / mL)的低聚果糖饮食后,对后爪机械刺激的敏感性增加(N=10);
2. 结肠粘膜肥大细胞数量显著增加
乳糖和低聚果糖均显著增加近端结肠粘膜肥大细胞的数量(图3),乳糖没有显著增加远端结肠的肥大细胞的数量,而低聚果糖饮食增加了近端结肠和远端结肠的肥大细胞。乳糖和低聚果糖组的近端结肠上皮细胞中AGER表达免疫荧光强度更高(图4)。FOS +吡哆胺组的AGER表达明显低于相应对照组。

图3 | 近端结肠粘膜肥大细胞分析
(A)用5mg乳糖和/或吡哆胺治疗3周后,粘膜肥大细胞免疫荧光染色结果;
(B)粘膜肥大细胞(MC)计数;
(C)低聚果糖饮食3周,添加或不添加吡哆胺(1mg / mL)的动物近端结肠的黏膜肥大细免疫荧光染色结果 ;
(D)低聚果糖饮食3周,添加或不添加吡哆胺(1mg / mL)的动物近端结肠的黏膜肥大细胞(MC)计数。

图4 |近端结肠粘膜上皮细胞分析
(A)用5mg乳糖/吡哆胺(Pyr)处理3周的动物近端结肠的上皮AGER免疫荧光染色的代表性图像;
(B)乳糖实验近端结肠粘膜上皮细胞中AGER染色的强度;
(C)低聚糖果饮食,饮用水添加或不添加含吡哆胺(1mg / mL)对动物的近端结肠进行上皮AGER免疫荧光染色的代表性图像;
(D)低聚果糖实验近端结肠粘膜上皮细胞AGER染色的强度。
3.乳糖和低聚果糖对肠蠕动特征的影响
与对照饮食相比,富含低聚果糖的饮食增加了粪便的水分含量和盲肠重量,并减少了运输时间。 口服乳糖对这些参数没有显著影响,添加吡哆胺不会影响对照或FODMAP处理组动物的这些特征(图5)。

图6 | 16S rRNA基因测序分析
通过16S rRNA基因测序确定乳糖、吡哆胺对粪便微生物群落分布和多样性的影响
(每天用5mg乳糖和/或吡哆胺治疗)
(A)根据组划分的样本中每个OTU的患病率;
(B)根据组划分的每个门的相对丰度(%);
(C)通过Chao1和Simpson指数测量的丰富度(α-多样性);
(D)未加权(左)和加权(右)Unifrac多维标度图,表示组之间的结构变化(β多样性)(多样性分数以百分比形式表示);
4.乳糖和吡哆胺不会引起粪便微生物群组成的显著改变
不论测试的α多样性指数是多少,无论是乳糖、吡哆胺还是两者的组合都不能显著改变OTU的数量,如丰富度和均匀度(图6)。所有动物敏感的炎症生物标记物Lipocalin-2均为低水平(未有炎症)(图7)。

图5 | 用FODMAPs处理的动物的粪便含水量
(A)粪便水分含量;
(B)盲肠重量;
(C)乳糖基团的通过时间;
(D)粪便水分含量;
(E)粪便重量和(F)对照或富含果糖-低聚糖饮食动物的通过时间;

图7 | 不同样本处理脂蛋白的浓度
用乳糖(A)或低聚果糖(B)和/或吡哆胺处理的动物粪便中脂蛋白的浓度,以pg / mg粪便表示,没有表现出炎症的脂质运载蛋白水平升高;
相关讨论
口服乳糖和低聚果糖都可导致敏感性增加以及结肠粘膜肥大细胞计数 的增加,单独摄入FODMAP可以增加这些敏感性。服用吡哆胺(一种公认的抗糖化剂)可以预防乳糖和低聚果糖的影响,表明糖基化过程参与了对两种FODMAP的作用。吡哆胺同样可以预防结肠上皮细胞在FODMAP实验的增加。
通过LC-MS非靶向代谢组学分析结肠内容物中醛类物质来评估结肠腔中糖化剂的生成。与对照组相比,FODMAP处理组结肠内容物中醛类物质显著增加(图8)。尽管吡哆胺有阻止FODMAP诱导的作用,但在结肠内容物上清液中,FODMAP与FODMAP +吡哆胺的醛类物质分布图中未发现特异性差异。这可以用小肠有吸收吡哆胺的强大能力来解释,导致肠道组织发生全身性而不是局部的抗糖基化反应。

图8 | 对照组的醛类物质的衍生离子值低于FODMAP处理组
与用低聚果糖治疗的小鼠相比,作者发现在用乳糖处理的小鼠中肠蠕动特征(大便中水分、排泄时间、转运时间)没有变化。与对照相比,低聚果糖组显示出水分含量较高和转运时间减少。吡哆胺不能逆转对照和果糖低聚糖饮食之间的粪便水分含量和转运时间的差异。
FODMAP的摄入会增加近端结肠的水和可发酵物质,进而导致膨胀。虽然增加敏感度是IBS患者因食用FODMAP引起不适的原因,但并没有消除减少FODMAP摄入量会减少这种膨胀的事实。FODMAP本身不可能引起IBS,但通过本研究发现,它会引起可能引起IBS症状的生理变化。因此FODMAP在IBS中的作用是多因素的。除了先前报道的由饮食FODMAP引起的渗透压和扩张相关症状产生外,其微生物加工过程中的反应性醛类发酵产物还会引起结肠的生理变化,特别使人联想到IBS。
实验结论
口服乳糖或低聚果糖可增加小鼠的腹部敏感性,与结肠肥大细胞数量增加和AGER表达有关,该症状可用抗糖化剂预防。乳糖/吡哆胺未对小鼠粪便微生物产生明显影响,糖基化反应可以减轻对FODMAPs敏感的IBS患者的腹痛。
小鹿推荐
肠易激综合征(IBS)是一种广泛存在的胃肠道疾病,低FODMAP 饮食被认为是一种能够有效缓解 IBS 症状的饮食方法。本文作者使用16S rRNA基因测序和LC-MS非靶向代谢组验证醛类物质含量等方法,首次探讨了FODMAP增加腹部敏感性的机制,发现由微生物代谢物引起的糖基化反应是减轻IBS患者腹痛症状的关键。在本研究中,这些发现可能有助于开发功能性营养策略,也对类似研究提出新的解决思路。
文末看点
一席讲座
深度剖析
5月28-29日
2天时间,带您get不可不知的快速发文研究思路;两位资深技术专家与您相约线上课堂,深入剖析高分文章的研究思路与逻辑构架!

文献参考
J.B.J. Kamphuis et al. Lactose and Fructo-oligosaccharides Increase Visceral Sensitivity in Mice via Glycation Processes, Increasing Mast Cell Density in Colonic Mucosa[J]. Gastroenterology, 2019
猜你还想看
◆开年客户文章解读 |Microbiome(IF=10.465)运用GC-MS非靶标代谢组学研究植物根际微生物对开花时间的影响
END
嫣然 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
01-27 Pribolab
第五个产品Molidustat获批,HIF-PH抑制剂竞争将很快白热化01-27 Himalaya
药品注册现场核查之研发现场准备事项01-27 偶阵雨
光学显微镜在制药中的应用浅析01-27 迎风而立 编译
课程报名 | 保护药品研发成果,这2项专利制度你必须知道!01-27
2021年中国宏观展望01-26 任泽平
苏-57战机正式列装意义几何01-26 李旭吴腾章子星
大型、重型和超重型 ——商业发射服务的未来是地月经济01-26 李刚
猎杀航母的利器——巡航导弹式无人机01-26
大国竞争中,3个关键新兴信息技术01-26 高级评论员
美政府公布《美国印太战略框架》部分解密内容01-26 陈银娣 郑惠文
美国新国防授权法强化对华科技竞争的新举措01-26 穆玉苹
新型MQ-9B“海上卫士”将助力美海军实现分布式反潜战01-26 黄鑫
考个环境管理工程师, 升职加薪01-26
【干货分享】市环境局最新发布近100页的土壤污染状况调查与风险评估工作指引01-26
省厅环评处理:通报批评13家环评单位、12名环评人员、2个环境分局01-26 安徽省生态环境厅
【干货分享】水质监测方案、大气采样方法作业指导书等01-26
环评处理:预测叠加值低于背景值01-26 德阳市生态环境局
福利免费领取:水土保持培训资料01-26
【免费领取】中国环境统计年鉴01-26
