【热点】万物皆可偶联之多肽偶联核素药物
2024-07-01 11:23:54, 市场部 钟旭 艾杰尔-飞诺美(Agela & Phenomenex)
核药,又称放射性药物(Radiopharmaceuticals),是指放射性同位素制剂或用放射性同位素标记的用于医学诊断和治疗的一类特殊药物。根据核药的用途不同,可以分为放射性诊断药物和放射性治疗药物。
与肿瘤放射治疗(放疗, Radiation therapy, RT)不同,核药可以认为是在需要治疗部位由内而外发生的辐射,而放疗则是由外向内输送的辐射。在给予相同辐射剂量时,核药可以更直接的针对需要治疗的部位,例如癌症治疗中,肿瘤组织可以相较于健康组织获得更高的辐射剂量[1]。根据核药的用途不同又可将核药分为放射性诊断药物和放射性治疗药物。
放射性药物与放疗的区别

资料来源:Nature Revlews、招商证券
放射性治疗药物则可以分为:
1)
利用特定核素在特定组织器官中选择性聚集实现治疗目的的核药,例如:I-131;
2)
内介入法放疗药物,例如:Y-90 微球、P-32 微球等。利用穿刺、插管、植入或局部注射到肿瘤组织等手段将核药聚集到病变部位进行治疗;
3)
靶向治疗核药,通过将放射性同位素与具备靶向功能的结构偶联,实现核药的体内治疗部位聚集,最终实现治疗。靶向治疗核药通常指放射性核素偶联药物(Radionuclide Drug Conjugates, RDC),往往由四部分组成,放射性同位素、螯合剂、连接子、生物靶向部分[1]。生物靶向部分又可分为小分子、多肽与抗体。RDC 相较于前两类具有潜在适应症更加广泛的优势。
RDC 结构示意图

资料来源:Chem.Rev、招商证券
RDC 的药物结构与抗体偶联药物(ADC)类似。ADC 分为抗体、连接子(Linker)和小分子毒素(Payload)三个构成要素;RDC 则由四个部分构成,包括由介导靶向定位作用的抗体或小分子(Ligand)、连接臂(Linker)、螯合物(Chelator)和放射/成像因子(放射性同位素, Radioisotope)。两者的药物结构虽类似,但要素的选择和发挥的药物作用却大相径庭。对比来看,ADC 的载荷是小分子化疗药物,需要进入肿瘤细胞内部才能起到杀伤作用,而且只能使用大分子单抗作为“导航”,很难进入细胞内释放载荷杀伤肿瘤细胞,通常需要设计微管毒素(MMAE、DM1 等)通过抑制细胞分裂抗肿瘤,药物结构设计难度较大。相较之下,RDC 的载荷为放射性核素,只需依靠射线杀伤肿瘤细胞,不需要进入肿瘤细胞内。而且,RDC 的靶向配体(起到精准定位的作用,引导放射性核素到达靶标)除了大分子的单抗以外,还可以是体积更小的小分子或多肽等,更容易让 RDC 通过渗透作用深入肿瘤内部发挥杀伤作用,并且相较 ADC 更不容易产生耐药。更关键的是,使用不同的放射性核素,可以实现诊断或治疗的功能,甚至两者兼备实现 ADC 药物无法做到的诊疗一体化。
螯合物类型
RDC 中的放射性同位素都为金属原子,需要通过双功能螯合剂(Bifunctional Chelator, BFC)来连接。BFC的选择取决于放射金属的物理化学性质,如氧化态、放射性金属配位数等。理想情况下,选定的 BFC 需要与放射金属高效形成具有高热力学稳定性的络合物,低稳定性会导致交叉络合和转金属现象引起的放射毒性。目前RDC中常用的BFC包括DOTA、DPTA、NOTA、DFO 等[2],并在这些结构基础上进行改进和优化。
常见的BFC种类

资料来源:Chem.Sci.,兴业证券经济与金融研究院整理
放射性同位素
放射性同位素是指能通过自发衰变并发出各种射线的物质,射线是指由某些放射性物质放出的高能粒子或电磁波,在放射性衰变中,常见的射线有α 射线、β 射线和γ射线[2]:
α 射线由α 衰变产生,其穿透能力最差,可以被一张纸、人体皮肤或几厘米的空气层阻挡住,因此容易防护。但 α 射线的电离能力最强,可以使肿瘤细胞 DNA 双链发生不可修复的断裂,因此极少量的 α 射线能够在有限区域内表现出显著的细胞毒性,并有望减少不良反应。靶向 α 核素治疗在临床癌症治疗中蕴含巨大潜力,正在引领核药创新的下一波浪潮,主要核素包括镭 - 233(233Ra)、锕 - 225(225Ac)、砹 - 211(211At)、钍 - 227(227Th)等。
β 射线由 β 衰变产生,包括 β+ 射线和 β- 射线,其电离能力比 α 射线弱,但是穿透能力比 α 射线强,一般的金属板或有一定厚度的有机玻璃板才能阻挡 β 射线。发射 β 射线的核素既可以用于诊断也可以用于治疗,目前以 177Lu(镥)为代表的 β 核素在核药研发中布局最多,其他还包括铼 - 188(188Re)、锶 - 89(89Sr)、钇 - 90(90Y)、碘 - 131(131I)等。
γ 射线由 γ 衰变产生,其能量非常微弱,但穿透能力极强,可穿过人体和铝板,因此发射 γ 射线的核素适合用于开发核药诊断试剂,主要核素包括锝 - 99m(99mTc)、氙- 133(133Xe)、铊- 201(201Tl)、铬 - 51(51Cr)等。
α 射线、β 射线和γ 射线穿透能力

资料来源:Radioactivity,兴业证券经济与金融研究院整理
上市药物
目前已上市的放射性治疗药物的适应症相对主要集中在神经内分泌瘤与前列腺癌上,这与生物靶向结构直接相关。考虑到治疗窗口,核药对体内循环过程的速度要求要尽可能快速,对靶点结合要尽可能紧密。因此特异性强的生物靶向成为最终能否成药的关键。
奥曲肽是结合生长抑素受体(SSTR)的理想结构,利用奥曲肽进行生长抑素受体结合的核药用于治疗神经内分泌瘤。结合前列腺特异性膜抗原(PSMA)的小分子结构的应用是对前列腺癌适应症有效的保障。生物靶向是核药成药的基础。在生物靶向问题解决后,可以拓展放射性核素种类优化有效性与安全性(奥曲肽偶联不同放射性核素的实例)。
Lutathera 是 FDA 批准的第一个治疗胃肠胰神经内分泌肿瘤的放射性药物。2018 年获批至今,其累积销售额已超过 20 亿美元,前两年全球销售额分别在 4.75 亿美元、4.71 亿美元。而另一款明星药物 Pluvicto,用于治疗市场潜力更高的去势抵抗性前列腺癌,2022 年上市首年销售额即达到 2.71 亿美元,即使在产能暂不能满足市场需求、出现供应短缺的情况下,2023 年上半年仍实现 4.5 亿美元收入,诺华预计其峰值年销售额可达 20 亿美元。
前列腺特异性膜抗原(PSMA)是一种非分泌性膜酶,在前列腺癌上高度表达。前列腺特异性膜抗原( PSMA, Prostatespecificmembrane antigen) 是一种表达在细胞膜上的跨膜糖蛋白。相比于正常前列腺组织和身体的其他部位,PSMA 在前列腺癌 (PCa) 中呈现出特异性高表达模式,并且其表达水平与 PCa 的侵袭性高度相关。
Pluvicto 为靶向 PSMA 的 RDC 药物,可有效治疗前列腺癌患者。Pluvicto 的设计与 ADC 类药物类似,将配体与放射性元素镥177结合,在体内注射后,配体会和 PSMA 蛋白定向结合,之后药物会被细胞吸收进内部,并且放射性元素会产生 β 射线来杀伤癌细胞[3]。
Pluvicto 作用原理

根据医药魔方统计数据,截至 2024 年 2 月,全球共有 639 条核药新药管线处于临床阶段,其中 1 期临床项目占比 62%、1/2 期临床项目占比 12%、2 期临床项目占比 16%、2/3 期临床项目占比 3%、3 期临床项目占比 7%。全球核药中靶向 PSMA 的产品研发热情最高,有 76 项处于临床阶段,数量远超其他靶点,其他热门靶点还包括 FAP(成纤维细胞激活蛋白)、SSTR、整合素αvβ3、PDL1、GRPR(胃泌素释放肽受体)、Aβ 蛋白、Tau 蛋白等[2]。
全球开发中核药新药热门靶点[2]
资料来源:医药魔方,兴业证券经济与金融研究院整理
注:截至 2024 年2 月
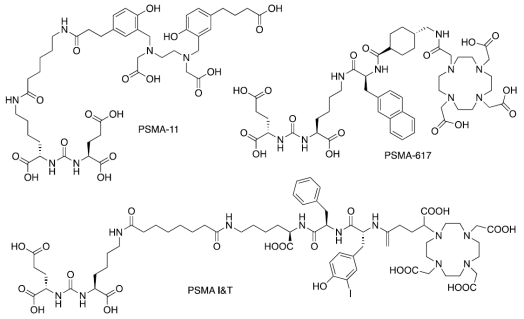
目前,许多靶向 PSMA 的核药都具有一个共同特征,即 Glu‑urea‑Lys 结构,一种适用于涉及强效 PSMA 抑制剂的切块化合物。谷氨酸尿素小分子及其衍生物(Glu-urea-R)是 PMSA 的叶酸水解酶I酶活性抑制剂,它能够特异地与 PSMA 结合,并且可以内化到 PSMA 阳性细胞内。在 Glu-urea-R 的结构设计中,Glu-urea 为 PSMA 结合基团,R 基团为偶联端。这种设计使得此类放射性药物活性稳定,体内循环半衰期短,对于肿瘤渗透性好,体内应用副作用低。谷氨酸尿素结构单元中,R 基团的不断优化,是 PSMA 药物发展的主旋律。其中基于赖氨酸-脲基-谷氨酸(Lys-urea-Glu)骨架的高度特异性的 PSMA 小分子抑制剂在临床实践中占据主导位置,相关药物如:68Ga-PSMA-11、177Lu-PSMA-617、18F-DCFPyL 和 177Lu-PSMA-I&T 等。其中,68Ga-PSMA-11 和 18F-DCFPyL 分别于 2020 年和 2021 年被美国 FDA 批准为靶向 PSMA 的前列腺癌诊断显像剂。177Lu-PSMA-617 和 177Lu-PSMA-I&T 是目前研究最多的靶向 PSMA 的放射治疗配体,177Lu -PSMA-617 于 2022 年被美国 FDA 批准为靶向 PSMA 的放射配体治疗药物。
临床用基于脲基的PSMA抑制剂PSMA-11, PSMA-617, PSMA I&T[4]
同时,有研究报道[4],基于 Glu‑urea‑Lys 结构的靶向 PSMA 药物会存在自发脱水缩合,形成五元环杂质的现象,而该环化反应依赖于环境 pH 和温度,若在放射性核素标记过程中不加以控制,则会导致[177Lu]Lu-PSMA-617 临床批产品生产过程中产生大量放射性杂质([177Lu]Lu-SP1*, [177Lu]Lu-SP2*, and [177Lu]Lu-SP3*)而无法放行使用。该研究考察优化了标记过程中的反应条件,从而将最终产品放射化学纯度(RCP, Radiochemical Purity)控制在 ≥95%,满足纯度要求。
环化副产物 SP1, SP2 和 SP3 形成示意图
色谱柱:Jupiter Proteo (250×4.6mm, 4µm)
流速:1mL/min
进样体积:20µL
流动相A:0.1% TFA水
流动相B:0.1% TFA乙腈
t/min
A/0.1% TFA 水
B/0.1% TFA 乙腈
0.00
955
1.00
955
25.00
5050
27.00
595
29.00
595
32.00
955
PSMA-617 及相关环化杂质液相分析色谱图(检测波长 220nm, PSMA-617 (17.09min ); SP1* (17.34min ); SP2*(17.34min ); SP3* (17.49min )
经[177Lu]Lu-PSMA-617治疗的病人尿样Radio-HPLC色谱图
( Reg#1 = [177]Lu-PSMA-617, Reg#2 - Reg#3 =[177]Lu-SP1* - [177]Lu-SP3* )
用于蛋白质/多肽分析和纯化的 RP-HPLC
Jupiter HPLC 色谱柱系列包括 Jupiter 300 和 Jupiter Proteo,为蛋白质和多肽表征和纯化提供优化的反相解决方案。采用这些色谱柱,我们几乎可以识别、纯化和分析所有的蛋白。
Jupiter 300 – 300 Å 色谱柱设计用于分析和纯化完整蛋白
用于分离分子量大于 10,000 的完整蛋白
拥有 C18、C5 和 C4 键合相
pH 稳定范围为 1.5-10,可以获得方法稳健性及轻松地去除蛋白
直接扩展至制备和散装填料
Jupiter Proteo – 90 Å 色谱柱可以为肽谱分析和多肽分离提供更高的峰容量和分离度
用于分离分子量小于 10,000 的完整蛋白质和多肽
可配用新颖的 C12 键合相以获得优异的选择性
识别翻译后修饰
毛细管柱可以提高灵敏度
填料特性
如需产品订购,可拨打全国免费技术支持热线 400-606-8099
官方Email:cninfo@phenomenex.com
推荐阅读

一种靶向整合素αvβ6兼具成像诊断与治疗作用的多肽偶联药物研究
参考文献:
1. 生物医药行业创新药系列报告:核药行业深度,创新驱动的高壁垒领域,看好RDC未来发展
2. 医药行业核药深度报告:诊疗一体化优势显著,海内外加快产业布局
3. 医药行业研究·创新药系列:核药深度报告,现代医学重要组成部分,RLT疗法开启新篇章
4. Identification, Characterization, and Suppression of Side Products Formed during the Synthesis of [177Lu]Lu-PSMA-617. J. Med. Chem. 2021, 64, 4960−4971.

07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
精准测量, 安杰智造:气相分子吸收光谱仪校准规范发布06-27
精准科仪 高效分析 | 福立2024气相色谱技能培训会·第一期成功举行!06-27 福立仪器
ICP-OES直接分析95%乙醇样品中的As、Cd、Pb、Sb迁移量06-27 德国耶拿
好礼来袭 | 分享您身边的特洁安身影06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
"全民禁毒宣传月,普立泰科亮神器!"06-26 普立泰科
高分离 高灵敏 高通量——福立液相LC5190重新定义分离需求06-26 福立仪器