项目文章 | 浙江大学医学院团队发现促进卵巢癌转移和化疗耐药性的治疗新靶点
2024-01-08 11:06:44, 莲莲看 北京青莲百奥生物科技有限公司

研究思路
ATdb数据库和“CuratedOvarianData”用于评估激酶对卵巢癌生存率的影响。
Western blot和实时荧光定量PCR检测卵巢癌细胞中的基因表达。
采用创面愈合实验、细胞侵袭实验、免疫荧光染色、免疫组化、流式细胞术等方法评估基因敲低或过表达的体外效果。
采用质谱分析、蛋白质结构分析、免疫共沉淀分析、核质分离和体外激酶分析等手段,验证了PINK1-PTEN相互作用及其作用。
在雌性BALB/c裸鼠中进行卵巢癌异种移植物转移实验。
研究结果
一、PINK1高表达与卵巢预后不良有关
为了研究自噬与肿瘤之间的密切相关性,通过ATdb数据库与R包“CuratedOvarianData”筛选与卵巢患者预后相关的自噬相关激酶。结果显示,PINK1高表达与卵巢癌患者较差的预后显著相关(图1A, 1B)。Kaplan-Meier Plotter网站获得了多个数据集进行Meta分析,以描述PINK1表达与卵巢癌预后之间的相对性结果。森林图表明,PINK1高表达与预后不良密切相关(图1C),且与本地队列数据一致(图1D)。还发现PINK1的表达可能与FIGO分期和网膜侵袭有关(图1G)。总体而言,PINK1与卵巢癌的不良预后密切相关。
鉴于卵巢癌预后不良通常与转移有关,且发现PINK1高表达与网膜侵袭相关,评估了原发性和转移性卵巢癌组织中的PINK1蛋白水平。免疫印迹分析和IHC分析显示,转移性组织中PINK1蛋白水平显著升高(图1H-J)。研究结果表明,PINK1在卵巢癌的转移和不良预后中起着重要作用。
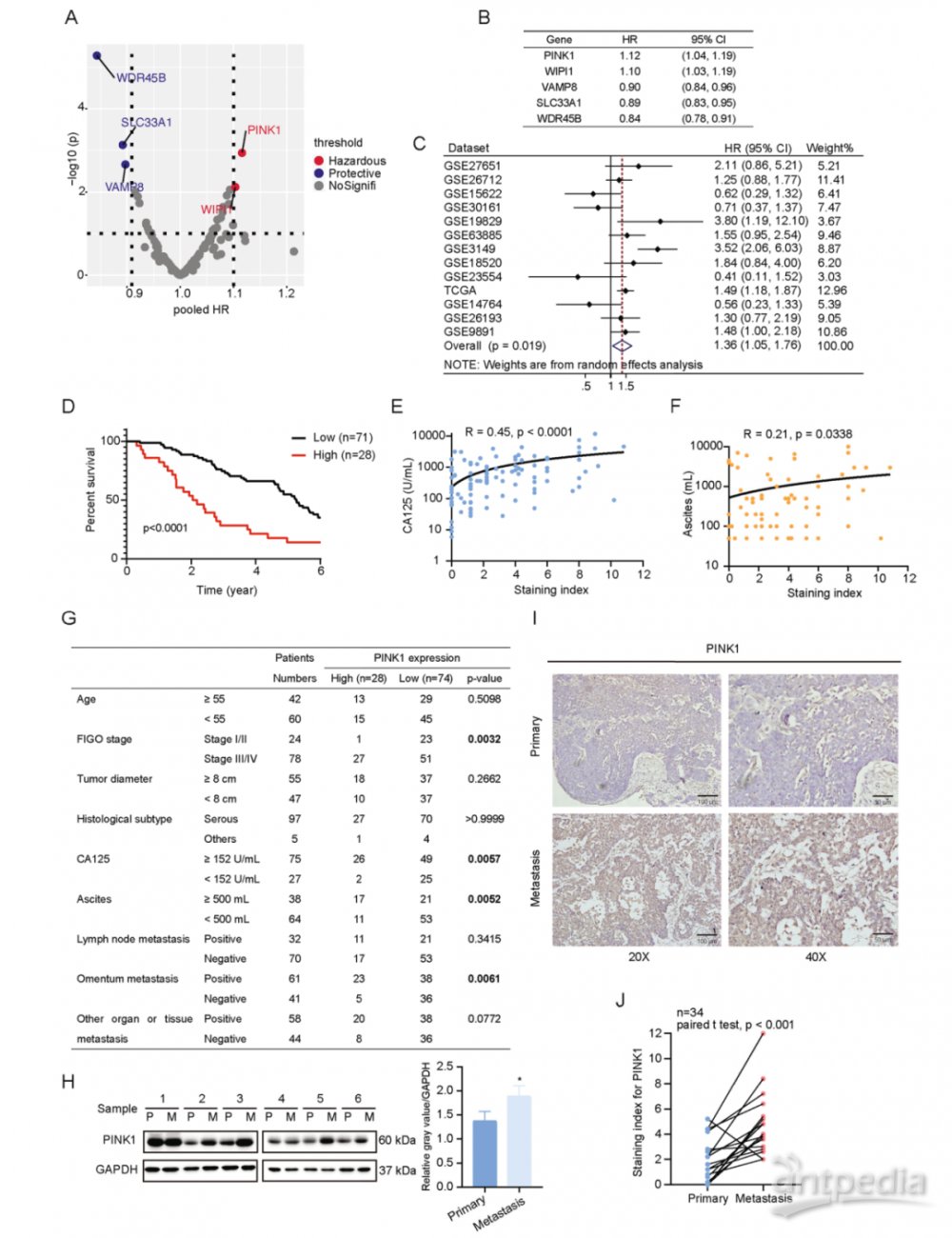
图1 PINK1与卵巢预后不良有关
二、PINK1在体外促进卵巢癌细胞转移
为了探索PINK1在卵巢肿瘤发展中的作用,选择细胞系A2780(PINK1蛋白表达水平在A2780细胞中最低)和SKOV3(PINK1蛋白表达水平在SKOV3细胞中最高),分别用带Flag标记的PINK1过表达质粒和靶向PINK1的siRNA进行转染,以确定PINK1对卵巢癌的影响。
为了评估PINK1对卵巢癌细胞体外迁移和侵袭能力的影响,进行了划痕实验和基质凝胶侵袭实验。结果表明,PINK1的过表达显著增强了A2780细胞的迁移和侵袭能力(图2A, 2B),PINK1的敲低降低了SKOV3细胞的迁移和侵袭能力。使用 EdU和 CCK-8 测定评估PINK1对卵巢癌细胞增殖能力的影响(图2C)。结果表明,PINK1对卵巢癌细胞增殖没有显著影响。
上皮-间充质转化(EMT)在肿瘤转移中具有重要作用,研究了PINK1是否可以促进卵巢癌细胞中的EMT。分析显示,PINK1过表达显著下调了上皮标志物,如E-钙粘蛋白。相反,包括N-钙粘蛋白在内的间充质生物标志物以及关键的EMT转录因子slug 和 snail下调(图2D)。
通过在A2780细胞中过表达PINK1激酶失活突变质粒来评估PINK1的激酶活性对于其对卵巢癌症转移的作用的必要性。激酶失活突变体未能增强细胞迁移和侵袭能力(图2A,B),且过表达未导致EMT促进(图2D)。结果表明,PINK1的促转移能力主要取决于其激酶活性。总体而言,PINK1通过其激酶活性促进卵巢癌转移。
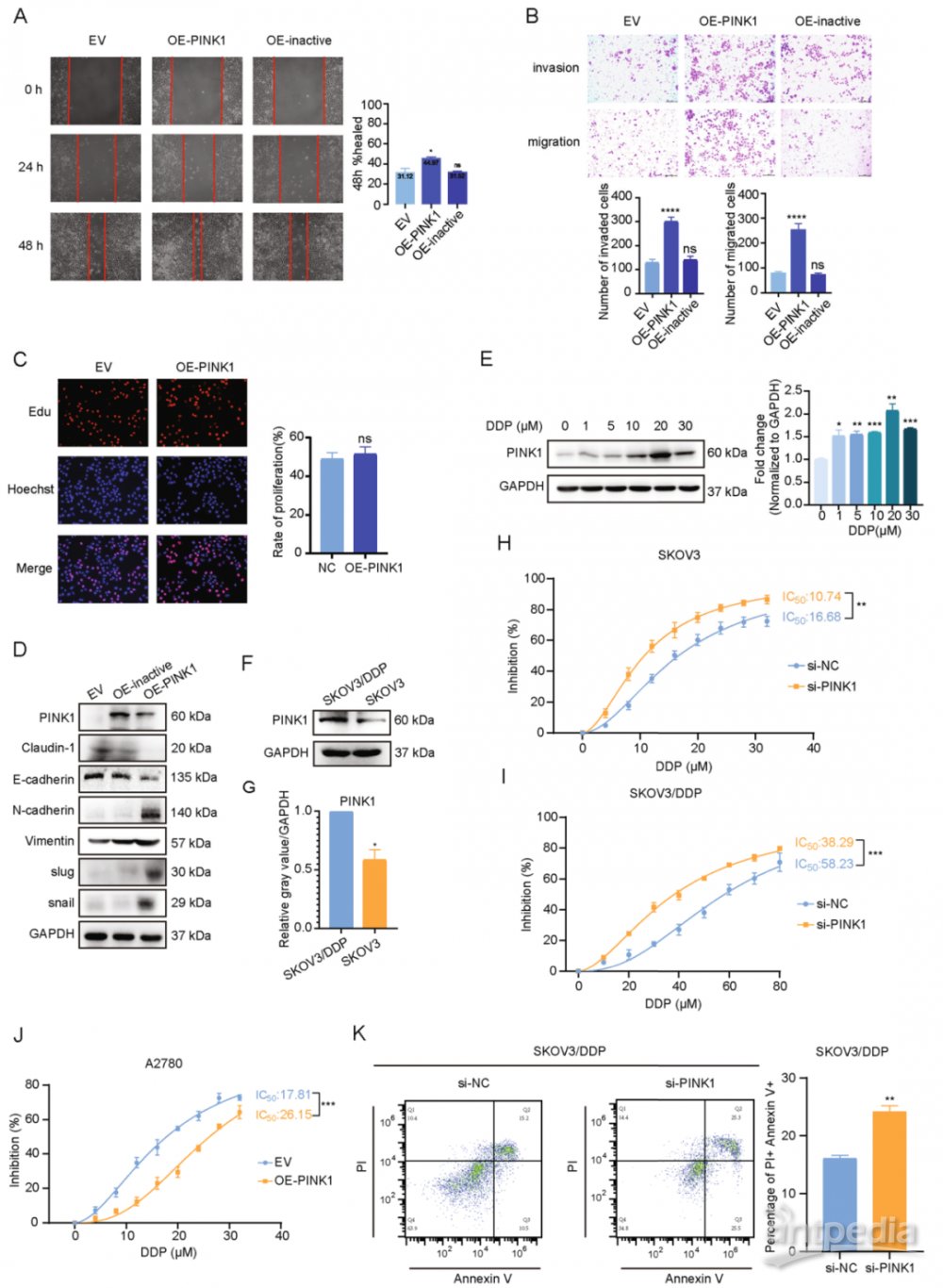
图2 PINK1 在体外促进卵巢癌的转移和化疗耐药
三、PINK1敲低可提高顺铂敏感性
耐药性通常是乳腺癌晚期患者最终复发和预后不良的主要原因,顺铂是治疗乳腺癌最有效的化疗药物之一,选择顺铂进行进一步实验,以确定PINK1是否与化疗耐药性有关。结果显示,PINK1的mRNA和蛋白水平在顺铂暴露后以浓度依赖性方式上调(图2E)。引入顺铂耐药的癌症细胞(SKOV3/DDP),以进一步研究PINK1在顺铂耐药性中的作用。Western blot分析表明,SKOV3/DDP细胞中PINK1蛋白表达显著增加(图2F,G),这表明PINK1与卵巢癌症中的顺铂耐药性有关。进行CCK-8测定以评估顺铂在PINK1敲低或过表达的细胞中的抑制作用。在SKOV3和SKOV3/DDP细胞中,PINK1敲低后顺铂的IC50显著降低(图2H,I),在A2780细胞中结果类似,其中PINK1的过表达显著增加了IC50(图2J)。此外,流式细胞仪分析显示,PINK1敲低后顺铂处理后细胞凋亡水平增加(图2K)。这些结果共同表明,PINK1参与卵巢癌对顺铂的耐药性。
四、PINK1与PTEN相互作用
由于Parkin在卵巢癌中的表达极低,本研究专注于探索PINK1在没有Parkin的情况下的功能。PINK1被确定为癌症细胞中PTEN的上调靶点,因此假设PINK1可以与PTEN相互作用并调节PTEN。通过co-IP和免疫荧光(IF)实验分别分析了在HEK293T细胞中过表达Flag-PINK1和HA-PTEN(图3D),以及A2780 和 SKOV3 细胞系中的抗PINK1或抗PTEN抗体,验证了PINK1和PTEN之间以及卵巢癌细胞中这两种内源性蛋白质之间存在相互作用(图3E-H)。
为了确定PTEN中与PINK1相互作用的特定区域,构建了四个删除不同结构域的PTEN突变体(图3I)。用Flag-PINK1和全长HA-PTEN或PTEN截短突变体转染HEK293T细胞。观察到缺乏PBD结构域的PTEN突变体不能与PINK1相互作用,突出了PBD结构域在PINK1-PTEN相互作用中的关键作用。此外,分子模拟为PINK1和PTEN之间的相互作用提供了额外的支持(图3K, L)。
研究结果表明,PTEN是PINK1的相互作用伙伴,PTEN的PBD结构域在相互作用中起着重要作用。
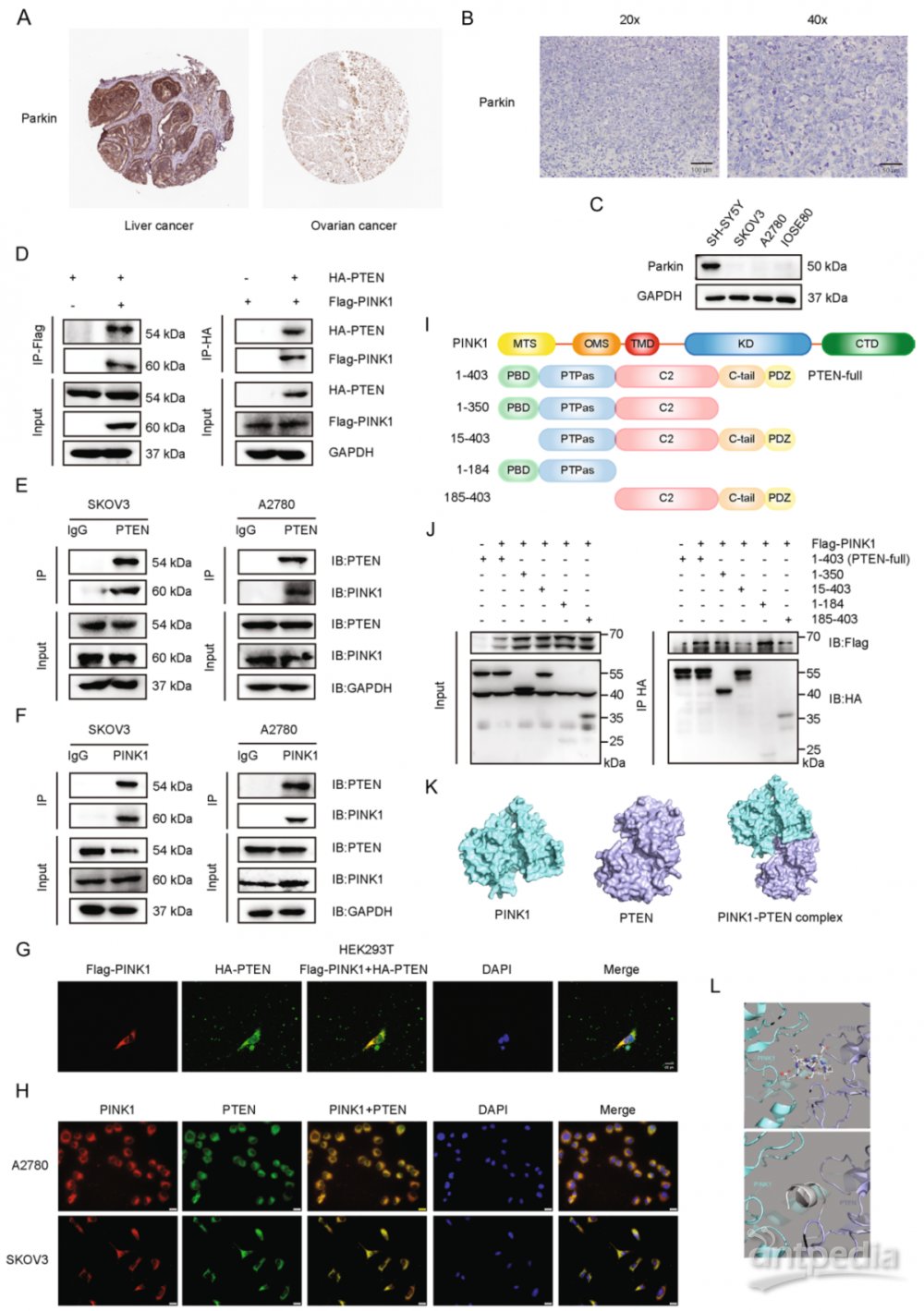
图3 PINK1与PTEN相互作用
五、PINK1在残基Ser179处磷酸化PTEN
PINK1是一种丝氨酸/苏氨酸蛋白激酶,研究了PTEN是否是PINK1介导的磷酸化的底物。用si-PINK1转染SKOV3细胞48 h后,使用磷酸标签凝胶分离磷酸化的PTEN蛋白。当PINK1下调时,磷酸化PTEN迁移减少(图4A)。此外,在HEK293T细胞中过表达HA-PTEN或与Flag-PINK1一起过表达时,显示与PINK1过表达相比,PTEN磷酸化增加(图4B)。为了确认PTEN在丝氨酸/苏氨酸残基上被磷酸化,使用抗PTEN抗体进行了免疫沉淀测定,并检测到内源性PTEN的丝氨酸/苏氨酸磷酸化,当PINK1被敲低时,其磷酸化降低(图4C)。相反,在HEK293T细胞中过表达外源性的PINK1导致HA-PTEN的丝氨酸/苏氨酸磷酸化水平增加(图4D)。为了探索激活的PINK1对PTEN的影响,在A2780和SKOV3细胞上施用CCCP(一种已知可激活PINK1的线粒体自噬诱导剂)后,丝氨酸/苏氨酸磷酸化的PTEN增加(图4E,F)。体外激酶实验表明,在ATP存在下,PINK1可以磷酸化PTEN(图4G)。
为了通过PINK1鉴定PTEN的磷酸化位点,我们进行了质谱(MS)分析。结果表明,Thr321和Ser179可能是PINK1磷酸化PTEN的残基 (图4H)。构建了相应的PTEN突变体,并检测了丝氨酸/苏氨酸磷酸化水平,发现Ser179的突变显著消除了磷酸化信号(图4I),表明Ser179是PINK1磷酸化PTEN的主要位点,该结果与我们的MS数据一致。此外,还使用GPS 6.0预测 PINK1的PTEN磷酸化位点(图4J)。 与MS结果一致,Ser179被预测为高分。Ser179在来自大多数不同物种的PTEN蛋白中高度保守(图4K)。
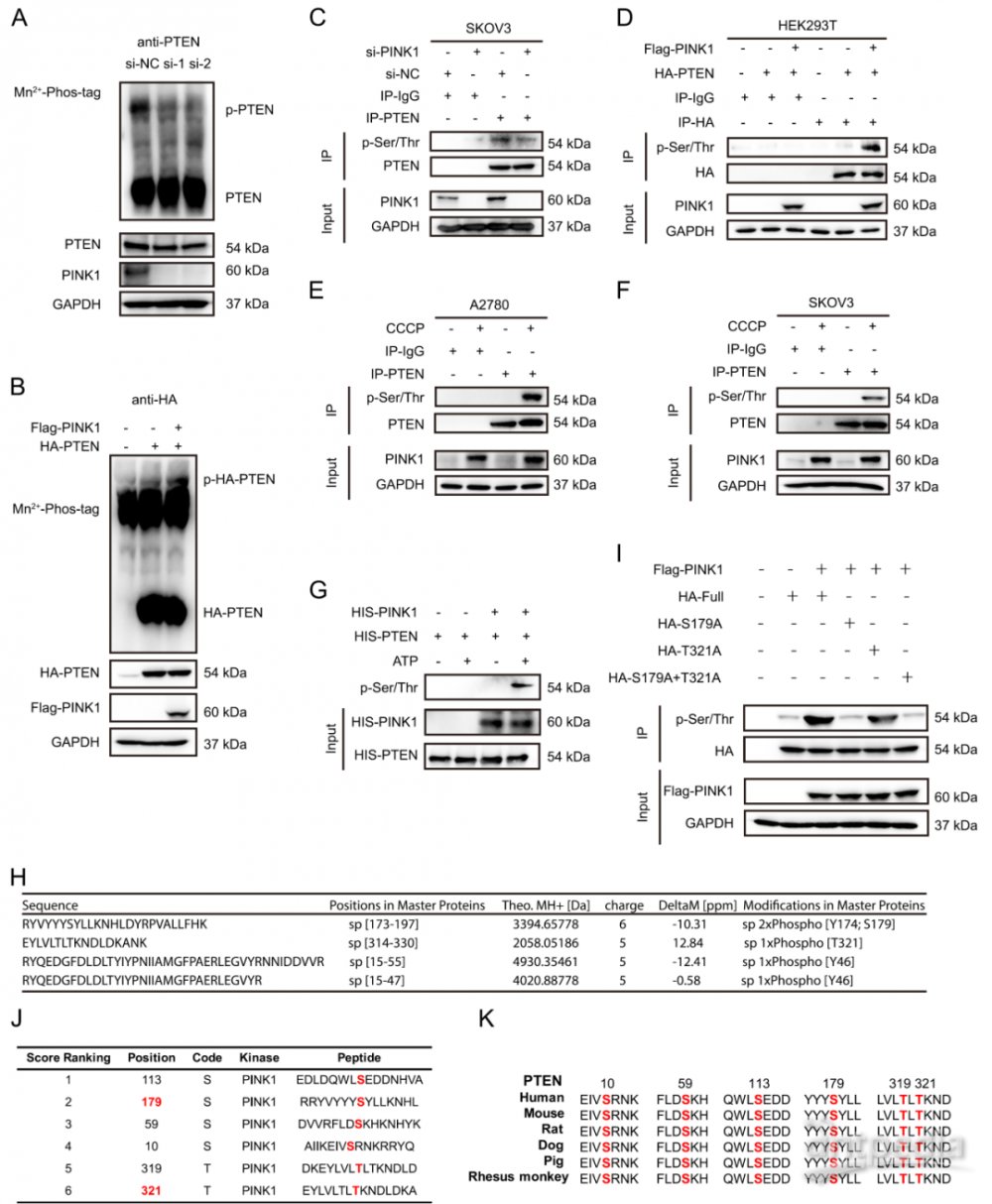
图4 PINK1在Ser179残基磷酸化PTEN
六、PINK1通过调节PTEN增强AKT的活性
为了研究PINK1在调节PTEN中的潜在作用,在A2780细胞中过表达PINK1,并在SKOV3细胞中敲低 PINK1。然而,PTEN mRNA和蛋白质的表达以及时程实验证实,PTEN的蛋白质稳定性不受PINK1表达变化的影响(图5A-D)。PTEN的肿瘤抑制作用主要是通过抑制PI3K/AKT信号传导,PTEN的功能失活可能与其磷酸化有关。敲低PINK1导致p-AKT(Thr308, Ser473)的表达降低,表明PINK1与PTEN相互作用以激活AKT(图 5A),用线粒体自噬诱导剂治疗以时间依赖的方式导致p-AKT水平升高(图5E)。此外,与原发肿瘤相比,人卵巢癌转移组织中p-AKT的蛋白水平更高(图5F),与PINK1的表达水平一致(图5H)。
为了确定PINK1介导的PTEN磷酸化是否影响AKT的磷酸化水平,过表达了一个在Ser179位点发生突变的PTEN突变体。与野生型组相比,PTEN突变体与PINK1的过表达未能提高p-AKT的水平(图5G)。
总体来说,PINK1在Ser179位点磷酸化PTEN,导致AKT的激活并促进肿瘤转移和细胞存活。
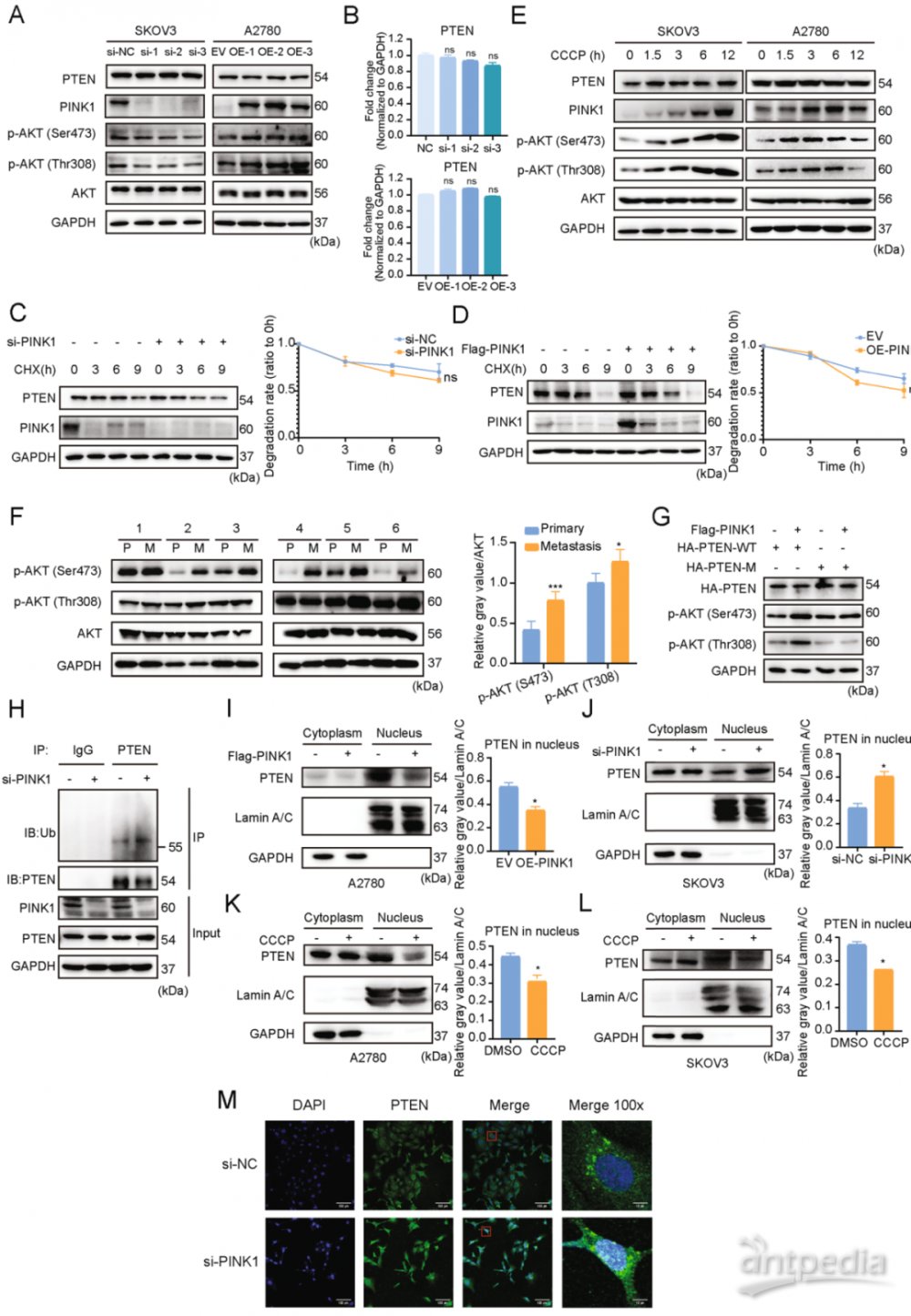
图5 PINK1通过磷酸化PTEN抑制PTEN核导入并激活AKT
七、PINK1抑制PTEN核易位
磷酸化PTEN可能导致泛素化,从而影响其功能和命运。因此,在SKOV3细胞中沉默PINK1,以探索PTEN的泛素化水平。PINK1敲低,PTEN的单泛素化水平增加(图5H)。PTEN的单泛素化水平有可能通过调节其核易位来暗示其抑癌功能。因此,研究了PINK1的磷酸化是否会影响PTEN的核易位,从而潜在地促进癌症转移和化疗耐药性。在PINK1过表达或敲低后,对卵巢癌细胞进行了核质分离。观察到细胞核中的PTEN水平发生显著变化,细胞质中的PTEN水平没有显著改变。用CCCP处理细胞,研究诱导线粒体自噬激活PINK1的效果,观察到PINK1激活后进入细胞核的PTEN水平显着降低(图5K, L)。免疫荧光实验,观察到在PINK1敲低后,PTEN在PINK1磷酸化反应中核内的PTEN明显增加(图5M)。
结果表明,PINK1通过在Ser179位点磷酸化PTEN来减少PTEN的单泛素化,从而抑制PTEN的核易位。这种作用反过来激活AKT,促进癌症的转移和化疗耐药性。
八、PINK1在体内促进卵巢癌的转移和顺铂耐药
通过在体内建立异种移植模型,研究了PINK1对癌症转移和药物抗性的影响。在BALB/c裸鼠中进行SKOV3细胞的腹膜内注射,这些细胞表达PINK1靶向shRNA(shPINK1)或阴性对照shRNA(shNC)。8周后,shPINK1转染的癌细胞形成的结节更少(图6C-E)。与DDP一起接受shPINK1转染的肿瘤细胞注射组具有最小的转移肿瘤质量和体积(图6C-F)。
此外,还评估了卵巢癌中的恶性肿瘤标志物,包括LDHA、CA125和Ki67。IHC图像显示shPINK1组的阳性指标较弱,显示出显著差异(图6G、H)。对EMT标志物(E-钙粘蛋白和波形蛋白)进行了IHC测定,以评估PINK1对卵巢癌EMT的直接影响。结果表明,在PINK1敲低时,波形蛋白水平降低,E-钙粘素水平升高(图6G,H)。结果表明敲除PINK1可以提高顺铂治疗的有效性,并降低肿瘤的转移潜力。
综上所述,PINK1通过其磷酸化调节PTEN的抑癌功能,从而促进肿瘤转移和化疗耐药性。

图6 PINK1通过调节PTEN促进卵巢癌症转移和顺铂耐药性
研究结论
研究发现PINK1-PTEN轴通过独立于Parkin的非典型途径促进卵巢癌。PINK1通过磷酸化Ser179位点的PTEN,上调AKT活性,抑制PTEN核易位,最终促进卵巢癌的转移和化疗耐药。因此,PINK1可能是卵巢癌治疗的新型治疗靶点。
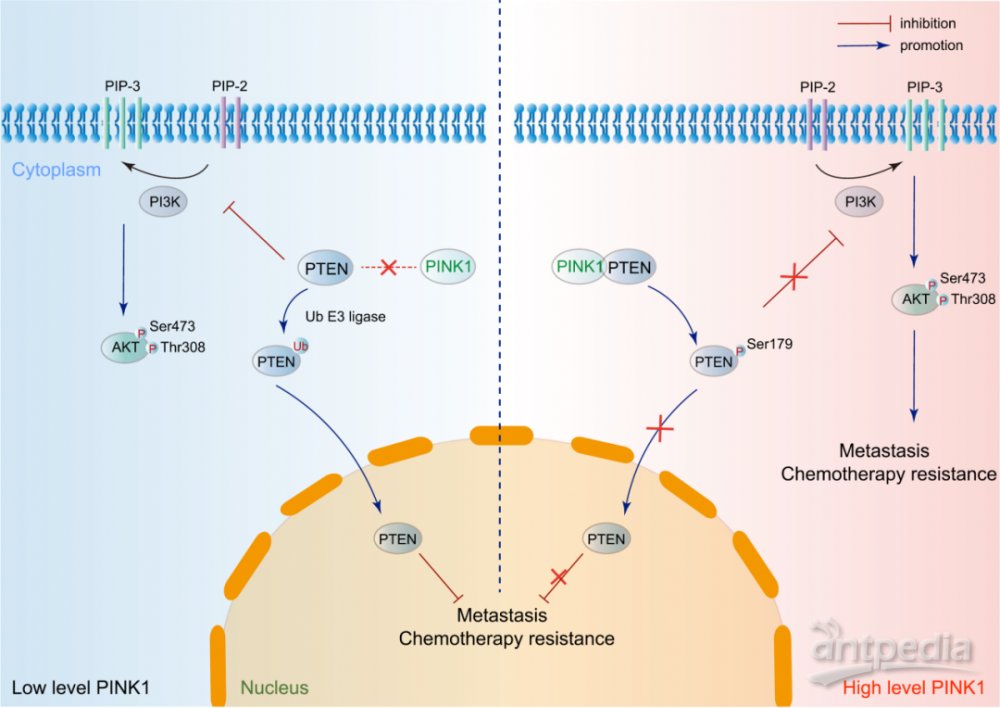
图7 PINK1-PTEN轴促进卵巢癌症转移和不依赖于Parkin的化疗耐药性
青莲百奥合作文章
青莲百奥深度参与众多前沿研究,与中国医学科学院、中国科学院、军事医学研究院、国家蛋白质科学中心、四川大学华西医院等单位通力合作,累计发表SCI论文100余篇,累计影响因子(IF)800+,多项重磅文章问鼎Nature、Science Translational Medicine、Nature Communications等顶级期刊。

关于青莲百奥







01-10 迈越生物
盘点 | 2023年68篇CNS大小刊关于RTCA都发了点啥?01-09 安捷伦细胞分析
在线讲座 | 线粒体功能研究思路与案例分享01-09 安捷伦细胞分析
酶标仪高端玩家指南:搭载合成生物学传感器的可穿戴设备研发01-09 安捷伦细胞分析
细胞说 | 免疫细胞代谢01-09 安捷伦细胞分析
喜报!鉴知技术获评北京市“专精特新”中小企业!01-08 鉴知技术
因美纳扩大与杨森的合作,推进肿瘤分子残留病灶检测开发01-08
卓立·大事记 | 盘点2023客户案例,利用光谱成像技术助力科研创新高!01-08 光电行业都会关注
Quantum Design中国正式成为Lake Shore Cryotronics, Inc. 公司中国区独家经销商01-08
乐研年初大放价,福利大放送01-08 乐研
应用案例|大容量9系三元锂离子电池热失控测试01-08 浙仪应用研究院
【不忘初心·共期致远】欧美克2023年度大事记01-08 欧美克仪器
NS-90Z Plus丨纳米粒度及电位分析仪01-08 欧美克仪器
中共中央政治局常委丁薛祥到兰友科技调研01-06
小寒 | 无畏九寒天 跨越征途待春归01-06 SHINE
时令新知丨小寒——穿越严寒,便是春意盎然01-05
恭喜天津大学纳米中心2024首篇 Nature: 半导体石墨烯新突破01-05 Park原子力显微镜
业务喜报丨易文赛干细胞新药IND获批!01-05 生物医药市场部
《第一财经》专题报道 | 微谱科技集团为化妆品企业提供高质量一站式技术服务01-05
技术分享丨微谱油田助剂结构解析,助力企业提升核心竞争力!01-05 先进制造事业群
