技术共探 | 生物制品微生物解决方案
2023-12-11 14:58:30, 生物医药市场部 上海微谱检测科技集团股份有限公司


前言
药品从研发到临床,从申报上市到商业投产,都绕不开微生物这一影响因素。如今,随着法规体系的不断完善,如何做好生物制品的微生物检查,从而满足各国监管机构控制药品质量的要求?本期#微谱药研院 · 技术共探,通过对比中国申报和美国申报的异同点,为您厘清细胞库、原液、收获液的微生物检查重点与难点,与您共同探讨生物制品的微生物解决方案。

细胞库的微生物检查
随着各方监管机构法规、指南的颁布,监管体系逐步完善,对于细胞库检测的法规要求愈加明晰。
在微生物检查的项目上,中国申报主要依据《中国药典》2020版三部中的相关要求开展检测,其中,无菌检查和支原体检查二者为必检项,分枝杆菌检查为可选检项,企业可以根据产品性质及工艺特点等选择是否开展分枝杆菌检查。在美国申报时,一般参照《美国药典》(USP)、ICH Q5D 、PCT 1997 等法规要求开展检测,其中,无菌检查和支原体检查二者为必检项。

▲ 细胞库的微生物检查项目在中国申报和美国申报中的差异
对比微生物项目中的无菌检查(细菌、真菌检查),由于《中国药典》和《美国药典》中要求开展试验所用菌种种类和来源不完全一致,同时,对于生物制品的无菌检查,按中国药典要求,须额外增加一份硫乙醇酸盐流体培养基在低温下培养,因此仅按照一种药典要求进行检测,是无法满足中美双报的要求的。
相较于无菌检查,支原体检查在进行中美申报时的差异更大一些,无论是样品的接种量、接种方式,还是检测用培养基的灵敏度检查方式,都存在着不小的差异。因此,在进行中国申报和美国申报,支原体检查应分别按照《中国药典》和《美国药典》的方法进行检测。对于是否需要进行干扰性实验,《中国药典》没有明确的规定,企业可以根据实际情况,结合待检样品的类型来选择,如细胞库的样品,可以选择不做干扰实验;对于UPB等成分相对复杂的样品,建议至少开展一次干扰性试验。在美国申报时,则不论是什么类型的样品,首次检测前都需要进行干扰实验。

原液、收获液的微生物检查
《中国药典》中要求对原液进行无菌检测,并简述了取样方式、取样量的相关要求,无收获液相关要求。然而PCT 1997则有明确要求,对UPB 来说,无菌和支原体检测是必检项;同时,企业也可以用生物负载检测的方式替代无菌检测,前提是需要建立一个适宜的限度标准。与细胞库不一样的是,无论采取的是无菌检查还是生物负载检查,应优先采用薄膜过滤法进行检测。
结合在细胞库章节介绍的无菌检查、支原体检查在中美药典中的方法差异,梳理申报策略可知,中美申报需要分别按照对应的药典要求进行无菌或者生物负载的检查,并进行支原体检查。

制剂的微生物检查
相比于细胞库、原液及收获液,制剂的微生物检查更关注检验量。
常规的制剂如抗体、mRNA疫苗等在最终的产品放行时只需要进行无菌检查即可,在《中国药典》和《美国药典》的无菌检查法章节中,详细列举了不同批量、不同剂型的产品需要开展无菌检查所需的样品量。从下图可以看出,两国药典关于制剂的无菌检查的样品检验量以及检验数量的要求是一致的。
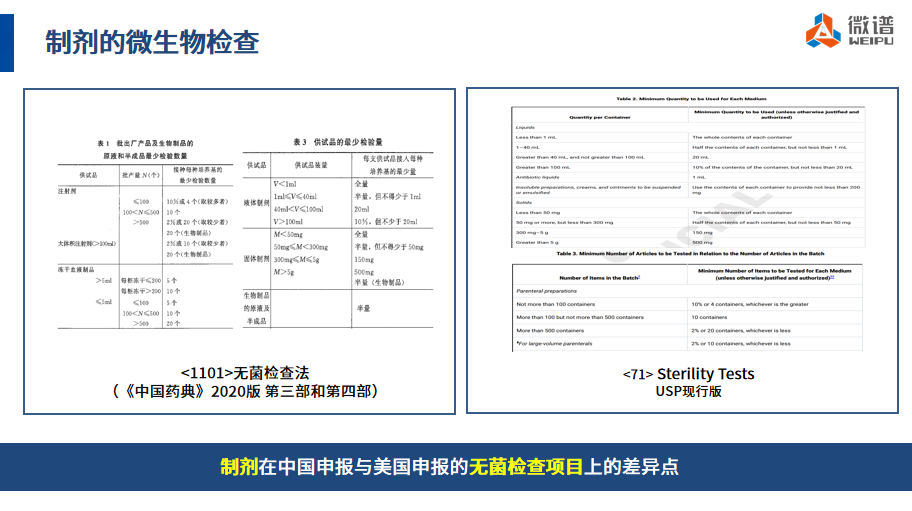
▲ 制剂的无菌检查项目在中国申报和美国申报中的差异
而CAR-T细胞类产品除了需要进行无菌检查之外,还需要进行支原体检查,以确保最终产品的安全。受制于此类产品的批产量一般较少的现实因素,依据《中国药典》或《美国药典》的无菌检查法项目下对于样品量的要求,在实际生产中显然是难以达到平衡的。因此,在实际研发中,该如何准备样品以满足法规及指南的要求?——减少产品在微生物项目上的检验量就显得尤为重要。
在无菌检查项目上,国家药典委员会于2022年发布《细胞类制品微生物检查指导原则》(征求意见稿),对CAR-T类产品的检验量提供了指导性的取样要求;《欧洲药典》、《美国药典》对此类产品的检验量要求与上述征求意见稿中的内容是相同的——企业需要根据产品的批体积来计算接种到每种培养基中的样本量进行无菌检查。
就无菌检查而言,在进行中美申报时,如果每份培养基中接种的样品量相同,依据《中国药典》的检测方法所开展的检测,可以覆盖《美国药典》检测要求,但须满足以下两个前提条件:
一是按照《中国药典》和《美国药典》分别开展方法适用性试验时,两者得出的结论一致,包括每份培养基里接种的样品数量也应是一致的;
二是使用的培养基是同一份,需要按照《中国药典》和《美国药典》分别开展对应的培养基的灵敏度检测,合格后才能用于检测。
而对于CAR-T类产品的支原体检查,在中国食品药品检定研究院发布的《CAR-T 细胞治疗产品质量控制检测研究及非临床研究考虑要点》中,明确规定:可以直接取收获前的细胞悬液用于支原体检查。
小结
本期文章围绕细胞库、中间产品以及制剂在中国申报和美国申报的异同,为您条分缕析了中美监管机构对于生物制品的微生物检查要求。接下来,我们还将对微生物快检进行详解,敬请期待!


END
关于我们
微谱于2014年正式涉足生物制品服务领域,2021年成立微谱生物科技有限公司,成为集团在生物药领域的重要战略布局。2022年公司荣获“江苏省民营科技企业”称号。
微谱生物科技立足于生物医药全产业链,依托创新型自主知识产权体系构建出成熟的生物制品质量研究平台、生物安全服务平台、GMP验证及法规咨询服务平台、药包材研究服务平台以及药械知识产权服务平台,致力于为国内外生物药企业提供合规、专业、一体化的生物制品质量与安全研究综合解决方案。

更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com




END

轻松一点,赞和在看都在这儿!

03-18
屹尧科技荣获中国检验检测学会技术发明一等奖03-18 屹尧科技
推动高质量发展,德国耶拿助力科研设备更新03-18 德国耶拿
莱伯泰科《裂解技术分析原理及在化工新材料检测中的应用》线上会议邀您报名啦!03-18
整体解决方案+全方位客户服务——莱伯泰科助力大规模仪器设备更新03-18
莱伯泰科《硅片表面金属离子国产检测仪器首创项目》获中国检验检测学会科学技术奖03-18
Empower控制质谱系列使用小贴士(一) | 沃特世质谱以旧换新现在进行时03-18 沃特世技术服务
尖端科学仪器,助力高质量发展:沃特世支持大规模设备更新03-18
【光博会直播预告】直播倒计时,快来码攻略!03-18 OceanOptics
特色方案|川贝枇杷糖浆中薄荷脑的测定03-18
讲座回放 | 洞见大气中微塑料污染,前沿研讨回顾与检测方案分享03-17 安捷伦科技
喜报 | 恭喜Agilent Cary60紫外分光光度计获得ACT可持续发展标签!03-17 安捷伦科技
连续流制药引领制药工艺新革命03-17 安捷伦科技
时间胶囊已开启,您有一则3年前的重要推送!03-17 安捷伦科技
您的仪器是否需要更新了?是时候感受来自更高性能仪器的力量了!03-17 安捷伦科技
网络研讨会 | 安捷伦 Bio Tek 微孔板检测仪相关法规认证服务03-17 安捷伦科技
积极响应国家设备更新政策丨布鲁克电子显微分析仪器更新和升级指南03-17
3·15 | 守护食品安全,槽头肉鉴别标准品现货供应!03-16 阿尔塔科技
东京理化提供一站式前处理设备更新和产品选型指南03-16
@科研人,仪器升级不用愁,一站式学科热点升级选型方案来了03-16 帮您升级仪器的