Cell Death Dis | 生物学一区,TMT标记定量蛋白组学探究PSMA1介导的胃癌发展潜在机制
2023-02-15 03:38:51, 多层组学定制服务 上海欧易生物医学科技有限公司

研究背景
胃癌是全球第五大最常见的恶性肿瘤,也是癌症相关死亡的第四大原因。尽管胃癌的发病率以每年约2%的速度下降,但由于人口老龄化的增加,预计未来几年的病例数和死亡人数将增加。由于胃癌进展的机制仍然难以理解,寻找新的有前景的分子标志物可以为改善胃癌患者的临床结果和预后提供新的治疗方法。
2022年11月,南昌大学第一附属医院消化科研究团队在Cell Death & Disease期刊(IF:9.685)发表了题为“PSMA1 mediates tumor progression and poor prognosis of gastric carcinoma by deubiquitinating and stabilizing TAZ”的研究成果,以人癌和癌旁组织+人胃黏膜上皮细胞+小鼠肿瘤组织为研究对象,通过TMT标记定量蛋白组学技术结合RT-qPCR、蛋白免疫印迹检测等多个技术,研究发现,PSMA1可通过消除转录辅激活因子(TAZ)来促进胃癌的进展和增殖,这与PSMA1介导的去泛素化酶活性有关,可用作提示胃癌的潜在治疗靶点。

研究思路
1.肿瘤中PSMA1表达上调

2.PSMA1通过介导TAZ蛋白的去泛素化促进胃癌的发展

研究结果
1. PSMA1的表达量高低与胃癌的进展相关
为了探索PSMA1在人类胃癌研究中的临床功能,研究人员使用来自癌症基因组图谱(TCGA)的RNA-seq来分析PSMA1在胃癌中的mRNA表达。结果显示,与邻近的正常组织相比,肿瘤组织中PSMA1的表达水平上调(图1A)。通过测量不同胃癌细胞系中的PSMA1表达水平,发现与GES-1细胞中的低PSMA1蛋白水平相比,胃癌细胞中的PSMA1蛋白水平更高(图1B)。
免疫组织化学(IHC)染色显示PSMA1表达在浅表性胃炎(SG)中相对较低,在肠化生(IM)中上调,在异型增生(DYS)中适度增加,在胃癌组织中显著上调(图1C、D)。胃癌患者中PSMA1表达的总生存期K-M图显示,PSMA1的高水平表达与胃癌患者的较差总生存期显著相关(图1E)。

图1 | PSMA1在胃癌组织中含量较高
2. PSMA1与TAZ相互作用并使TAZ去泛素化
为了检测可能作为PSMA1潜在相互作用靶点的特异性底物蛋白,研究人员进行了TMT标记蛋白组学实验,以系统地检测PSMA1敲除的B胃癌-823细胞与对照组相比蛋白谱的表达变化。蛋白组学结果显示PSMA1 siRNA显著降低了YAP和TAZ蛋白水平。为确定siPSMA1中TAZ蛋白水平的降低是否通过蛋白酶体降解发生,研究人员用蛋白酶体抑制剂MG132或自噬溶酶体抑制剂氯喹(CQ)处理siCtrl或siPSMA1胃癌细胞,结果显示在缺乏PSMA1的情况下,蛋白酶体抑制剂处理显著回调了TAZ蛋白水平,表明PSMA1稳定了TAZ,并保护其免受蛋白酶体降解(图3B)。

图2 | PSMA1维持 TAZ稳定性
此外,研究人员用环己酰亚胺(CHX)处理胃癌细胞来抑制蛋白质的合成,对两种细胞系的实验表明,MG132可以抑制这一过程(图3C)。并且PSMA1的敲除显著增加了TAZ的多泛素化。综上所述,这些结果表明PSMA1是作用于TAZ蛋白的一种有效去泛素化酶。

图3 | PSMA1通过去泛素化稳定TAZ
3.PSMA1促进胃癌细胞系的增殖、迁移和侵袭
为了研究PSMA1在胃癌进展中的潜在功能,研究人员用siPSMA1和过表达质粒在AGS和B胃癌-823细胞中敲低和过表达PSMA1,结果显示,与对照组细胞相比,PSMA1敲低后胃癌细胞的集落数显著减少(图4A)。细胞迁移实验结果表明,PSMA1上调并促进了胃癌细胞的侵袭(图4E、F)。细胞计数Kit-8(CCK-8)测定显示PSMA1抑制降低了胃癌细胞的活力(图4G)。PSMA1过表达显著促进了胃癌细胞增殖和集落形成,分别由CCK-8和集落形成测定确定(图4H,B)。这些结果表明PSMA1促进了胃癌细胞的生长和增殖,代表PSMA1在胃癌发展中有促进肿瘤生长的作用。

图4 | PSMA1促进胃癌细胞系的增殖、迁移和侵袭
4.PSMA1通过TAZ发挥致癌作用
为了说明PSMA1在维持TAZ稳定性方面的作用机制,研究人员利用内源性蛋白质进行了相互免疫共沉淀(Co-IP)实验。结果显示PSMA1可以与TAZ相互作用(图5A)。此外,将外源Flag标记的PSMA1和Myc标记的TAZ质粒共转染到HEK-293T细胞中,发现Flag标记的PSMA1与Myc标记的TAZ免疫共沉淀(图5B)。此外,免疫荧光分析发现PSMA1和TAZ显著共定位(图5D)。上述结果说明了在胃癌细胞中PSMA1与TAZ相互作用的结论。为了研究TAZ是如何促进胃癌进展的,实验人员进行了免疫共沉淀等一系列实验,结果表明TAZ依赖其赖氨酸214位点的去泛素化促进胃癌细胞的生长。

图5 | PSMA1通过降低其泛素化来维持TAZ的稳定性
5.在临床胃癌样本中,PSMA1与TAZ呈正相关,预示着较差的生存结果

图6 | PSMA1的致癌作用依赖于TAZ的稳定性
临床上,使用肿瘤微阵列(TMA)分析了94例胃癌患者肿瘤标本和邻近正常组织中PSMA1和TAZ的表达,以及相应的临床病理信息。PSMA1和TAZ在大多数肿瘤标本中均显示高表达(图7A)。IHC评分显示,PSMA1和TAZ蛋白在胃癌组织中的表达水平明显高于邻近正常组织(图7B)。
随后,研究人员对收集的20对胃癌组织和浅表性胃炎组织,TAZ在肿瘤组织中显示高表达。临床病理分析显示PSMA1的高表达与晚期TNM分期(P= 0.006)和阳性淋巴结转移(P= 0.041)有关。研究人员进一步探索了这种表达关联对胃癌患者生存结果的预后影响。结果表明,PSMA1高表达患者的预后比低表达患者差,在TAZ蛋白中显示了相同的结果(图7C)。此外,PSMA1和TAZ水平之间存在显著的统计学相关性(图7D)。

图7 | PSMA1上调TAZ以促进体内胃癌细胞增殖
6.PSMA1促进体内肿瘤生长
为了验证PSMA1对体内细胞生长的影响,研究人员向裸鼠皮下注射PSAM1缺陷的AGS细胞,并每3天测量肿瘤体积(图7E),PSMA1缺陷组的肿瘤体积小于相应的对照组。此外,对照组中的肿瘤重量比PSMA1缺陷组重(图7F),IHC结果显示敲除的PSMA1抑制Ki67、YAP和TAZ的表达(图7G)。肿瘤组织的蛋白质印迹结果表明,敲低的PSMA1抑制了C-Myc、PCNA、Ki67、YAP和TAZ的表达(图7H),这与体外的结果一致。进一步证明了PSMA1在体内促进胃癌的肿瘤生长。
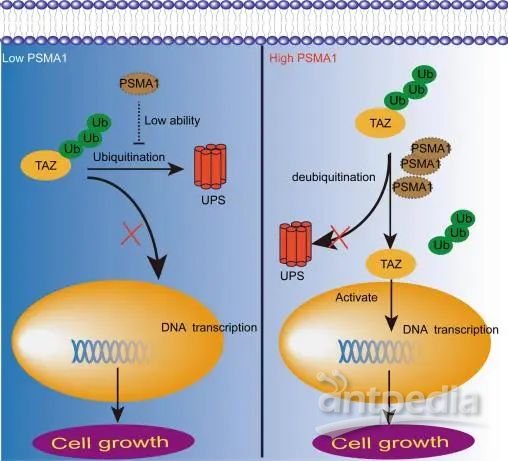
图8 | PSMA1对TAZ的调控机制方案
研究结论
本研究说明上调的PSMA1稳定了TAZ蛋白,促进胃癌增殖(图8)。PSMA1在胃癌中高表达,并与不良生存预后相关。PSMA1的上调促进了增殖、集落形成、迁移和侵袭。进一步的研究表明,PSMA1直接与TAZ相互作用,然后抑制TAZ的K27和K48连接的泛素化,以稳定和激活TAZ。TAZ的上调逆转了PSMA1在体内外对胃癌细胞生长的抑制作用。PSMA1与TAZ蛋白相关,并抑制其在胃癌细胞中的多泛素化和蛋白酶体依赖性降解。这一发现表明PSMA1可作为胃癌的新型预后预测因子和治疗靶点。
小鹿推荐
这篇文章运用TMT标记蛋白组学平台,系统的检测了PSMA1敲除组的蛋白谱变化情况,找到关键的靶蛋白,从而进一步研究PSMA1与TAZ蛋白之间的去泛素化作用,以及TAZ蛋白对于胃癌发展的作用机制,为后期胃癌临床治疗提供了新的思路。
鹿明生物在质谱领域经过多年发展,建立起了单细胞/微量蛋白质组学、4D-DIA/LFQ/PRM、iTRAQ/TMT、DIA、PRM、修饰蛋白组等蛋白组学技术平台,TMT标记定量蛋白组(6标、8标...18标)更是热推技术,更多组学咨询欢迎长按二维码咨询鹿明生物技术工程师~

猜你还想看
END
灵犀 | 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
09-21
学术交流|卓立汉光受邀参加第二十二届全国光散射学术会议09-21 光电行业都会关注
ACD/Labs 化学家基础工具软件方案09-21 ACD/Labs
【新品速递】Esco Avita系列冷藏箱09-21
通风橱安装维护指南以及安全提示(二)09-21
阿尔茨海默病日|我们如何对抗遗忘09-21
河北省建设行业职业技能竞赛决赛在石家庄顺利举行!09-21
展会现场|迪拜ARAB LAB 展览会202309-21 Mapada
【邀】聚力蛋白 远航未来——2023中国蛋白质组学大会午餐交流会09-21
超前、创新,脑类器官智能是否能成为下一代超算系统09-21 景辉
【课程预告】类器官创新应用09-21
热点应用丨SCION(赛里安)LC6000高效液相色谱仪对沥青基耐根穿刺防水卷材阻根剂的测定09-21 天美色谱
安装调试丨赛里安 LC6000 液相色谱仪安装调试须知09-21 天美色谱
安装调试丨赛里安 Artemis 6000 氨基酸分析仪安装调试须知09-21 天美色谱
Bettersize3000plus激光/图像粒度粒形分析仪09-21
共谱合作新篇章——丹东百特2023年全球代理商大会成功举行09-21 丹东百特
丹东百特持续开展“秋季助学”活动受称赞09-21 丹东百特
【百特小课堂】粒度测试的结果不同怎么办09-21
武汉大学周强辉团队--开启“Pd/NBE协同催化”新征程09-21 乐研
邀请函|2023食品药品质量安全与检测技术大会09-21