“色”路蹒跚,萧规曹随,浅谈固体制剂溶出度方法学
2022-11-23 10:34:29 月旭科技(上海)股份有限公司
原创作者:海南某药厂主任(资深色谱专家)题外话:我们吃的不是含量,是生物利用度;溶出度技术是评价固体制剂的灵魂与核心所在。以上是上海市药检所谢沐风老师说的,很在理。定义:大多数口服固体制剂在给药后必须经吸收进入血液循环,达到一定血药浓度后方能奏效,从而药物从制剂内释放出并溶解于体液是被吸收的前提,这一过程在生物药剂学中称作溶出,而溶出的速度和程度称溶出度,从药品检验的角度上讲,溶出度系指药物从片剂或胶囊等固体制剂在规定的溶剂中溶出的速度和程度。过去认为只有难溶性药物才有溶出度的问题,但近年来研究证明,易溶性药物也会因制剂的配方和工艺不同而致药物溶出度有很大差异,从而影响药物生物利用度和疗效,在USP中规定测定溶出度的制剂有相当数量是易溶性药物。质量研究中溶出度的内容:溶出度测试方法学和溶出行为方法学。
溶出度研究试验主要包括以下内容:(1)溶出介质的选择,(2)溶出介质体积的选择,(3)溶出方法(转篮法与桨法)的选择,(4)转速的选择,(5)溶出度测定方法的验证,(6)溶出度均一性试验(批内),(7)重现性试验(批间)等。
检验测试方法
检验方法-方法学验证
1. 检测波长的确定(辅料以及胶囊的干扰,胶囊一是对测试干扰,而是对样品崩解的影响)
2. 空白试验
3. 滤膜干扰验证
4. 线性试验
5. 回收率
6. 溶液稳定性
滤膜干扰试验:对照品用离心对比。
线性试验(50/60% 限度 100%)
回收率
溶液稳定性(0.5h 1.0h 2.0h 8.0h)
溶出度方法
溶出方法考察
1. 溶出转速选择
2. 溶出介质选择
3. 溶出限度和取样时间的确定
4. 溶出条件的确定
5. 溶出均一性考察
6. 三批检验
溶出介质/检测波长的选择:关键点为做曲线,取样时间点5、10、20(15)、30、45、60分钟。不同的介质可能影响到波长的选择,要和对照品一致。
溶出介质体积的选择:漏槽试验,参照标准。一般是500/900/1000ml
溶出装置的选择:利用标准方法进行试验,做曲线。一般是胶囊或易上浮样品用篮法,片一般用桨法。具体做法篮法100分钟/分钟,桨法50转/分钟。
转速的选择:一般为篮法75/100/150;桨法:50/75/100.
溶出度限度和取样时间确定
溶出度方法初步建立
溶出度均一性考察,要加上上市品作为对比。
1批小试 3批中试检验
4种溶出介质溶出度相似性试验,f2的计算
水
0.1mol/L盐酸
pH值4.5醋酸盐缓冲液
pH值6.8(7.0)磷酸盐缓冲液
评审中心提出的问题汇总:
1. 溶出介质的选择:通常情况下,溶出介质首选水,其次是0.1mol/L盐酸、缓冲液(pH值3~8)、人工胃液或人工肠液;若介质中加适量有机溶剂如异丙醇、乙醇或加分散助溶剂如十二烷基硫酸钠(0.5%以下)等,应有文献依据,并尽量选用低浓度,必要时应做生物利用度考察。通过测定药物在不同介质中的溶出曲线(通常应测定至药物全部溶出)来选择适宜的溶出介质。在一些申报资料中,仅简单地通过比较主药在各介质中的溶解度来选择溶出介质;还有一些品种在采用加有表面活性剂、有机溶剂或采用较高pH值的缓冲液为溶出介质时,没有提供充分的试验数据,难以说明介质选择的合理性。
2. 溶出介质的体积选择:溶出介质的体积需使药物符合漏槽条件,一般一个剂量单位以溶剂900ml或1000ml为最普遍,规格较小时也可使用常用体积的 1/2~3/4。为了满足某些特殊制剂的要求,中国药典自1995年版起增加了小杯法(即溶出度测定法第三法),小杯法常用体积为100~250ml。一些申报资料中,部分品种特别是规格较小的品种,为满足在溶出量测定时药物浓度的需要,在测定溶出度时,将两粒或数粒片剂或胶囊投入1个溶出杯中,这种溶出度试验法是不可行的。因为此时的溶出度测定已是数粒片剂或胶囊的平均溶出度,并没有客观地反映出每粒片剂或胶囊的溶出情况。通常小剂量药物的药效或毒性一般都较高,采用以上方法是不能保证药品的有效性和安全性的,应提请研究者加以注意。
3. 转篮法与桨法的选择:一般情况下,片剂多选择桨法,转篮法多用于胶囊剂或漂浮的制剂,研究资料应进行两种方法的对比试验,以确定最佳方法。
4. 转速的选择:目前,各国药典中收载的溶出度测定方法中的转速,大部分在50~100转/分。转篮法以100转/分为主;桨法以50转/分为主。一般认为桨法50转/分相当于转篮法100转/分。转速的设置与具体品种有关,通常,药物制剂的溶出速度随着转速的增加而增大。转速过快,可能会导致对不同制剂溶出行为的区分能力差,所以不推荐选择过高转速。转速的选择应以能区分不同处方和生产工艺的产品为宜,如确实需要选择高转速,应进行充分的验证。
5. 溶出度测定方法的验证:方法学验证内容与含量测定基本相同,应进行专属性试验(辅料、胶囊壳的干扰试验)、线性试验、回收率试验、溶液稳定性试验等。应该注意的是,在方法学验证中,试验所用的溶媒应为溶出介质,即应考查辅料、胶囊壳在溶出介质中的干扰,药物在溶出介质中的线性、回收率及稳定性等。在一些申报资料中,或者方法学验证内容不全面,或者虽进行了验证,但所有试验不是在溶出介质中进行的,使审评人员难以判断溶出度方法的可行性。
6. 取样点和限度的确定:通过溶出度均一性试验(考察同一批样品的溶出曲线)和重现性试验(考察至少3批样品的溶出曲线),确定合理的溶出度测定取样点和限度。为避免多次取样造成的误差,测定溶出曲线时取样点不宜过多,通常为5~6个点,小规格的制剂因采用100~250 ml溶出介质,所以溶出曲线一般可选3~4个时间点。限度应综合考虑溶出曲线拐点和一般性要求。在新药审评的过程中发现,胶囊壳的干扰试验经常被申报单位忽视。在 USP、BP和中国药典附录中,对空胶囊的干扰试验均有明确的规定,要求也基本一致。经试验考察,若空胶囊的干扰在2%以下时,可忽略不计;大于2%时,应对溶出度测定结果进行校正;大于25%时,则不能通过校正消除干扰,溶出试验无效,应重新选择溶出度测定方法。在溶出度研究资料中,另一个被忽视的问题是滤膜吸附情况的考察。在溶出度测定中,溶出液通常经过滤膜(中国药典规定滤膜孔径不大于0.8μm)滤过以得到澄清的溶液,试验所用滤膜应是惰性的,不能明显吸附溶出液中的有效成分,也不能被溶出介质溶出干扰测定的物质。因此在溶出度研究时,一定要首先考察试验所用滤膜对主成分是否有吸附,通常,吸附量在2%以下时可忽略不计;超过2%时应考虑选用其他滤过方法或更换适宜的溶出介质。另外在溶出度研究中还应注意溶出度试验仪的校正、溶出介质的脱气以及在操作中要严格执行SOP,保证实验数据的准确性,以全面正确和客观地反映药物的溶出情况。
溶出度结果不得大于含量测定结果的3%,如是这样,检测方法要重新验证。溶出曲线对于所选时间点溶出度结果变异系数的规定:第一选取时间点溶出结果的变异系数应不得过20%,自第第二时间点至最后时间点溶出结果的变异系数应不得过10%。如超出,应从仪器适用性、样品均一性、方法可行性的角度考虑予以解决。溶出度测试方法学部分内容:
试验条件:
仪器:LC-10AT VP(SHIMADZU) SPD-10A VP(SHIMADZU)
万分之一电子天平:Sartorius ABS-124S型
工作站:LCsolutionlite色谱工作站
色谱柱:月旭welchrom C18色谱柱,规格:250mm×4.6mm,填料粒径:5μm
检测波长:225nm
柱温:室温
流动相:流动相A为0.1mol/L磷酸二氢钾溶液-0.018mol/L十二烷基硫酸钠-甲醇-乙腈(275:275:200:250),用磷酸调节pH值至2.0;流动相B为乙腈。按下表进行线性梯度洗脱:
流速:1.2ml/min
运行时间:约11分钟
系统适用性:理论板数按阿莫西林峰和双氯西林峰计算应均不低于2000,双氯西林与阿莫西林的分离度应符合规定。主药在四种溶出介质中的色谱图:介质水: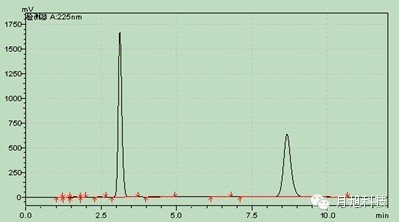 介质盐酸0.1mol/L
介质盐酸0.1mol/L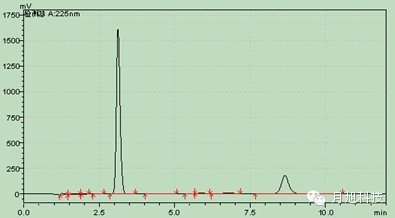 pH值4.5醋酸盐pH值6.8磷酸盐
pH值4.5醋酸盐pH值6.8磷酸盐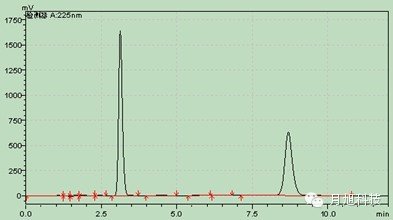 主药在四种溶出介质中的辅料干扰图:1.空白辅料 2.溶出介质 3.溶出介质中的主药水:
主药在四种溶出介质中的辅料干扰图:1.空白辅料 2.溶出介质 3.溶出介质中的主药水: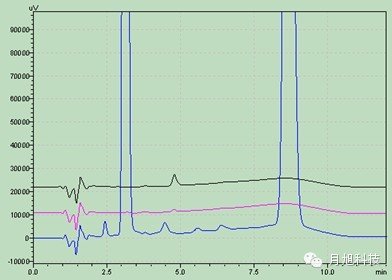 盐酸0.1mol/L
盐酸0.1mol/L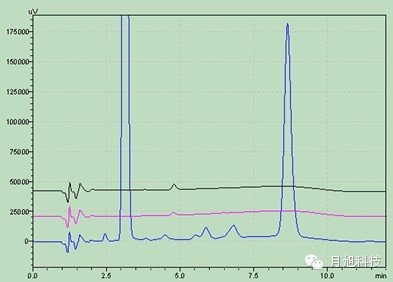 pH值4.5醋酸盐
pH值4.5醋酸盐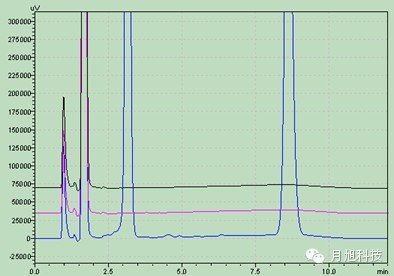 pH值6.8磷酸盐
pH值6.8磷酸盐
关于月旭科技:—————————————————月旭微信号:月旭科技公司官网:www.welchmat.com 服务热线:400-808-6760
月旭科技专注于研发、生产和销售色谱分离材料,并为广大的色谱工作者提供完整的色谱分离分析解决方案。我们的目标是成为中国色谱材料市场的领导者!
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家