项目文章 | 恭喜哈医大一院姚丽芬组支链氨基酸缓解帕金森小鼠的发病研究喜登医学一区顶刊
2022-11-04 04:38:34, 多层组学定制服务 上海欧易生物医学科技有限公司


前言
2022年9月,哈尔滨医科大学附属第一医院姚丽芬教授课题组(一作:闫珍珍)在Brain Behavior and Immunity期刊发表了题为 “Role of gut microbiota-derived branched-chain amino acids in the pathogenesis of Parkinson’s disease: An animal study ”的研究成果,通过气相色谱-质谱法、免疫学、GC-MS靶向代谢组学、微生物16S rRNA基因测序研究方法,发现了肠道微生物群代谢的动态变化特征,探究了BCAAs调节PD的机理,描绘了BCAAs影响肠道微生物群和炎症因子图谱,为帕金森疾病的深入研究提供了理论依据。
基本信息
中文标题:肠道菌群衍生物支链氨基酸在帕金森病发病机制中的作用:动物研究
研究对象:小鼠
发表期刊:Brain Behavior and Immunity
影响因子:19.227
发表时间:2022年09月
合作单位:哈尔滨医科大学附属第一医院
运用组学技术:气相色谱-质谱法、免疫学、GC-MS靶向代谢组学(由鹿明生物提供技术支持)、16S rRNA基因测序(由欧易生物提供技术支持)
研究背景
帕金森病(PD)是一种慢性进行性神经退行性疾病。迄今为止,PD治疗仍以增加左旋多巴,诱导大脑剩余的多巴胺能神经元末端多巴胺的合成来改善运动功能。本篇文章以肠道微生物群及其代谢产物为研究对象,进一步探究与PD有关的发病机制。
研究思路

实验方法
1. 实验分组
(1)PD模型组(口服鱼藤酮):每组10只小鼠
0周组(鱼藤酮未治疗);3周组(连续3周鱼藤酮治疗);4周组(持续4周鱼藤酮治疗)
(2)BCCAs组:每组9只小鼠
对照组;鱼藤酮组;鱼藤酮+高BCAAs组小鼠为6至8周龄雄性C57BL/6
2. 技术路线
2.1 行为测试:爬杆实验、转轴试验、粪便量
2.2粪便分析:DNA提取和扩增、16S rRNA 基因测序
2.3 代谢组学:血清分析
2.4气相色谱-质谱法:血清氨基酸分析
2.5免疫学:脑、结肠分析
2.6酶联免疫吸附试验:TNF-α、IL-1β、IL-6、LBP分析
3. 统计分析
S-t检验、Tukey事后检验的单向方差分析
研究结论
1. 鱼藤酮对PD小鼠肠道和运动功能及α-syn病理学的影响
鱼藤酮对小鼠肠道功能的毒性作用,通过观察1小时内的粪便排出量进行评估。与0周小鼠相比,3周、4周小鼠的粪便颗粒排出频率、粪便湿重和粪便水含量显著降低,4周小鼠比0周小鼠的减少更显著(图1C-E)。小鼠行为学测试发现,鱼藤酮治疗4周后,其爬杆时间显著延长、杆上掉落时间明显降低(图1F-G)。
免疫荧光显示,与0周小鼠相比,3周和4周小鼠结肠中的P-α-syn及服用鱼藤酮4周的小鼠黑质(SN)中的P-α-syn均显著增加(图2A-D)。随着鱼藤酮治疗时间延长,SN中TH的表达降低(图2B-E)。鱼藤酮治疗3周的小鼠主要显示肠功能障碍,鱼藤酮治疗4周的小鼠表现肠道功能障碍和运动功能障碍。
2. 鱼藤酮影响小鼠肠道微生物群的组成
小鼠服用鱼藤酮后,比较0周、3周和4周的微生物组群。与0周组相比,3周组富含厚壁菌,并伴有明显的拟杆菌。3周组的厚壁菌与拟杆菌的比率(F/B)比0周组高230%。与3周组相比,4周组的厚壁菌丰度显著下降,且4周组中的F/B比3周组下降51.6%(图3)。
对0周、3周和4周小鼠的α-多样性和β-多样性进行微生物群落结构评估。0周和3周组中,α-多样性没有显著差异,但在0周和4周组之间Chao1指数增加显著。与3周组相比,4周组的Simpson指数显著降低。通过未加权UniFrac、布雷-柯蒂斯距离Bray-Curtis距离和PCoA分析显示,三组之间的细菌组成存在明显差异。通过PCoA分析表明,鱼藤酮可引发微生物的组成发生变化(图4)。
4. 鱼藤酮处理时间引起的微生物群落动态变化
通过热图显示的聚类分析,确定了鱼藤酮处理0周、3周和4周组中微生物类群的变化,发现鱼藤酮与特定的细菌富集。丛毛单胞菌、嗜糖假单胞菌、螺旋杆菌、Ambiguous taxa 、普氏菌科NK3B31组、瘤胃球菌科UCG-014和厚螺旋菌科UCG-001的相对丰度增加,而洋海洋螺菌、杆菌属、未培养的酸性细菌、地温杆菌、苏特雷拉菌、普雷沃菌、莫尔干菌、未培养的拟乳杆菌、加德纳氏菌、梭杆菌和粪杆菌的微生物群落更丰富。观察鱼藤酮处理3周和4周的小鼠与肠道菌群的动态变化,发现乳杆菌、毛螺菌、类香味菌、乳球菌、棒状杆菌1、葡萄球菌、气单胞菌、AqS1、拟杆菌、嗜血杆菌、巨球菌、海洋球菌在治疗组中富集,而肠鼠杆菌 Muribaculum、毛螺旋菌属、杜氏乳杆菌、固氮螺菌47_25,Turiibacter和回肠杆菌在4周组中的含量显著增加(图5)。
5. 肠道细菌标志物与鱼藤酮的相关性
治疗时间根据RF机器学习算法,分别建立0周与4周、0周与3周、3周与4周组的预测模型。预测模型可分为0周组和4周组,肠道微生物群变异达到了92.41%。0周组中,粪杆菌、梭杆菌、未培养的乳杆菌和嗜血杆菌富集,而Muribaculum、Turicibacter、Ileibacterium和Pelomonas在4周组中富集。3周和4周的RF预测模型组中,随着鱼藤酮处理时间的增加,前9个类群中的5个类群的相对丰度明显降低,包括乳酸杆菌、乳球菌、葡萄球菌和气单胞菌。而0周组和3周组之间的差异很小,且预测模型的总体解释率为43.94%(图6)。
6. 鱼藤酮处理小鼠血清氨基酸产生的变化
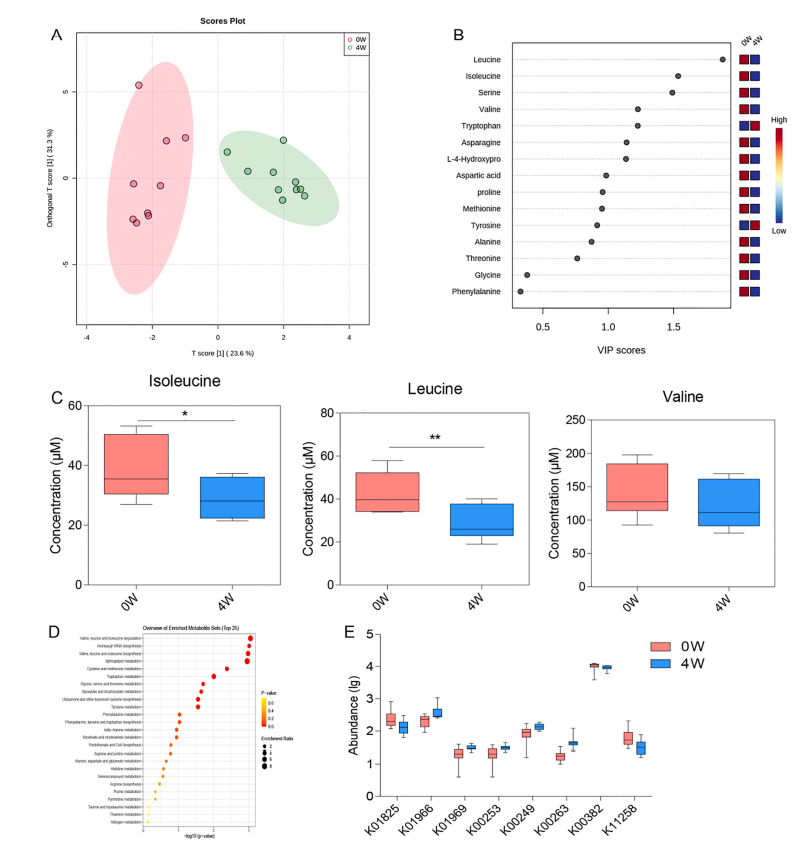
GC-MS代谢组学对19种氨基酸进行鉴定和定量。根据OPLS-DA模型,0周组和4周组之间分离度较好,再以OPLS-DA的VIP识别潜在的生物标志物。发现了VIP得分大于1的8种氨基酸,包括亮氨酸、异亮氨酸、丝氨酸、缬氨酸、色氨酸、天冬酰胺和L-4-羟脯氨酸。S- t检验筛选了0周组和4周组之间的差异代谢物,与0周组相比,4周组降低明显,且缬氨酸水平也有所下降,但两组间没有显著差异。MetaboAnalyst 5.0分析鱼藤酮治疗0周和4周组间代谢物的不同途径,4周组的缬氨酸、亮氨酸和异亮氨酸降解途径丰富(图7)。
7. 高BCAAs饮食减轻了鱼藤酮诱导模型小鼠的行为和病理特征
高BCAAs饮食显著改善了口服鱼藤酮引起的肠道功能障碍。与对照组相比,鱼藤酮组在测试中显示出更长的爬杆时间,旋转试验中显示出更短的潜伏期,表明高BCAAs饮食可缓解鱼藤酮的运动缺陷。高BCAAs饮食也恢复了SN中多巴胺能神经元的损伤,并改善了鱼藤酮引起的TH阳性神经元的减少情况(图8)。
8. 高BCAAs饮食可减轻小鼠的炎症反应
ELISA分析测量模型小鼠的LBP血清浓度,与对照组相比,LBP的血清水平显著高于鱼藤酮组。高BCAAs饮食组的血清LBP水平明显低于鱼藤酮组。此外,ELISA结果显示,鱼藤酮组结肠和SN中促炎因子(包括TNF-α、IL-1β和IL-6)的水平明显高于鱼藤酮组,表明高BCAAs饮食能够降低这三种促炎细胞因子的水平(图9)。
相关讨论
本篇研究,首次揭示了高BCAAs饮食对鱼藤酮诱导的PD小鼠的保护作用,同时表征了不同时间鱼藤酮治疗小鼠的肠道微生物组,并鉴定了与PD进展相关的微生物标志物。通过靶向代谢组学也确定了血清中BCAAs水平的降低。说明肠道微生物群及其代谢产物的失调在PD发病机制中的重要性,表明高剂量补充BCAAs可能是治疗PD的新方向,但需要深入探究BCAAs在PD中的可能机制。
研究分析发现,高BCAAs饮食改善了PD小鼠的肠道功能失调,并逆转运动功能障碍,同时也恢复了多巴胺能神经元的损伤。高BCAAs饮食也降低了PD小鼠的炎症水平,表现为血清LPS结合蛋白浓度降低、结肠及黑质中的促炎因子(TNF-α、IL-1β及IL-6)水平降低。
小鹿推荐
研究通过气相色谱-质谱法、免疫学、GC-MS靶向代谢组学、微生物16S rRNA基因测序方法,发现肠道微生物群和支链氨基酸(BCAAs)代谢的动态变化,可缓解改善PD的发病症状,即高BCAAs饮食通过调节炎症水平而改善PD。为PD的深入研究提供了新策略和新方向。

详情请扫码咨询鹿明生物技术工程师
参考文献
猜你还想看
1、Molecular Plant | 综述:植物代谢组学过去十年研究进展和未来展望
2、Cardiovasc Res | 千文综述!医学一区,心脏和心血管系统顶刊,当组学遇见功能-微生物与心血管疾病
3、项目文章 | 鲁南制药联合山东大学运用多组学技术解析人参固本口服液通过多靶点实现对甲状腺毒症小鼠的抗衰老作用
4、ADV SCI | 材料化学一区顶刊:国家肝癌中心利用多组学技术解析PD1高表达CD4/8双阳性细胞轨迹和功能特征
END
小妮子|撰文
小久|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点击“阅读原文”了解更多
11-22
年度巨献!AbrasiMet L Pro 自动砂轮切割机11-22 标乐中国
GE医疗全球总裁兼首席执行官彼得·安杜尼拜会国家卫生健康委员会副主任曾益新11-21
安捷伦公布Q4及全年财报:营业收入达预期值高点,每股收益超预期11-21
感恩回馈丨3D探秘 电子显微镜科技的魔法视界11-21
内毒素检测的OOS不合格结果调查11-21 Sievers分析仪
应用速递 | MaxPeak Premier色谱柱定量分析超短链到长链的PFAS11-21 沃特世
【网络讲座】选对色谱柱,工作更高效!11-21 沃特世
“限塑令”法规再升级 微塑料方案我先行11-21 飞飞
福利再返场!AZtecFlex学生版特惠价格再延期,多买多惠!11-21 牛津仪器
报计划清单 | 2024 等离子刻蚀及沉积工艺设备选型指南11-21 牛津仪器
会议邀请:艾捷博雅诚邀您相聚第八届中国分析仪器学术大会11-21 Agilebio
自杀OR实验室事故?!27岁麻省理工中国化学博士生突然身亡!11-21
快讯 | 600亿医药董事长辞职;河北拟新建33个省重点实验室…11-21
赛默飞离子、沃特世原装氘灯…超值钜惠!11-21 检测家
大咖解读文献 直播回放|中国矿业大学周宏伟教授团队-刘泽霖博士:低场核磁三轴压缩损伤作用下煤中孔隙-裂缝结构演变的原位观测和建模11-21 纽迈分析
哈希邀您共赴青岛在线仪器展!11-21
应用汇总 | 看NanoTemper如何在结构生物学领域大显身手!11-21 NanoTemper
直播预告 | 如何通过多参数稳定性表征来降低ADC开发过程中的风险?11-21 NanoTemper
喜报 | 欧品检测技术(辽宁)有限公司取得CNAS实验室认可证书11-21 欧品检测