看Cell文章怎么开发帕金森抑制剂
2022-08-20 23:39:50, 陈老湿 德国赛多利斯集团

帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,最主要的病理改变是中脑黑质多巴胺(dopamine, DA)能诱导神经元的变性死亡,由此而引起纹状体DA含量显著性减少而致病。典型的症状就是无力、迟缓、僵硬…
等等,陈老湿怎么最近也有这种感觉。。。哦,不对,这是天气太热,各地高温频频闹得。。。
说回正题,为了探究PD的确切病因,美国约翰霍普金斯大学医学院Dawson实验室曾命名了一种新的程序性细胞坏死形式——Parthanatos,又称PARP-1 dependent cell death,是基于DNA损伤,PARP-1激活的细胞坏死。这种细胞死亡广泛地存在于不同的器官不同的疾病中,包括帕金森病、阿尔茨海默症、多发性硬化症、亨廷顿氏舞蹈病等。
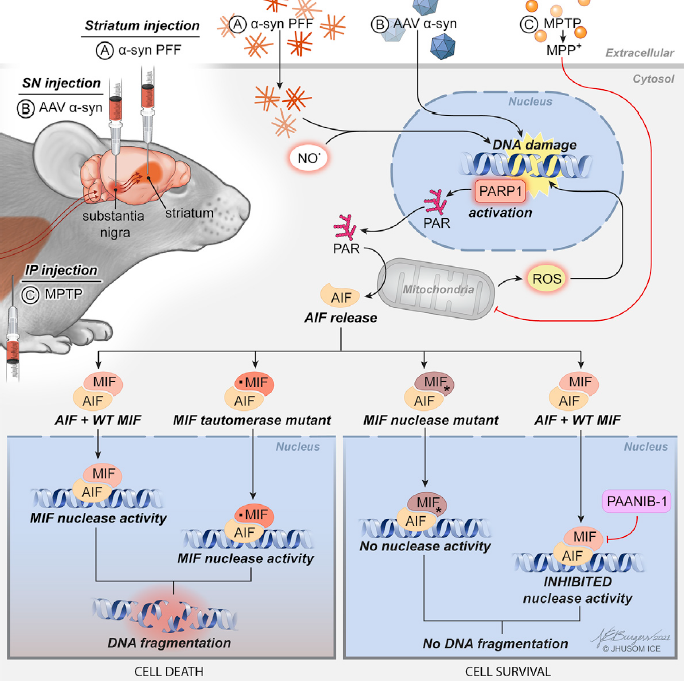
图1
近期,Dawson团队又有了重磅发现——抑制PAAN/MIF核酸酶可防止帕金森病的神经退行性,相关《Cell》文章于2022年5月10日在线发表。该研究揭示了病理性α-突触蛋白(α-syn)诱导的神经变性是通过Parthanatos相关凋亡诱导因子(AIF)核酸酶(PAAN)/巨噬细胞迁移抑制因子(MIF)的核酸酶活性发生的。PAAN/MIF的遗传耗竭和缺乏核酸酶活性的突变体可防止散发性PD的α-syn预成纤维(PFF)小鼠模型中多巴胺能神经元的缺失和行为缺陷。通过化合物筛选,研究人员发现了PAANIB-1—— 一种脑渗透性的PAAN/MIF核酸酶抑制剂,可以防止α-syn PFF、AAV-α-syn过表达或MPTP中毒在体内诱发的神经退行性。这项发现可能在人类神经退行性病症中具有广泛的意义。
陈老湿带大家整理下研究思路:
敲除或者耗竭PAAN/MIF核酸酶活性可以减少α-syn PFF引起的病理变化
证明PAAN/MIF核酸酶活性诱导的基因组DNA裂解和神经元死亡
构建筛选平台,通过受体蛋白复合物筛选小分子化合物库
优化小分子结构,并进行药代动力学分析
动物实验评估药物的特性
首先,研究人员通过基因敲除(KO)和突变(E22Q、P2G),利用腺相关病毒(AAV)在MIF KO小鼠中表达PAAN/MIF WT、PAAN/MIF E22Q和MIF P2G的基因,证实PAAN/MIF的核酸酶活性,而不是MIF的异构酶酶活性,是α-syn PFF诱导的体内神经退行性病变所必需的(图 2)。

图2通过删除PAAN/MIF的核酸酶活性,α-Syn PFF诱导的病理学特征减少
接着,研究人员确定了PAAN/MIF核酸酶转位介导了α-syn PFF诱导的基因组DNA裂解和神经元死亡。AIF和PAAN/MIF在α-syn PFF给药后相互作用,它们在细胞核内共同定位(图3C)。PAAN/MIF WT、E22Q和MIF P2G在对α-syn PFF的反应中的核转位没有差异。敲除PAAN/MIF可以防止α-syn PFF诱导的基因组DNA裂解(图3D)、细胞死亡(图3E和3F)。在MIF KO神经元中,通过慢病毒表达PAAN/MIF WT和MIF P2G可恢复基因组DNA的裂解和细胞死亡,但在用PAAN/MIF E22Q和AIF结合缺陷突变体PAAN/MIF E22A的神经元中未观察到DNA裂解和细胞死亡(图3D-3F)。在PAAN/MIF E22Q和MIF P2G回补的神经元中也得到了类似的结果。这些数据表明,PAAN/MIF的核酸酶活性及其与AIF的结合对基因组DNA的裂解和α-syn PFF诱导的细胞死亡是必需的。
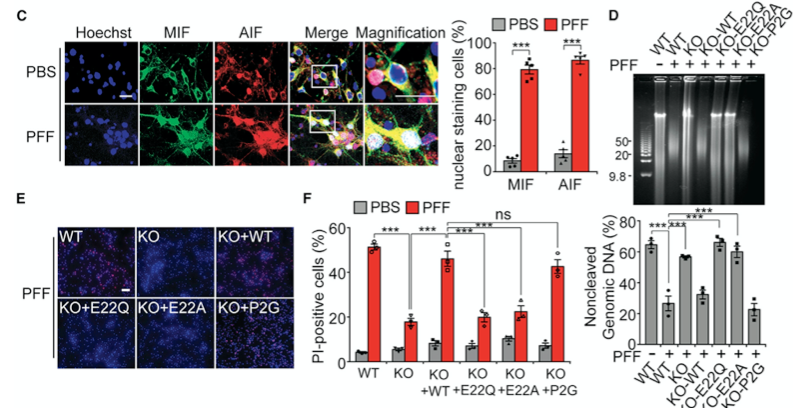
图3PAAN/MIF核酸酶活性是预防α-syn PFF诱导神经毒性的关键
在确认了PAAN/MIF核酸酶活性是诱导α-syn PFF引发病理性变化的关键证据后,研究人员构建了一个基于荧光显色的DNA完整性筛选平台(图4A)。当MIF具有核酸酶活性就可以结合到基因组DNA上,从而破坏DNA双链完整性,导致荧光信号降低或消失。当抑制剂与MIF结合后,MIF不再具备核酸酶活性,因此荧光信号正常显示。通过这一平台的构建,研究人员筛选了具有45,000个候选分子的化合物库。经过多轮筛选,最终找到了编号C8的化合物能防止用人α-syn PFF处理的人皮质神经元的基因组DNA裂解(图4G和4H),并且可以在口服后仍具有穿过血脑屏障(Blood Brain Barrier)的能力。

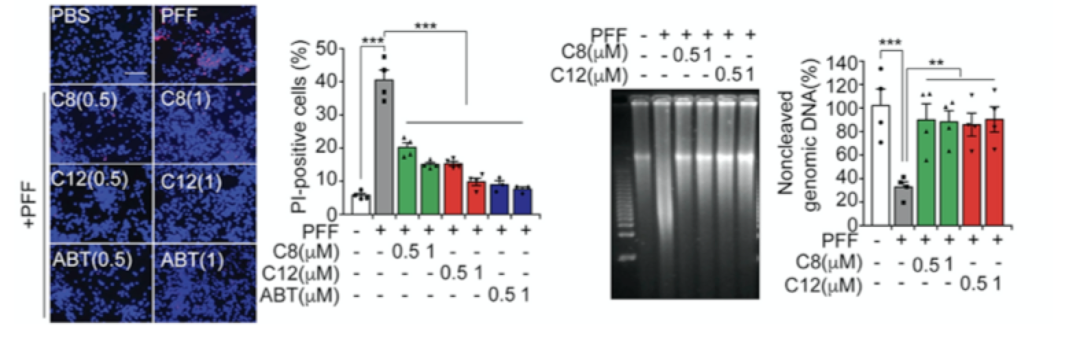
图4PAAN/MIF核酸酶抑制剂的筛选与鉴定
为了优化C8的效力并增加其中枢神经系统(CNS)的渗透性,研究人员设计了一个C8衍生物,优化后命名为C8-31(以下称为parthanatos-associated nuclease inhibitor-1,PAANIB-1),它与C8的不同之处在于增加了一个氟(图5B)。PAANIB-1能有效地抑制PAAN/MIF核酸酶的活性和Parthanatic细胞的死亡(图5A)。PAANIB-1抑制MNNG诱导的Parthanatic细胞死亡的IC50为0.28 μM,C8的IC50为0.52 μM(图5C)。PAANIB-1与C8相似,通过抑制PAAN/MIF核酸酶的活性,保护神经元免受α-syn PFF引起的突触障碍、NAD+减少和细胞死亡。

图5PAANIB-1是一种PAAN/MIF核酸酶抑制剂
然后,研究人员需要确定PAANIB-1如何影响PAAN/MIF核酸酶,首先就要判断PAANIB-1与PAAN/MIF是否直接结合?
PAAN/MIF与PAANIB-1的结合实验不出意外地选用了Octet® BLI(生物层干涉)分子互作分析系统进行定量检测,结果表明二者的亲和力KD值为1.56 μM(图6A)。
研究人员构建PAAN/MIF三聚体模型,预测了PAAN/MIF的61-64、67-68、73、98-100和106位的氨基酸是潜在的PAANIB-1结合点。对推定结合位点周围的每个残基进行了丙氨酸突变。其中,在PAAN/MIF L62A、PAAN/MIF 61-64A和PAAN/MIF N73A突变体中,PAANIB-1对MNNG诱导的细胞死亡的保护作用明显减弱(图6C)。进一步测定PAAN/MIF WT和丙氨酸突变体与PAANIB-1的结合动力学,结果表明,PAAN/MIF WT和Y100A突变体与PAANIB-1结合,而L62A和N73A突变体的结合明显减弱(图6D)。

图6PAANIB-1与PAAN/MIF的抑制作用机制是直接相互作用
文章最后,作者将PAANIB-1作为口服药物,通过小鼠实验的行为能力测试评估及病理实验证实PAANIB-1是一个具有成药潜力的小分子核酸酶抑制剂。这在开发靶向可药物化的PAAN/MIF核酸酶的细胞死亡抑制剂方面提供了启示和指导作用。
Summary
纵观整篇文章,作者结合目前常用的实验技术方法和手段,完成了出色的研究工作。其中体外的互作验证,采用BLI方法进行的蛋白与小分子结合动力学实验。基于BLI的Octet®是检测结合动力学的标准方法学之一,已经被写入美国药典。快速准确,结实耐用,成本低~
Octet® 分子互作分析系统

Download
了解更多BLI技术在小分子结合动力学的应用优势,下载《优化蛋白-蛋白,蛋白-小分子结合动力学分析应用指南》

下载全文
-参考文献-
Park et al., PAAN/MIF nuclease inhibition prevents neurodegeneration in Parkinson’s disease, Cell (2022).https://doi.org/10.1016/j.cell.2022.04.020



01-23 纽迈分析
GE医疗驰援海东地震灾区医疗设备已在医院就位01-22
重磅!全新Ergo KPFM让表面电势的测量简单又准确01-22 牛津仪器
屹尧科技助学金,温暖莘莘学子心01-22 屹尧科技
助力双碳,“氢”心打造-燃料电池汽车用氢质量分析方案(Ⅰ)01-22 飞飞
前沿应用|低场核磁共振技术用于固体药物多晶型的定性与定量研究(二)01-22 纽迈分析
岛津分析客户服务中心升级启航一AI引领向着数字化和自动化演进01-22 仪器信息网
1月23日直播 | 微观与宏观的美丽邂逅——先进金属材料前沿表征技术研讨会01-22 分析中心
哈希京东旗舰店店铺会员日01-22
偏振分光镜产品介绍01-22 韵翔光电
大寒却暖雪晴天01-21
2023元析仪器年会盛典 | 突破·创新,析望无限。01-20 元析仪器
寒气之逆极,故为大寒01-20
擦亮品牌 凝聚力量 | 皖仪科技获“行业先锋品牌”称号01-19 WAYEAL皖仪
【新功能】非靶向代谢组学中的同位素示踪01-19 核磁同位素学社
有奖互动 #谁最爱用过柱机?01-19 市场部
三度蝉联!丹纳赫荣膺“中国杰出雇主”认证01-19
惊!都2024了 还有人不知道儿茶酚胺怎么分析嘛01-19 王静
【视频】Phenomenex科学家话 #SPE的典型步骤 终极目标——“Catch”抓和“Release”放01-19
用户前沿丨清华大学/中科大合作, Science!01-19

