Make it Evident丨共聚焦&微流控:实现酿酒酵母单细胞复制寿命检测
2022-08-11 14:33:56, OLYMPUS生命科学 仪景通光学科技(上海)有限公司
Make it EVIDENT
本期推出【FV3000 Makes Yeast Evident】

本文作者:王颖瀛
东南大学电子科学与工程学院 MEMS教育部重点实验室
酿酒酵母与复制寿命检测
细胞及生物体的衰老是一个复杂的生理过程,通常被认为是由分子、细胞和器官的损伤不断积累造成。
酿酒酵母(Saccharomyces cerevisiae),又称出芽酵母(Budding yeast),作为首个实现完整基因组测序的模式真核细胞,具有繁殖迅速、培养条件简单、基因组小等优点,并且与人类的衰老曲线相似,成为衰老寿命研究的理想模型。
酿酒酵母在死亡之前只能产生有限数量的子细胞,这种现象被称为复制衰老,而在死亡前产生的子细胞的数量被称为复制寿命(Replicative Lifespan, RLS)。
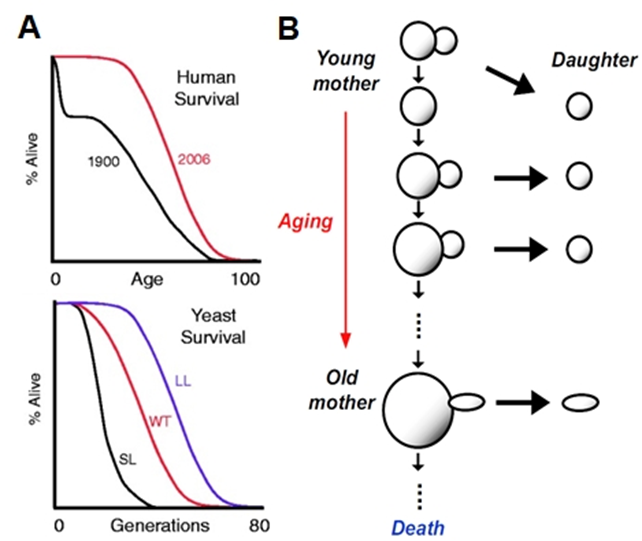
A 人类生存率曲线与酵母细胞复制寿命曲线类似[1]
B 酵母细胞复制寿命示意图[2]
酵母细胞复制寿命的传统测量手段是基于1959年提出的微解剖法,即利用微解剖针手动剔除培养板上单个酵母细胞产生的每代子细胞,从而得到复制寿命。该方法具有效率低、周期长、样本量小、对细胞易造成损伤等缺点。
而微流控芯片可利用微结构实现酵母单细胞的捕获,利用流体力剪切去除子细胞,为酿酒酵母自动化高通量单细胞培养和高时空分辨率监测提供可能,但有如下局限:
现有微流控芯片在细胞捕获稳定性、子细胞剪切效率、复制寿命检测精确性等方面都有待于提高;
现有微流控芯片较少关注大体积、随机出芽的双倍体酵母细胞的捕获培养和寿命检测。
显微成像技术在课题研究中的作用
东南大学电子科学与工程学院MEMS教育部重点实验室朱真副教授团队利用高通量微流控芯片取得了酿酒酵母单细胞复制衰老寿命研究的重要进展,相关研究成果于3月31日以“A high throughput microfluidic diploid yeast long term culturing (DYLC) chip capable of bud reorientation and concerted daughter dissection for replicative lifespan determination”为题,发表在国际期刊Journal of Nanobiotechnology上(影响因子:10.435,doi:/10.1186/s12951-022-01379-9)。
该论文研制的高通量酿酒酵母单细胞捕获-培养-解剖微流控芯片,与奥林巴斯FV3000激光扫描共聚焦显微镜双剑合璧,成功实现对双倍体酿酒酵母母细胞的可靠捕获和子细胞的一致性剪切,进而实现稳定的长期培养和完整的复制寿命检测研究。


搭载高通量酿酒酵母单细胞捕获-培养-解剖微流控芯片的FV3000
该微流控芯片主体为含有1100个的“瓶颈式”微结构阵列的单流体沟道。每个微结构由一个较大的“瓶身”和较为细窄的“瓶颈”组成,“瓶身”的大小恰好可限制酵母单细胞在结构中稳定捕获。利用母细胞在三维“瓶身”空间由流体拖曳力带动旋转的特性,可使母细胞任意位置所出的芽被拖曳、旋转、并限制在“瓶颈”处并进行实时观测。每个细胞周期结束后,成熟的子细胞可被流体力剪切去除,由此在连续出芽中实现母细胞的稳定保留。
 A 微流控芯片沟道实物图
A 微流控芯片沟道实物图
B 微结构阵列区实物图
C母细胞在捕获结构中带芽旋转和子细胞剪切过程示意图
该研究首先通过时序图像的统计对比测得最优微结构阵列排布方式和微捕获结构的尺寸设计。作者发现,通过调节微结构两行间相错间距及行间距,阵列即可利用“自填充”能力在实验初始4小时内实现单细胞捕获效率由70%上升至92.3%。根据优化的排布,我们通过视频观测到单细胞动态捕获过程。视频中,一旦上游的捕获结构捕捉到酵母细胞后,后续流经的细胞将绕过该结构而流向下游的空结构。
针对不同“瓶身”长度,时序图像显示在母细胞较小时,捕获结构容易捕获上游剪切下的细胞。而母细胞接近凋亡时,由于体积增大,子细胞旋转至“瓶颈”的成功率降低,朝向“瓶身”上游生长的子细胞会将母细胞拖拽造成样本丢失。根据统计的母细胞稳定保持的比例,最终确定“瓶身”长度优化值。

A 4小时内微捕获阵列中的空结构实现“自填充”
B 4小时内单细胞捕获效率提升
C 较短“瓶身”的捕获结构,朝向上游的子细胞将母细胞拖拽造成样本丢失
D 较长“瓶身”的捕获结构,易捕获上游剪切下的细胞
视频1:捕获带芽母细胞后,剩余细胞将绕过捕获结构而不被多余捕获
接下来,研究人员在高通量单细胞长时间培养过程中,通过视频拍摄观测并验证了母细胞在初始出芽时的动态旋转,并在芽稍大时重新定向至“瓶颈”处,且停止旋转直到胞质分裂完成后被解剖分离。通过时序成像,验证了母细胞在多代子细胞之间,面临随机的出芽位点依然能够实现稳定的“瓶颈”定向和子细胞剪切。
视频2:母细胞在细胞周期内出芽旋转至成熟子细胞剪切的动态过程
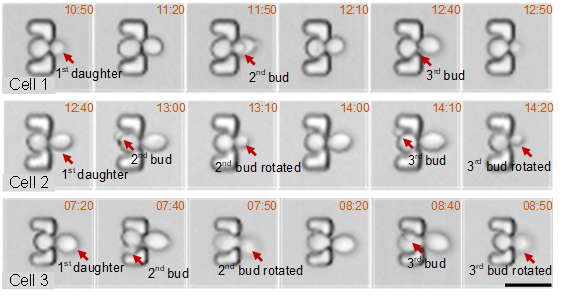 以10分钟时间间隔的时序成像过程中,上一代子细胞被成功剪切后下一代芽随即旋转至“瓶颈”中(三个样本分别为相邻出芽、相对出芽、随机出芽三种模式)。
以10分钟时间间隔的时序成像过程中,上一代子细胞被成功剪切后下一代芽随即旋转至“瓶颈”中(三个样本分别为相邻出芽、相对出芽、随机出芽三种模式)。
同时,酿酒酵母的细胞周期在其寿命内的分布也呈现一定规律。细胞在完成第一个细胞周期的用时比接下来5代用时略长,而接下来的复制寿命里,各代周期皆相对平稳,只在临近死亡的最后几代中急剧上升。选取样本并将其每个细胞周期使用不同颜色的长条标出,从而将细胞群体间的异步化结果变得可视化。
结果表明,细胞在前8至10代以内,细胞周期在细胞相互间保持有相对的同步性,随着细胞不断衰老,细胞间的异质化现象逐渐明显。临近细胞死亡时,细胞的周期被拉长,且细胞间差异逐渐扩大。
视频3:单个酿酒酵母细胞复制寿命的时序监测

A 双倍体酿酒酵母细胞的复制寿命曲线
B 不同时间点下,母细胞所产生的子细胞被空捕获结构捕获后的复制寿命
C 酿酒酵母细胞的平均细胞周期(出生对齐)
D 酿酒酵母细胞的平均细胞周期(死亡对齐)
E 细胞周期分布图
该研究后续工作包括利用卷积神经网络深度学习算法实现酵母细胞的复制寿命、细胞周期、生长速率等关键生理指征参数的高效智能分析,成功解决酵母细胞衰老过程中的表型分析问题,为酿酒酵母复制寿命及其衰老相关形态变化完整关联性图谱的构建提供可能,并在杂合性缺失、沉默信息调控等双倍体细胞独有的寿命调控模式研究上具有广泛的前景。
在成像样品制备以及图像采集中的注意事项
本文时序共聚焦图片均使用OLYMPUS FV3000激光扫描共聚焦显微镜拍摄。在成像过程中,我们先利用低倍物镜进行大视野成像生成导航图,然后在导航图中选择多个典型区域,利用20X和40X物镜进行高分辨率成像。
实验过程中,我们设定了每隔10分钟对导航图内各典型区域一次成像。此外,FV3000系统配备了z轴防漂移系统,可持续锁定焦平面,在长达3天的长时程成像中保证了焦面的稳定。FV3000的导航图和长时程锁焦功能,优化了我们的图像采集工作流程,为实验提供了便利性,保证了稳定可靠的实验数据的获取。
参考文献
[1] Smith, J., Wright, J., & Schneider, B. L. (2015). A budding yeast''s perspective on aging: The shape I''m in. Exp Biol Med, 240(6), 701-710.
[2] Lee, S. S., Vizcarra, I. A., Huberts, D. H. E. W., Lee, L. P., & Heinemann, M. (2012). Whole lifespan microscopic observation of budding yeast aging through a microfluidic dissection platform. Proc Natl Acad Sci USA, 109(13), 4916-4920.
更多精彩内容
请关注“OLYMPUS生命科学”
05-24
实战演练,技能精进——连华科技助力郑州市生态环境执法大队技能培训05-24
5月18-28日,快检系列双重优惠火热进行中!05-24
【海能实验室】膳食纤维测定仪测定可溶性、不可溶性及总膳食纤维含量05-24
陕西、北京、天津、湖北……渠道商交流会再更新!05-24
佳绩频传,宸安生物5月再获三项殊荣!05-24 市场战略中心
Opentrons Flex:让文库制备流程更便捷!05-24 Opentrons
2024半导体先进技术创新发展和机遇大会圆满闭幕05-24 优尼康
展会预告丨2024中国平坦化技术大会05-24 优尼康
【展会预告】钢研纳克邀您参加CISILE 第21届科仪展05-24
「钢研纳克」即将在 WCNDT 2024世界无损检测大会闪亮登场05-24
闪耀制造之巅|钢研纳克获颁制造业单项冠军企业证书05-24
HPLC-ELSD分离检测鲸蜡硬脂醇聚醚-2505-24 Unimicro
胤煌YinHuang与您相约武汉丨2024药品质量控制与检验技术大会05-23
上海交大/上硅所黄富强课题组设计新型超快充钠离子电池负极材料 | 用户成果速递05-23 HORIBA
【设备更新仪器推荐】高速高分辨显微共焦拉曼光谱仪——LabRAM Odyssey05-23 HORIBA
2024 ASMS,快来看看有哪些亮点?05-23 沃特世
半导体行业解决方案之共聚物分析05-23 沃特世
[inform]2024沃特世信息学全球用户大会圆满落幕!05-23 沃特世
UPLC,20岁生日快乐!05-23 沃特世