GUT | 单细胞转录+代谢组学:台湾辅仁大学陆嘉真团队发现肠道微生物群能调节慢性阻塞性肺病发病机制
2022-04-19 00:34:04, 多层组学定制服务 上海欧易生物医学科技有限公司


前言
2021年9月,台北辅仁大学陆嘉真团队在Gut发表的题为 “Gut microbiota modulates COPD pathogenesis: role of anti-inflammatory Parabacteroides goldsteinii lipopolysaccharide” 的研究成果,本研究通过小鼠吸烟(CS)的慢性阻塞性肺疾病(COPD)模型构建,评估肠道微生物群在COPD发展中的因果关系,另外采用单细胞RNA测序、血清代谢组学以及16S rRNA测序分析发现,肠道菌群组成显著影响CS诱导的COPD发育,存在肠道菌群-肺COPD轴。金氏拟杆菌(Parabacteroides goldsteinii)能改善COPD,降低肠道炎症,增强结肠线粒体和核糖体活性,系统地恢复血清中异常宿主氨基酸代谢,以及抑制肺部炎症。

基本信息
中文标题:肠道微生物群调节慢性阻塞性肺病发病机制:抗炎性金氏拟杆菌脂多糖的作用
研究对象:慢阻肺病人、金氏拟杆菌
发表期刊:GUT
影响因子:23.059
发表时间:2021年9月28日
合作单位:台湾辅仁大学
运用生物技术:非靶代谢组学、单细胞RNA测序、16S rRNA测序
研究背景
慢性阻塞性肺病(COPD)是一种全球性的疾病,其特点是肺部气流的慢性阻塞干扰了正常呼吸。尽管有报道发现呼吸道的微生物群与慢性阻塞性肺病有关,但肠道微生物群在慢性阻塞性肺病发展中的因果关系还没有确定。因此作者研究了肠道微生物群组成和肺部COPD发展之间的联系,并描述细菌及其衍生的活性成分对COPD的改善情况。
研究思路

研究方法
1、实验样本:小鼠(6-8周龄)
2、实验分组:CTL(对照组),CS(吸烟模型组),ABX(抗生素处理组),NEO(新霉素处理组),AMP(氨苄青霉素处理组),WAN(万古霉素),CS+Pg(金氏拟杆菌处理组)
研究结果
1
肠道微生物群参与COPD发展的证据
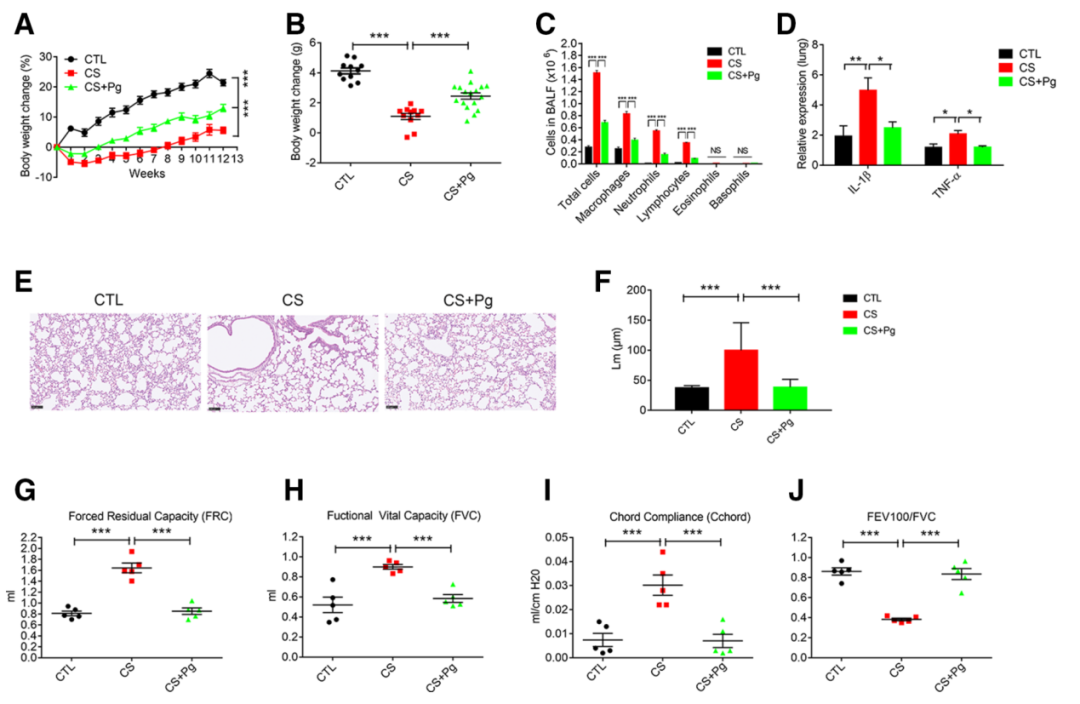
作者使用了小鼠的CS模型来研究肠道微生物群是否可能有助于CS诱发COPD的发展。研究结果表明,吸烟12周的CS小鼠体重明显下降,支气管肺泡灌洗液(BALF)中免疫细胞的浸润增加;相比之下,与与对照组共同饲养的CS小鼠(CO-CTL)体重增加,浸润的免疫细胞减少;对照组小鼠与CS(CO-CS)组出现了异常的表型。同时,肺组织切片的组织学分析显示,与CTL小鼠相比,CS暴露的小鼠表现出周边肺气肿的变化,其特征是肺泡壁的破坏和气隙的扩大。相比之下,CO-CTL组恢复了病理变化,而CO-CS组则加剧了病理变化。根据联合研究的结果推测,CTL和CS小鼠的肠道细菌可能分别存在有益和不利的关系。
2
ABX治疗可减少CS诱导的COPD发病
为了确定肠道微生物群组成在COPD发展中的重要性,在CS前2周对小鼠口服单个药物(万古霉素(VAN)、新霉素(NEO)、甲硝唑(MET)和氨苄青霉素(AMP))和组合药物ABX17。在CS小鼠中观察到的异常表型在ABX、AMP和VAN-治疗组中得到明显改善(图1A-K)。相反,口服NEO或MET治疗对COPD的发病机制影响不明显(图1A-K)。结果表明,共生微生物群的组成影响CS诱导的COPD的炎症和发病机制,ABX是治疗COPD小鼠肺部的最佳方式。
3
肠道微生物群组成对COPD的发展起着因果作用
ABX治疗的有益作用可能是通过改变肠道微生物群组成来介导的。为了了解肠道微生物群结构的改变是否会对COPD的发展起到因果作用,作者进行了粪便微生物群移植(FMT)实验。将经ABX、NEO、AMP或VAN处理的CTL或CS小鼠的供体粪便微生物群转移到CS受体小鼠身上。来自CTL、ABX处理、AMP处理或VAN处理小鼠的粪便微生物群明显改善了COPD综合症(图1L-U)。相反,来自CS或NEO-处理的小鼠的微生物群未能逆转CS受体的COPD特征(图1L-U)。因此,肠道微生物群结构的改变可能对COPD的发病机制起到因果作用。
使用16S rDNA测序确定了各组小鼠的肠道微生物群组成(图2A)。与CTL小鼠相比,CS小鼠粪便中Erysipelotrichaceae、Bacteroidales和Ruminococcaceae的相对丰度明显降低,Lachnospiriaceae的相对丰度则增加。ABX治疗和FMT都会影响CS小鼠的肠道微生物群组成(图2A)。
通过使用宏基因组测序(图2B),确定了与CS组相比因抗生素(ABX、NEO、AMP和VAN)而明显改变的17种细菌物种。其中金氏拟杆菌和大肠杆菌与COPD严重程度明显负相关(图2C),16S测序数据中Parabacteroides goldsteinii (Pg)和大肠杆菌的相对丰度与qPCR验证的数据基本一致,然而AMP组中Pg的相对丰度在qPCR数据中没有明显改变。此外,任何两组之间通过FMT明显改变的细菌种类表明,只有Pg在ABX、VAN和AMP处理的小鼠组有增加的趋势(图2D)。
在CS小鼠中发现Lachnospiriaceae明显增加,推测COPD严重程度和Lachnospiriaceae之间的呈现正相关性。因此,结合所有获得的数据,选择Pg进行后续研究。
4
Pg MTS01改善COPD
随后作者从ABX处理的粪便微生物群样本中分离出一株Pg菌株MTS01。Pg MTS01的16S rRNA基因测序显示与Pg JCM13446的基因有99.9%的一致性。口服Pg MTS01的小鼠体重明显增加并改善COPD表型(图3A-J)。在结肠中,Pg MTS01治疗减少了促炎症细胞因子如IL-1β和TNF-α的表达,并增加了CS小鼠ZO-1和Occludin的表达。Pg MTS01进一步恢复了在Caco-2-细胞体外模型中TNF-α诱导的细胞层通透性。分析Pg MTS01对体重变化、肺部和肝脏的组织病理学、血清GPT和BUN水平的影响,结果表明Pg MTS01对健康小鼠没有不良影响。
5
Pg MTS01降低CS小鼠肠道炎症,增强细胞核糖体和线粒体活性
为了进一步确定Pg MTS01对结肠细胞生理学影响,作者对经过或未经过Pg MTS01处理的CS小鼠的结肠组织衍生细胞进行了单细胞RNA测序(scRNAseq)和分析(图4A、B)。与CTL小鼠相比,CS小鼠的脂肪酸代谢、二十烷烃代谢、膜微血管形成和内肽酶活性的基因表达增加,而涉及核糖体生物生成和线粒体活性的基因表达减少。
相比之下,Pg MTS01给药后,CS小鼠的细胞抗氧化剂、氧化还原过程、抗菌剂、线粒体去极化、核糖体活性和粘蛋白产生等基因明显上调(图4C、D)。Mptx1、Ang4和Muc2、RNR1、RNR2、Cytb、PGC-1α、ND-5和线粒体编码的转录因子A基因的表达水平与氧化应激和核糖体或线粒体活动有关,结果通过qPCR进一步验证。
相比之下,Pg MTS01对CS小鼠的任何GO途径都没有明显的下调。随后作者分别测量了与氧化磷酸化和非线粒体糖酵解功能有关的耗氧率(OCR)和细胞外酸化率(ECAR),结果证明Pg MTS01增加了CS小鼠的异常OCR活动,并降低了ECAR。因此,推测Pg MTS01有减少炎症的功能,并可以恢复CS小鼠结肠中被废除的细胞核糖体和线粒体活性。
6
Pg MTS01系统性恢复Cs小鼠异常氨基酸代谢
口服Pg MTS01改善COPD肺部发病机制的现象可能与恢复血液中的系统异常代谢有关。为了进一步确定小鼠血清中的代谢组学是否受到Pg MTS01治疗的影响,作者进行了非靶代谢分析。对血清代谢物的代谢通路分析,发现Pg MTS01治疗最明显地改善了CS小鼠的异常氨基酸相关代谢途径,包括增加瓜氨酸和脯氨酸的生物合成,苯丙氨酸和甘氨酸的降解等。因此,推测Pg MTS01可能增强与细胞核糖体、线粒体活动以及尿素循环周转有关的氨基酸代谢。
7
Pg MTS01减少Cs小鼠的肺部炎症
进一步的肺组织单细胞RNA测序分析表明,CS增加了B细胞和巨噬细胞的存活数,并减少了T细胞和中性粒细胞的数量,而这些改变都能被Pg MTS01的给药所逆转(图4E,F)。此外,Pg MTS01明显恢复了CS小鼠中发现的异常基因表达模式。相比之下,涉及抗氧化活性、二十烷烃结合活性、脂肪酸合成和免疫反应的基因被上调(图4G-I)。然而,Pg MTS01没有明显降低CS小鼠的血清IgG水平。简而言之,Pg MTS01减少了过度炎症免疫反应,包括那些与肺组织中B细胞受体信号有关的反应。
8
Pg MTS01 LPS(Pg LPS)拮抗大肠杆菌LPS诱导的炎症
对Pg MTS01的全基因组序列进行BLAST分析(图5C),发现参与脂质A合成的基因与Bacteroides dorei和Bacteroides thetaiotaomicron中的基因相似(图5D,E)。相对于肠道细菌分离出的促炎性脂多糖(LPS),Bacteroides衍生的LPS亚型表现出明显较低的内毒素和免疫刺激反应。为了了解Pg MTS01和大肠杆菌是否表现出亚型特异性LPS免疫原性的差异,作者测定了它们对细胞活化的影响。结果发现Pg-LPS显示出对EC-LPS活性的拮抗作用。
9
Pg-LPS改善CS诱导的COPD综合征
随后,作者研究了Pg-LPS在改善CS-诱导的COPD发病机制方面的潜力。由于腹腔内(i.p.)施用促炎性LPS会促进COPD的肺气肿发展,于是作者测试了Pg-LPS对CS小鼠的i.p.处理效果,对COPD进行表型分析。与CS小鼠相反,Pg-LPS治疗在低剂量和高剂量下分别使体重增加18%和13.9%(图6A,B),减少BALF细胞浸润(图6C),并使肺部病理学和功能正常化(图6D-I)。此外,Pg-LPS减少了COPD小鼠肺组织(图6J,K)和结肠(图6L,M)中促炎症细胞因子的过度表达,如IL-1β和TNF-α。同时,COPD小鼠支气管肺泡灌洗液(图6N)和血清(图6O)中增加的LPS浓度和活性都被Pg-LPS显著降低。进一步的研究表明,用Pg-LPS处理的对照组小鼠的肝脏和肾脏功能正常。因此,推测Pg MTS01来源的LPS改善了CS诱导的小鼠COPD。
研究讨论
肠道微生物群组成显著影响CS诱导的COPD发展,粪便微生物群移植后可改善COPD。分离出的共生细菌金氏拟杆菌,在减少肠道炎症和增强结肠中的细胞线粒体和核糖体活性方面发挥重要作用,能够系统地恢复血清中异常的宿主氨基酸代谢以及抑制肺部炎症。研究证明Pg MTS01和Pg-LPS可能是改善COPD的潜在治疗药物。
小鹿推荐
通过单细胞RNA测序以及血清代谢组学分析,能够了解粪便微生物群移植和抗生素治疗对COPD的改善情况,从而评估肠道微生物群组成与肺免疫力之间存在的作用关系,来找到一些潜在的有益细菌菌株及其功能成分用以预防或治疗COPD的替代药。
.
文末看点|lumingbio
欧易/鹿明生物推出的16s+代谢组学的多层组学研究思路继本篇文章前已先后助力了浙江工业大学、中国农科院、青岛农业大学等在微生物一区顶刊Microbiome、医学一区顶刊GUT发表文章。
鹿明生物“组学发文快”豪礼促销16S微生物多样性+LC-MS+GC-MS 1100元/样~快点咨询当地工程师或者扫码咨询小鹿皆可得到快速回复~
详情请戳:
 项目文章 | 恭喜中国农科院及青岛农业大学团队继GUT后又喜发微生物顶刊Microbiome。
项目文章 | 恭喜中国农科院及青岛农业大学团队继GUT后又喜发微生物顶刊Microbiome。

长按咨询16S+双平台代谢促销活动

扫码观看16S+代谢医口线上课
猜你还想看
1、前沿技术 | 单细胞蛋白质组技术开启极微量蛋白组精细研究新时代
END
叮当|撰文
小久|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多
04-19
全域感知,“育”见环博 | 谱育科技再赴上海环博会之约04-19 点击关注→
融合创新,质领未来 | 青源峰达“THz+ & IC+”双生态亮相2024第十七届中国科学仪器发展年会04-18 SHINE
近期热招职位 | 春暖花开之际,来和我们做同事吧04-18
来真的,揭秘药物销量榜“药王”诞生04-18
圆满收官丨慕尼黑俄罗斯分析生化展览会落下帷幕!奥谱天成创新成果闪耀全场04-18
BET系列新品即将发布!国仪量子邀您参加CIBF202404-18 CIQTEK
顺磁小课堂47期 | 操作EPR谱仪不能携带手机、银行卡、硬盘等磁性物体?04-18 CIQTEK
培训通知 | 国仪量子2024年第二期SEM线下应用培训班04-18 CIQTEK
【实验室动态】QD中国样机实验室引进M91快速霍尔测量仪,极低迁移率材料测量速度提升100倍!04-18 Dr. Shen
病原微生物测序方案,您想了解的都在这里04-18
探索生命之光,让每一次检测都清晰可见!04-18 aladiin
土壤/沉积物中的有机碳、无机碳及元素碳检测方案 | 德国元素04-18 德国元素
Moku时间间隔与频率分析仪发布!表征和控制系统应用的全面解决方案。04-18 圈内人都会关注
杂质溯源及清除率研究04-18 ACD/Labs
国际展会 | 鉴知技术探索俄罗斯实验室仪器展04-18 鉴知技术
拒绝网络谣言,守护清朗园区04-18 国产精密仪器厂家
【知识&好礼】 ATAC-seq(染色质开放性测序)速览04-17
【预告】让你的核酸检测精准高效04-17
橙达仪器受邀参加中国化学会第十八届全国有机合成化学学术研讨会04-17 Orienda