精准医学的“桃花源”:血小板多组学
2024-05-24 18:24:18, Untangled

背景介绍
BACKGROUND
血小板(Platelet)是血液循环中最小的无核细胞成分,具有丰富的胞内颗粒。在正常血液循环中,血小板保持静息状态,但一旦受到生理或物理刺激因子的作用,就会发生活化。血小板活化时,其内的颗粒膜糖蛋白迅速发生数量和构型变化,并与血浆中的受体蛋白结合,导致血小板聚集和血小板成分的释放。
在过去的十年中,许多研究详细阐述了血小板在止血和血栓形成之外的新功能。分子和功能研究表明,血小板在血管重塑、免疫调节和组织再生过程中发挥着重要作用(见图1)。血小板在心血管疾病发展过程中的作用已被证实,同时也被证明是癌症、炎症性疾病和感染(例如SARS-CoV病毒)的病理生理过程中的关键参与者。血小板及其异质状态、血小板释放物和其他靶细胞在各种疾病中的研究为诊断、预后和治疗提供了重要的机制线索。

图1. 血小板的生理和病理示意图
分析前对血小板研究的挑战
血小板在离开血液循环后对环境变化非常敏感,如温度、pH值、机械应力和添加物。因此,收集血液时需特别小心,最好使用聚丙烯塑料管或涂有柠檬酸钠缓冲液的硅胶管。为基础或临床研究准备血小板需要全血、富血小板血浆(Platelet rich plasma,PRP)或洗涤血小板。分离PRP只需一个离心步骤,但制备洗涤血小板需要连续离心。洗涤后的血小板最好使用酸-柠檬酸盐-葡萄糖缓冲液(pH 6.5)作为抗凝剂,以防止其活化。在处理PRP时,要避免过度抑制可能的血小板活化或聚集。在离心前可添加前列腺素(PG)I2、PGE1和/或apyrase来防止这种激活。

图2. 血小板的分离步骤
血小板蛋白质组学
血小板含有大量蛋白质(估计超过3000种),包括膜蛋白、细胞骨架蛋白、信号蛋白、酶、凝血因子和转录因子。蛋白质组学可以无偏地鉴定蛋白质和其翻译后修饰,从而表征信号通路和蛋白质之间的相互作用。
蛋白质组学的进展使得研究血小板蛋白质成为可能,而磷酸化蛋白质组学分析则揭示了静息和活化血小板的磷酸化模式。利用固定化金属亲和层析(IMAC)、TiO2结合纳升级液相色谱(nLC-MS)以及同位素标记或非标记定量蛋白组学,可以确定血小板激活信号传导的特定位点。糖基化蛋白质组学研究表明,粘附蛋白与胶原蛋白结合后的N-链接糖基化起着主要作用。血小板蛋白泛素化是另一种重要的翻译后修饰,参与蛋白质降解、信号转导和蛋白质相互作用,可以通过血小板泛素化蛋白质组学进行分析。
血小板与疾病
血小板被认为是血管损伤的第一反应者,能够迅速应对血液中的扰动,如炎症或高血糖。它们的寿命短(7-10天),体积小(直径2-4μm),且无核,因此过去认为它们只能起到有限的作用,比如促使血栓形成。但现在我们知道,血小板比以前认为的更加复杂多样化,涉及到许多重要的细胞过程,如自噬、程序性细胞死亡和快速新生蛋白合成。研究已经确定了血小板在维持血管稳态和参与免疫反应中的多种作用,如在炎症、心血管疾病、神经退行性疾病和肿瘤等方面。血小板直接或通过释放信号介质与多种其他类型的细胞相互作用,包括循环血细胞、内皮细胞和其他血管壁细胞。因此,血小板在免疫系统(与各种白细胞相互作用)和血栓形成(通过激活和释放止血和炎症介质)之间扮演着桥梁的角色。
导致病理性血小板过度激活的可能因素包括心血管危险因素,如老年、糖尿病、肥胖和缺氧性肺部疾病,以及导致细胞内活性氧(ROS)水平升高的免疫因素。血小板过度激活的结果包括血小板微泡和颗粒释放增加,导致血栓形成和局部及循环细胞因子风暴增加。血小板活化的增加可能导致血小板与白细胞(尤其是中性粒细胞)结合,以及血小板凋亡和/或聚集,从而进一步促成血栓形成和炎症加剧。纤维蛋白溶解受损和内皮病变的存在可导致血栓形成增加,进而可能引发生命危险的血栓和血栓栓塞。肺是最容易形成血栓的器官,但这种情况也可能发生在心脏、肾脏和肝脏等多个器官中。随着血小板过度激活、细胞凋亡和血栓形成的增加,血小板的清除率和消耗量也会增加,导致血小板减少。只有当巨核细胞无法产生足够的血小板来弥补丢失时,才会出现血小板减少症。
血小板与COVID-19
研究表明,在COVID-19病毒感染期间,血小板可能会促进整体的凝血和炎症反应,可能导致血栓形成、血管并发症和高死亡率。在存在潜在内皮病变、凝血功能障碍和炎症的情况下,COVID-19与血小板减少、血栓形成和出血之间存在关联,这些情况都是疾病严重程度和不良预后的生物标志。血小板病(血小板功能障碍)是COVID-19的一个显著特征,可能包括血小板减少和血小板过度活化,这可能导致过度血栓形成和免疫反应功能障碍。在COVID-19患者中,血小板减少可能与纤维蛋白原水平下降和出血风险增加相关,特别是在接受抗凝治疗的患者中。然而,在重症COVID-19患者中,纤维蛋白原水平下降和出血事件相对较少,而血栓并发症更为常见。一种解释是COVID-19患者的血小板过度活化。研究表明,患有心脏代谢疾病和合并症(如糖尿病)的患者血小板凋亡率很高。此外,凋亡血小板的存在促进了存活血小板的过度活化。考虑到重症COVID-19患者常伴有心血管并发症,血小板凋亡可能是COVID-19发病机制的重要因素。此外,其他与COVID-19发病机制相关的因素,如缺氧、炎症、免疫系统激活以及内皮激活和功能障碍,可能进一步诱导血小板活化和凋亡,导致血栓形成增加。
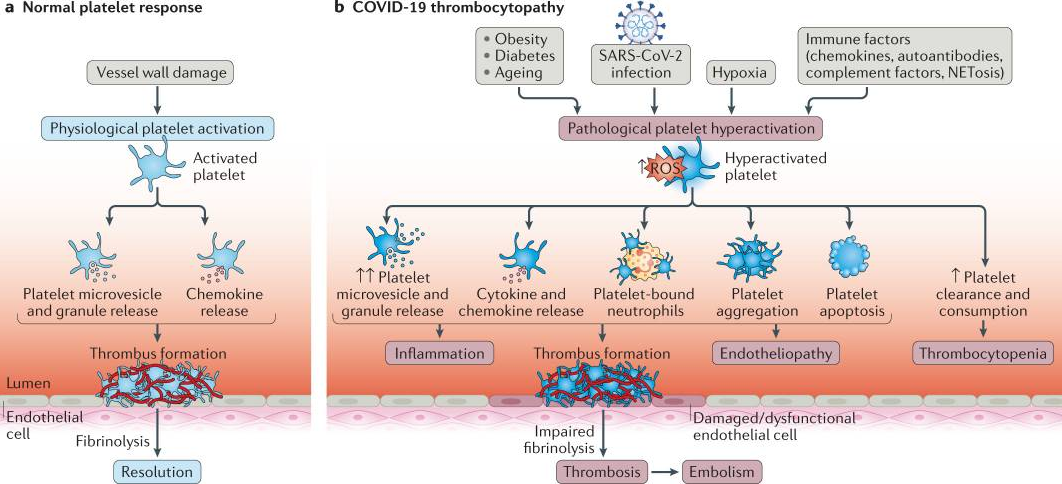
图 3.COVID-19与血小板。血小板对血管壁损伤的正常生理反应,即止血(图3a)和COVID-19(图3b)
总结
基础科学研究的重大进展表明,血小板不再被视为同质的群体,而是一个具有多个亚群的异质性群体,它们之间相互作用,可以预防或促进疾病的进程。通过经典和先进的技术研究,我们能够更好地理解血小板的异质性,不同亚群的功能以及它们在疾病中的作用机制的复杂性。采用新兴的检测方法,如蛋白质组学和代谢组学技术,可以有效且准确地研究血小板功能和反应的个体差异水平,这对提高抗血小板药物的临床安全性至关重要。这些方法还可以用于临床高通量筛查,尤其是在创伤患者中进行快速决策,并确定针对特定血小板亚群的新疗法。这些技术还可用于监测治疗效果,从而提高我们对疾病病因和出血风险的理解,为定制针对性治疗心血管疾病和其他疾病的方法奠定基础。
我们的解决方案
氨探生物针对血小板建立了高通量和深度覆盖的蛋白质组学、磷酸化修饰组学、代谢组学和脂质组学检测与分析平台,实现了高效、准确地研究血小板功能和个体差异反应,并以此来阐明复杂疾病血小板相关的生物标志物和的发病机制。
参考文献
1. A guide to molecular and functional investigations of platelets to bridge basic and clinical sciences. Nat Cardiovasc Res. 2022;1(3):223-237.
2. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 2023 Apr 18;4(2):102150.
3. Thrombocytopathy and endotheliopathy: crucial contributors to COVID-19 thromboinflammation. Nat Rev Cardiol. 2021;18(3):194-209.
Untangled Biosciences
解构健康奥秘、探寻生命答案,氨探生物以一流的分子表型组平台和成熟的临床转化应用体系,为优秀的研究团队进行技术和数据赋能,致力于实现分子表型水平的精准诊疗。
05-28
聚力真空技术,赋能行业发展——2024科学仪器开发者大会“真空技术论坛暨中科科仪地区用户会”融合创新举办05-28
从Microtrac到Microtrac MRB,再到Microtrac的创新与守成——访麦奇克全球销售总监05-27 大昌华嘉
碳酸钙的电声特性05-27 大昌华嘉
邀请函 | 2024中国涂料油墨峰会暨展览会05-27 大昌华嘉
DWS微流变学用于化妆品配方设计—Rheolab应用05-27 大昌华嘉
土壤/植物样品中碳、氮含量以及TOC总有机碳含量测定05-27 大昌华嘉
网络研讨会 | 欢迎来到百欧林(Biolin)用户日2024!05-27 大昌华嘉
网络研讨会 | Turbiscan稳定性分析仪如何改善现代食品和饮料以满足未来需求05-27 大昌华嘉
安捷伦与香港浸会大学合作成立联合实验室05-27
群英荟萃 Park葳蕤: Park 出席半导体先进技术大会展示Park原子力显微镜在化合物半导体应用05-27 Park原子力显微镜
ProteoSil生物用液相色谱柱重磅上市!—解决易吸附金属配位物的拖尾问题05-27 技尔GL Sciences
又一标准发布并实施!天隆参与!05-27
罕与光™公益项目持续扩大受益面,为更多罕见病家庭点亮希望之光05-27
官宣!连华科技新官网正式上线,体验再升级05-24
实战演练,技能精进——连华科技助力郑州市生态环境执法大队技能培训05-24
5月18-28日,快检系列双重优惠火热进行中!05-24
质粒纯化解决方案:五种方案灵活变通,毫厘层析“好帮手”带来质稳高效多样选择,总有一款适合您!05-24
【海能实验室】膳食纤维测定仪测定可溶性、不可溶性及总膳食纤维含量05-24
陕西、北京、天津、湖北……渠道商交流会再更新!05-24