Sci Adv | 最全阿尔茨海默病糖基化修饰谱揭示疾病新视角
2024-04-23 15:04:19 北京青莲百奥生物科技有限公司

阿尔茨海默病(Alzheimer''s disease,AD)是一种严重危害患者身心健康的慢性神经退行性疾病,其病理特征是大脑中β-淀粉样蛋白(Aβ)斑块和tau蛋白神经纤维缠结。许多研究表明,一些重要的AD相关蛋白如APP,Tau等会发生异常糖基化,尽管蛋白质糖基化对大脑健康很重要,但目前对人类大脑中糖蛋白质或糖基存在形式及其在AD中的改变相关知识仍然受限。
近日,埃默里大学医学院神经退行性疾病中心Qi Zhang研究团队在Science Advances(IF 13.6)上发表题为“Human brain glycoform coregulation network and glycan modification alterations in Alzheimer’s disease”研究论文。该研究建立了基于完整糖肽的定量糖基化蛋白质组学与网络生物学的整合,大规模、深入地分析人大脑中的糖型和位点特异性的N糖肽在AD中的变化。

【文章标题】Human brain glycoform coregulation network and glycan modification alterations in Alzheimer’s disease
【发表期刊】Science Advances
【影响因子】13.6
【发表时间】2024年4月5日
技术路线
样本类型:人脑组织,AD组和对照组(n=16)
组学手段:糖基化修饰蛋白组学
结果速递
一、AD组和对照组大脑的糖蛋白质组学景观
研究人员利用基于质谱的完整糖蛋白质组学平台,共鉴定出12176个N-糖肽匹配1184个N-糖蛋白,10731个N-糖型以及2544个N-糖基化位点上有164种不同的N-聚糖组成(图1A-D)。代表了迄今为止最大的人类AD大脑糖蛋白质组数据集,同时具有位点特异性的N聚糖和糖型信息。此外,与常规蛋白组学以及基于脱糖基化的糖蛋白质组学结果相比,完整糖蛋白组学方法实现了更广泛的糖蛋白、N-糖肽、糖基化位点以及糖型的覆盖(1E-G)。对N-聚糖进行分类,结果显示表明AD中整体唾液化程度降低(图1H-I)。糖蛋白质组学分析显示修饰每个糖肽的不同N-聚糖的数量在对照组和AD组中存在广泛的异质性(图1J)。

图1:AD组和对照组大脑的糖蛋白质组学景观
二、AD中位点特异性糖基化谱及N-聚糖分析
糖蛋白组学结果鉴定了一些全基因组关联研究(GWAS)识别的AD危险因素(如ABCA7,ACE,CLU等)的位点特异性N-聚糖和N-糖型(图2A)。其中AD相关蛋白的糖基化谱显示了大量的聚糖和糖型多样性,揭示了AD相关蛋白的N-聚糖修饰的异常与AD病理之间存在密切联系。

图2:AD中位点特异性糖基化谱及N-聚糖差异分析
进一步将N-聚糖结构分为七大类别:低聚甘露糖、低甘露糖型、壳聚糖核心、未经修饰的复杂型/杂合型(既无岩藻糖基化也无唾液酸化)、仅岩藻糖基化、仅唾液酸化和唾液酸岩藻糖基化聚糖。相对丰度分析显示低聚甘露糖蛋白质修饰在人脑中非常丰富(~相对丰度的49%)(图2B-D)。差异分析结果显示AD中46个修饰发生显著改变(图2E),聚类分析表明鉴定出的46个差异聚糖修饰可以很好区分AD病人和健康人。研究人员发现在AD中下调的聚糖修饰中约有83%是唾液酸化的,其中以高度支化和拉长的唾液化聚糖为主,而上调的聚糖修饰均未发生唾液酸化,说明唾液酸化和N-聚糖分支/伸长的减少与AD病理相关。
三、AD中差异变化的N-聚糖修饰相关蛋白糖型分析
研究人员对糖型丰度进行差异分析,AD组中鉴定出556个显著差异变化的糖型,进一步分析发现糖型丰度的变化大多是由位点特异性N-聚糖修饰水平的变化引起的,而不是由蛋白表达水平的改变引起。接下来,分析了179个糖型位点特异性的N-聚糖修饰和49个糖型缺失位点特异性的N-聚糖修饰,178个高糖基化蛋白516个高糖基化糖型以及来自71个低糖基化蛋白质的161个低糖基化糖型(图3A-C),发现高糖基化和低糖基化数据集都包含了低聚糖基化、寡聚糖基化、岩藻糖基化或唾液酸化改变的糖型和糖蛋白。功能分析结果显示多种不同类型的细胞功能受到AD中聚糖修饰改变的影响(图3D-F)。

图3:AD中位点特异性N-聚糖修饰改变的糖型和糖蛋白功能分析
四、WGCNA分析揭示了与AD病理相关的聚糖模块
为了深入了解人类大脑中的聚糖修饰以及在AD中的变化,研究人员利用加权基因共表达网络分析(WGCNA)构建一个聚糖网络,将人脑N-糖基化修饰组划分为8个模块(图4A)。确定了一个正相关的聚糖模块(GNM2)和两个负相关的聚糖模块(GNM1和GNM4)与AD状态、Aβ病理、神经原纤维缠结有显著关联(图4B)。其中GNM2模块在AD中糖基化修饰水平显著升高,GNM1和GNM4模块在AD中糖基化修饰水平显著降低(图4C)。
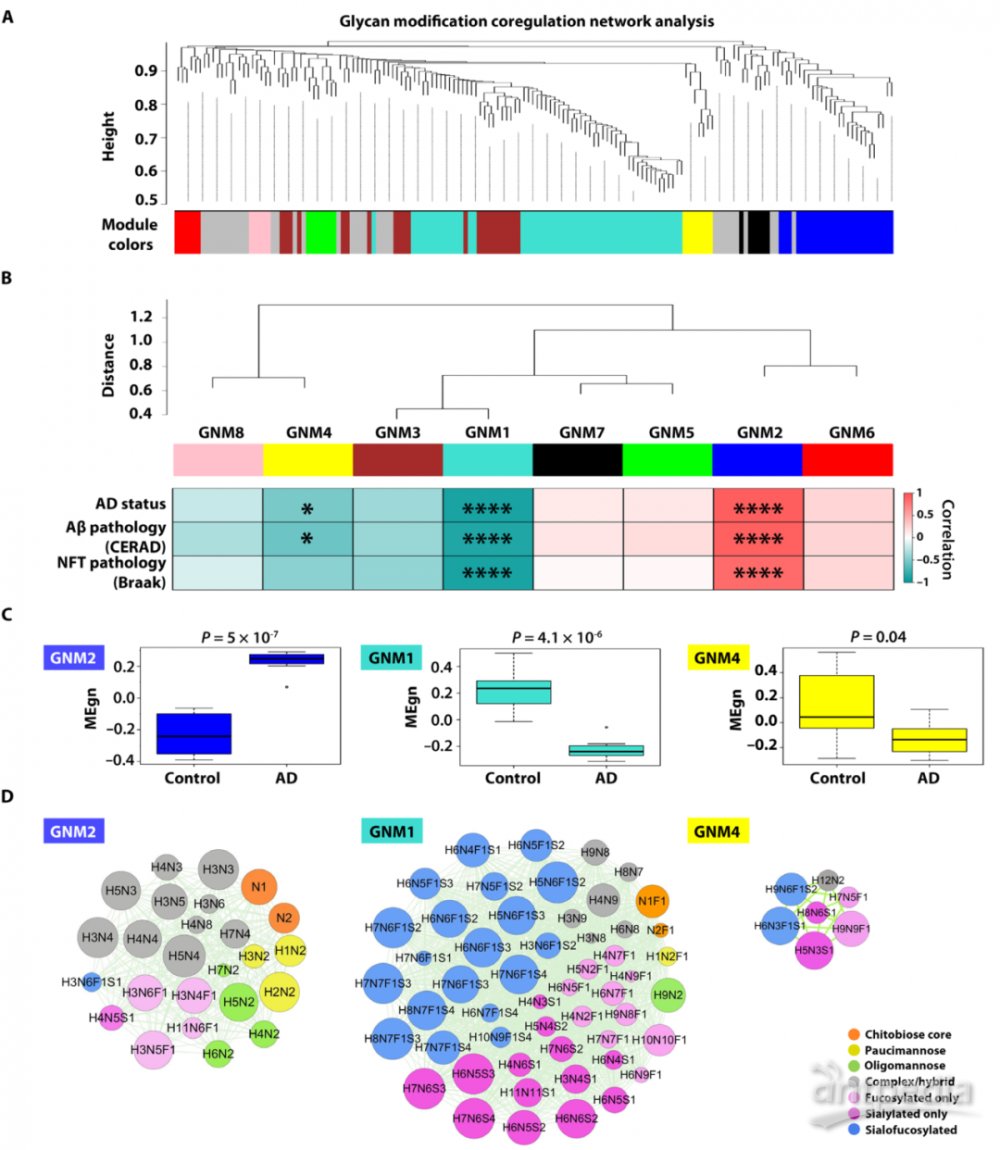
图4:聚糖修饰共调控网络分析和AD相关聚糖模块的鉴定
五、AD脑中糖基化修饰失调影响多个中枢神经系统
研究人员还使用WGCNA构建一个糖型网络,共确定了21个模块,其中7个模块与AD表型相关。功能分析显示7个与AD相关的模块都与细胞粘附过程中蛋白糖型过度表达显著相关,包括神经细胞粘附分子、突触细胞粘附分子等(图5D-F)。另一个显著特征是这7个模块与ECM组织和基质体功能、基质体蛋白的糖型富集相关。已有研究表明基质体蛋白在炎症反应中起着关键作用。此外,AD相关模块也包含其他炎症相关蛋白的糖型。总之,这些结果强调了这些糖蛋白的糖基化修饰改变与AD患者的神经炎症之间有着密切联系。

图5:AD相关糖型模块的功能分析
最后,研究人员结合已发表的AD大脑转录组数据、蛋白组数据进行多组学联合分析进一步评估了AD疾病中N-糖基化修饰酶和调节因子的变化。多组学分析的结果为N-糖基化机制失调在驱动糖蛋白质重塑和参与AD发病机制中提供了强有力的支持。
研究结论
本研究首次使用基于完整糖肽的定量糖基化蛋白质组学并结合共表达网络分析,提供人类大脑中N-糖蛋白和N-糖基化位点及其在AD中变化的系统全景图,是迄今为止最大的人脑糖蛋白质组数据集。揭示先前未知的因疾病特征改变糖型和位点特异性糖肽,在分子和系统水平上为理解和治疗AD提供了新的见解。
关注青莲百奥







04-26 赛默飞生命科学
【反射颜色测量】典型配置、硬件说明、软件操作04-26
【文末福利】东北人做实验,爆笑来袭!小嘴儿叭叭的~04-25 黑龙江办事处
直播预告 | 大规模设备更新-赛默飞生命科学专场直播04-25 赛默飞生命科学
【转载】「最佳的抗皱塑形运动方案」研究表明:这两类运动可有效延缓皮肤衰老,特别是对于女性!04-25 生物谷
【有奖征集】「寻找实验室最美身影」主题摄影大赛火热征稿中04-25
让你的干细胞研究“研”值飙升的秘密04-25 赛默飞生命科学
CIBF2024|H.E.L诚邀新老朋友莅临指导04-25 Don Lin
苏州佳谱科技有限公司参与制定国家标准,助力水泥窑固体废物处理技术规范发展04-25
DW行业解决方案|食品安全微生物实验室能力建设04-24 DW
全国排名公布!色谱大赛战况激烈,高手如云!04-24 市场宣传部
在众多可能中,找到你的“那一个”04-24 赛默飞生命科学
融合创新,质领未来—钢研纳克蝉联检测及科学仪器行业重磅奖项04-24 钢研纳克
4月24日直播 | 使用安捷伦Seahorse技术快速精准检测线粒体毒性04-24 安捷伦细胞分析
Nature 子刊|陆军军医大肿瘤微环境新成果,一作分享研究思路04-24 转载自生物学霸
4月25日直播 | 中国PIC/S成员资格对监管实验室的影响与含义04-24 安捷伦细胞分析
它来了,符合国家卫生行业标准的流式细胞仪性能校准服务!04-24 安捷伦科技
剑桥大学/阿斯利康利用RTCA揭示cGAS-STING 该明星分子在神经小胶质细胞炎症中的机制04-24 安捷伦细胞分析
4月26日直播 | 类器官研究大讲堂 开启精准医学新时代04-24 安捷伦细胞分析
追忆星空回响,坚守使命信念——中科科仪与“东方红一号”的峥嵘岁月04-24
