演讲精华丨一文get√原辅包登记要点及常见变更问题
2023-12-11 15:03:01, 生物医药市场部 1有限公司
近日,以“化学药品注册法规与实践”为题的NMPA高研院药品研究者网络大会顺利举行。微谱生物医药注册法规咨询总监李美玲老师受邀发表《原辅包登记要点及常见变更问题》专题演讲,线上近300家医药企业代表积极参会并热烈回应。本期推文,我们送上此次演讲的精华回顾。更多问题,欢迎文末留言。

👆NMPA高研院药品研究者网络大会

李美玲
微谱生物医药注册法规咨询总监
▋李美玲女士,从事药品研发、注册和管理类工作10多年,熟悉新药研发、FDA、欧盟注册法规以及国内注册相关法规及技术要求;2012年起从事新药研发工作,2017年兼顾仿制药研发工作,是国内较早一批从事新药研发的从业者;致力于药品全生命周期内各种创新药和仿制药的药学研究和注册事务,参与的部分新药项目已在国内外上市销售;并多次参与中国药监机构和美国检察官的项目交流和现场核查,助力多家企业的多个品种获FDA批准。
■
精华回顾
此次演讲围绕三个主题展开:一是在新“双法”下原辅包的监管特点,二是原辅包的登记要点,三是原辅包常见变更问题。
不管是过去单独审评审批,还是现在以及未来关联审评审批,生产药品所用的原料药、辅料和包材必须符合药用要求和药品生产监督管理规范的有关要求,这是核心要点。
1. 法规沿革
回顾法规的历史变化,我们能清晰看到原辅包监管趋势的变化。

👆法规沿革
2005年至2015年的监管是由省局主管部门发生产许可证和注册批件。2015年国务院发布《关于改革药品医疗器械审评审批制度的意见》,也就是国发2015 44号文,拉开了关联审评审批的序幕。
在这之后,值得关注的时间节点有,2016年总局发布134号文提出药包材药用辅料与药品关联审评审批。2017 146号公告,CDE建立原辅包登记平台,原辅包企业进行登记备案,5个工作日内完成形式审查就会在平台进行公示。2019 56号文提出了完善药品关联审评审批和监督工作有关事项。2019和2020年药品管理法和药品注册管理办法相继发布。中国的关联审批审批经历了不断演进的阶段。
经过2015计划、2016发布、2017调整、2019完善,最终2019和2020年在药品管理法和药品注册管理办法中分别落地实施,真正对关联审评审批做了详细的规定和要求。此后陆续有重要文件发布,如2020年中国药典、2021年《药品上市变更管理办法》等。
2.药品管理法对原辅包的要求

新版规定,在审批药品时,对相关辅料、直接接触药品的包装材料和容器一并审评,对化学原料药一并审评审批。需要强调的是,无论是以前还是现在的注册管理办法,原辅包的合法来源、生产工艺、质量标准和检验方法的研究资料,这个核心点是没有变的。
从2007年到2020年的药品注册管理办法,中间陆续出台了一系列公告。通过不断优化调整,最终实现了今天的药品注册管理办法中的原辅包的关联审评审批制度。

1.原料药

关于原料药登记备案,按照现行ICHM4的要求进行。
2.药用辅料

关于辅料的登记要点,需要说明三点:
1
高风险辅料,如动物源或人源的药用辅料、用于注射剂、眼用制剂、吸入制剂等,对高风险药用辅料的登记资料要求,可根据辅料在特定制剂中的应用以及相应的技术要求提供,也可以在审评过程中根据特定制剂及辅料在制剂中的应用情况根据需要补充资料。
2
对于已有使用历史的辅料超出相应给药途径的历史最大使用量,还要提供相关安全性数据等资料。
3
对预混辅料,要根据他在制剂中的应用及配方组成中各辅料成分情况,选择合适的资料要求进行登记。
3.药包材

高风险的包材包括三类:1,吸入制剂、注射剂、眼用制剂的药包材;2,国家药品监督管理局根据监测数据特别要求监管的药包材;3,新材料、新结构、新用途的药包材。
国家鼓励按照包装系统进行登记,如因为技术原因不能按照完整的包装系统登记,也可按照包装组件进行登记。
近两年发布了很多配套变更指导原则,有关境内境外不同原料药的变更方式和路径和境内境外辅料包材的变更情形,这些都有相关的管理规定。
首先,从分类来讲,有技术类和非技术类变更的分类,又可在不同变更事项下,按照风险等级分为微小、中等和重大变更。对微小、中等和重大变更,相应要求的研究工作也有差异,尤其对于重大变更有非常严格的要求。

1. 原料药

对原料药变更研究分微小中等和重大三个维度。
1
微小变更说明变更的具体情况和原因,对变更后的工艺进行研究/验证研究,提供1批样品检验,并在年报中体现首批样品长期稳定性考察情况;
2
中等变更来讲,工艺研究和验证,无菌/灭菌工艺验证,需要1批批生产记录、质量对比研究,1-3批样品检验,同时申请时不少于3个月稳定性研究资料,1批加速/长期稳定性研究;
3
重大变更:工艺研究和验证,无菌/灭菌工艺验证;对影响产品结构的变更需提供结构确证;需要1批批生产记录和质量对比研究;连续3批样品检验;申请时,需要3-6个月稳定性研究资料,3批加速/长期稳定性研究;
2. 药用辅料
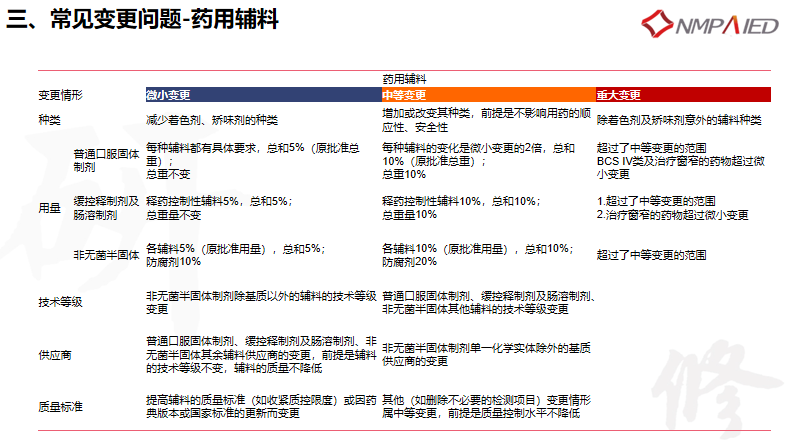
药用辅料变更较为复杂。普通口服固体制剂、缓控释制剂及肠溶制剂、非无菌半固体等不同剂型分别有不同的变更说明。

对于辅料变更要研究的工作,也做了归纳总结:
1
微小变更:需要针对变更进行相应研究;提供1批检验报告;可能影响溶出行为的辅料供应商的变更(SDS、吐温80、缓控释材料等)需进行溶出曲线对比研究;在在年报中提供首批的长期稳定性数据。
2
中等变更:需要针对变更进行相应研究;提供批生产记录;1-3批检验报告;对比变更前后样品的溶出曲线、杂质谱、关键理化性质等,应保持一致,符合指导原则;在稳定考察中1批加速和长期3个月稳定性数据,与变更前进行对比。
3
重大变更:需要针对变更进行相应研究;提供批生产记录;连续3批检验报告;对比变更前后样品的溶出曲线、杂质谱、关键理化性质等,符合指导原则;3批加速,长期3-6个月稳定性数据,并与变更前对比;对于重大变更,如申请免除生物等效性研究,需要提供充分的依据。
3. 药包材
药包材变更研究主要涉及工艺研究验证、质量对比研究、检验报告和稳定性考察等方面。

1
对于微小变更,主要涉及变更前后包装相关特性的质量对比研究;1批检验报告;在年报中提供首批长期稳定性考察研究;
2
中等变更涉及包装工艺验证,无菌/灭菌工艺验证;质量对比研究涉及三点:1).变更前后包装材料和容器相关特性的对比研究,2).包材的等同性/可替代性研究,3).包材相容性、密封性研究;1-3批检验报告和1批加速和长期稳定性考察研究;
3
重大变更涉及包装工艺验证,无菌/灭菌工艺验证;质量对比研究涉及1).变更前后包装材料和容器相关特性的对比研究2).包材的等同性/可替代性研究3).包材相容性、密封性研究。给药剂量的准确性研究;连续3批检验报告;3批加速和长期3-6个月稳定性考察研究;
在关联审评审批制度下,原辅包变更势必会影响制剂。

问答环节
随后的问答环节,吸引了众多在线行业伙伴们的积极关注与热烈互动。在此,我们为大家分享其中几个问题:
Q
变更涉及多规格问题,是否要对每个规格进行研究?
A
建议参照ICHQ12要求,分情况进行,第一种情况,同品种多规格产品 若处方等比,可选择有代表性规格进行研究,要提供选择的依据。
第二种情况,若辅料比例不一致,对每个规格进行研究;或者进行充分分析与风险评估,基于评估结果选择有代表性的规格进行研究。
Q
变更涉及多种内包材问题,是否对每种内包材进行研究?
A
同品种多包材的产品,要对每种包材进行研究。
如果仅对一种包材进行研究,提供充分的分析和风险评估资料,证明研究的包材具有代表性。
无法评估的,需要明确包材种类,限定特定包材。
Q
原料药的变更如何办理?
A
第一,已通过审评审批的,可以按照相关规定确定变更管理类别,经批准备案后实施报告,并及时更新登记信息。
第二,未通过审评审批、未进入审评程序的,可通过官网平台随时更新相关资料。
Q
审批类和备案类关联的变更同时发生时,如何申报?
A
第一, 同时发生可合并报药审中心进行技术审评;
第二, 也可先将审批类报药审中心,通过后,备案类报省局或药审中心。
Q
关于管理类别?
A
第一,有明确规定的,按规定执行;
第二,没有明确规定,企业自己可以确定的;
第三,没有明确规定,企业自己也无法确定的,第一步先和省局沟通;无法达成共识的,向药审中心提出申请;对于备案类和报告类的异议,按照备案类执行;
第四,对于降低管理类别的,需要和省局协商一致,否则不允许降低。
国家药品监督管理局高级研修学院
国家药品监督管理局高级研修学院是国家药品监督管理局直属事业单位、唯一的教育培训机构,是药监系统唯一以社会科学研究为主的博士后科研工作站,唯一的国家级药品安全应急演练中心。
作为国家级教育培训机构,学院构建了集专家讲座、基地实训、情景模拟等多形式的线上线下立体化培训体系,为我国药品、疫苗、医疗器械等从业者开展体系化培训。此外,学院还积极开展国际合作,引进美国药品检查员网络培训课程,供国内检查员学习借鉴。
△ 来自国家药品监督管理局高级研修学院官网
关于微谱
微谱,大型研究型检测机构,是科技服务改变世界的践行者。凭借长期服务于先进制造、生物医药、美丽健康、生态环保、食品及农产品五大产业链所沉淀的行业技术解决方案,坚持以市场需求为导向,满足用户在研发创新、质量升级、节能减排、工艺改善、调查分析、质量鉴定、计量校准、体系或产品认证等多层面的个性化综合性科技服务需求;通过众多自主研发的分析检测测试方法,助力客户获取更大成功。微谱始终秉承“服务,不止于检测!”的理念,尽心尽力让科技进步更快,让产品质量更好,让人类生活更安全、更健康、更绿色!

轻松一点,赞和在看都在这儿!
05-22
应用案例|食品中苯甲酸、山梨酸和糖精钠的测定05-21
新闻动态丨天美公司参加生物医学工程前沿交叉论坛05-21
【精彩回顾】丹纳赫生命科学与Cytiva携手,共同亮相第二十三届中国生物制品大会05-21
微小器官的宏大未来——类器官技术在临床研究和医学应用转化中的更多可能05-21
新突破!HPLC分析mRNA聚集体新方法: 大孔径SEC05-21 艾杰尔飞诺美
人物专访 | 北京邮电大学刘玉敏老师,畅谈半导体微纳结构05-21 光电行业都会关注
我们了解生命孕育的不易,我们深知母亲的伟大丨《科学吱(zi)声儿》拜访母胎医学研究团队05-21 安捷伦
新闻动态丨继往开来 聚力共赢,赛里安色谱产品渠道招商会在郑州、济南和青岛成功召开05-21 天美色谱
展会回顾|指尖上的仪器“福州”人生初见暨广州市仪器行业协会福州行05-21 Criron——谱临晟
报名通知 | 2024一带一路暨金砖国家技能发展与技术创新大赛—首届食品药品质量安全与检测技术赛项05-21 MAPADA
仪器优势丨CP8400自动进样器在脂肪酸甲酯双通道测试中的优势05-21 天美色谱
Cytiva与丹纳赫生命科学携手亮相第二十三届中国生物制品大会05-20
【会议邀请】微纯生物科技邀您参加“CIS-Asia 2024 第十六届百世化学制药国际大会暨展览会”05-20
热点应用丨prepASH在饲料领域的应用05-20 天美
热点应用丨如何实现饲料快检——prepASH全自动水分灰分分析仪05-20 天美
热点应用丨药品快检好帮手之中药分析——prepASH全自动水分灰分分析仪05-20
热点应用丨prepASH在食品领域的应用——灰分检测05-20 天美
热点应用丨prepASH在食品领域的应用——水分检测05-20 天美
名家专栏 | 量子理论系列—量子理论的产生与发展05-20 光电行业都会关注