技术分享丨一文厘清生物制品物料质量控制要点
2023-12-11 15:03:01, 生物医药市场部 1有限公司
摘要
summary
当下,基因工程、细胞工程等生物制药愈加受到社会各界的关注,受起始物料、生产工艺及灭菌条件的限制,生物制品的安全性和有效性需要严格把关,这对药企在生物制品的物料检测上提出了更高的要求。
本期#微谱药研院 · 技术共探,与您共同探讨生物制品物料质量控制的重点与难点。
一、生物制品的定义和物料分类
生物制品是用基因工程、细胞工程或发酵工程等生物学技术制成的免疫制剂或有生物活性的制剂,由生物来源(即活细胞或生物体)的原料生产或提取,包含一种或多种活性物质,可以用于诊断、预防和治疗疾病。按照来源可将生物制品生产用原材料分为两大类:
一类为生产过程使用较多的生物源材料,主要包括来源于微生物,动物和人的细胞、组织、体液成分,以及采用重组技术或生物合成技术生产的生物原材料等;
另一类为化学原材料,包括无机和有机化学材料。
常见的原材料主要包括四大类:
1
原料血浆、动物(马、猪、兔)免疫血清、单抗生产用小鼠腹水、细胞基质、菌毒种;
2
用于细胞、病毒、细菌培养的培养基成分;
3
用于提取或纯化的化学、生物材料等;
4
灭活剂、脱毒剂。
辅料指生物制品在配制过程中所使用的辅助材料,如佐剂、稳定剂、赋形剂等。
二、生物制品物料分类和质量控制
与小分子药物不同,生物制品由微生物、动物或人源组织的细胞和体液等生物活性材料加工制成。因为生产过程中使用的各种材料来源复杂,生产工艺复杂且易受到多种因素影响,所以可能引入外源因子或毒性化学材料,再加上制剂成分复杂且一般不能进行终端灭菌,仅靠中控、原液和成品的检定质量控制难以保证其安全性和有效性。因此,对生物制品生产用原材料和辅料进行严格的安全质量控制,是降低外源因子或有毒杂质污染风险、保证生物制品安全有效的必要措施。

针对生物制品原辅材料在生产应用中的安全性控制,国内外药典及法规明确要求原辅材料的工厂控制过程,包括供应商管理、原辅料全生命周期管理、杂质引入的评估和一次性使用系统的质量控制。通过以上控制过程减少由物料和工艺引入的生物污染风险,保证生物制品生产的安全性,实现生物制品原辅材料在生产应用中的闭环监控。
在生产的各阶段中
原辅材料安全性方面的缺陷主要集中在产品中原辅材料的处方信息、辅料投料量、原辅材料间相容性以及成分安全性等几个方面。另外,生产中所用的外部采购关键原材料的供应商审计及质量标准建立也存在缺陷。
在生物药注册阶段
常见缺陷为申报资料不充分或不完善,尤其是生产用原材料质量控制和安全性风险评估的资料缺漏,如未明确生产过程中所用的动物源性材料并评估其安全性风险,包括引入外源因子的风险。
所以,无论是商业化生产还是注册阶段,原辅材料的变更评估以及变更研究都备受关注。
三、生物制品物料质量控制的法规要求
中国2010版GMP对生物制品生产的各个环节都有明确的控制要求,中国药典2020年版:三部《生物制品生产用原材料及辅料质量控制》列出了关于不同风险等级生物制品生产用原材料和辅料的质量控制要求。因此,生物制品生产过程中,外源因子(包括外源病毒和其他微生物)污染所导致的产品安全性风险是需要重点考虑的质量控制要求。
根据风险级别可以将生物制品生产用原材料和辅料各分为四级,不同风险等级生物制品生产用原材料和辅料至少应进行的质量控制要求分别见表1和表2。
表1 不同风险等级生物制品生产用原材料的质量控制要求
(上下滑动查看详情)
表2 不同风险等级生物制品生产用辅料的质量控制要求
(上下滑动查看详情)
尽管中国药典对常用的生物源性原材料已有明确的规定,但整体而言,目前尚无全面、系统的要求。欧美药典对于生物制品原辅材料的相关规定对完善中国生物制品原辅材料质量控制有一定的参考意义,各国药典规定不同又可相互借鉴,应根据申报要求选择性满足。
企业应确定不同类别的材料用于生物制品产品生产中所需采取的降低风险的控制措施,包括对来源的控制、供应商的审核和评估,更重要的是确定需要检测的项目并满足药品申报要求,同时若使用高风险材料,还要证明在产品生产过程中该材料的去处和残留物对终产品安全性、有效性及稳定性影响的评估。
四、生物制品物料的检测重点
外源因子污染会引起严重的产品安全性风险,是需要重点考虑的质量控制要求,这就需要在生产过程中对原辅料的质量进行检测,常见的检测项目主要包括外源病毒因子和微生物两类。
外源病毒因子的检测是生物制品需要关注的重点,涉及生物制品的生产全过程,包括生产用原辅料、细胞基质、细胞库到生产过程控制和工艺验证。
对于采用人源或动物源性材料的生物制品
需要对细胞系和细胞库进行全面的外源性因子检定,包括体外不同指示细胞接种法检测和动物体内接种法检测等方式。
针对细胞制品
在建立或传代过程中使用的胰酶和血清培养基等原材料,需要对物料生产过程中可能引入的外源性病毒进行评估,进行物料来源动物相关的病毒检测,例如采用牛源血清时需要对可能引入的牛源病毒进行检测(图1和2);采用胰酶(猪源)也需要对可能引入的猪源病毒进行检测。对于病毒的种类各国药典都有明确规定,且有差异,应根据具体申报方向进行选择。
图1 牛源病毒检查—荧光抗体法

图2 牛源病毒检查—血吸附法
对于特定啮齿类细胞(如CHO,BHK21,NS0和Sp2/0)
对于特定啮齿类细胞(如CHO,BHK21,NS0和Sp2/0),还应确定其未加工收获液中病毒颗粒的量及其是否具有感染性逆转录病毒(图3);病毒清除研究中,应关注选择合适的模型病毒,采用缩小规模的工艺模型进行病毒灭活/清除验证,并证明缩小模型可代表商业化规模工艺;试验样品应具有代表性,并明确能有效去除或灭活病毒的生产步骤;结合未加工收获液中病毒检测结果和整个工艺的病毒去除/灭活能力,综合评价终产品的安全性。
图3 逆转录病毒检查 — 共培养法
物料微生物污染是影响生物制品质量的另一重要因素,中国药典3301和美国药典63、71章节,对生物制品涉及的微生物检测项目进行了规定,包括细菌、真菌、支原体等项目,支原体检查可以通过指示细胞培养法(图4和5)进行检测,也可使用经验证的核酸检测法进行测试。

图4 支原体检测 — 指示细胞培养法
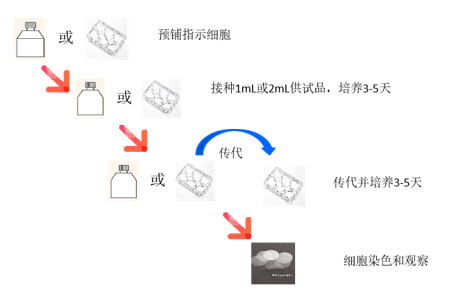
图5 指示细胞培养法流程
五、微谱生物安全研究平台

在生物安全研究领域,微谱拥有近2000㎡的BSL-2级生物安全实验室,并通过ISO 9001 质量管理体系、CMA+CNAS资质三重认定。结合专业的仪器配备,国际化的专业团队与合规的管理体系与规范,微谱生物安全研究服务为生物技术产品提供质量与安全控制整体解决方案,并可提供符合中美欧双申报的验证报告。
在细胞库检定方面,我们可以为客户提供周全且专业的细胞系检定服务,包含支原体、无菌、内毒素、逆转录病毒、电镜、逆转录酶、共培养、体内检测(鸡胚)、同工酶、猪源、牛源病毒检测等。
在病毒清除验证方面,我们以多元且精准的定制化服务,解答客户疑问,解决产品难题。我们的病毒清除验证研究服务可为药品提供整体安全性证明。同时,微谱实验室缩小模型可去除/灭活外来因子以验证下游纯化过程,并提供有效的病毒清除平台设计服务。
【参考文献】
[1] European Medicines Agency; European Commission. Biosimilars in the EU: information guide for health care professionals. http://www.ema.europa.eu/docs/en_GB/document_library/Leaflet/2017/05/WC500226648.pdf. Accessed 28 Sep 2017.
[2] Ingrasciotta, Ylenia et al. “Safety of Biologics, Including Biosimilars: Perspectives on Current Status and Future Direction.” Drug safety vol. 41,11 (2018): 1013-1022.
[3] US Food and Drug Administration. Biological product definitions. https://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/TherapeuticBiologicApplications/Biosimilars/UCM581282.pdf. Accessed 6 Nov 2017.
[4] 郭中平, 谢贵林. 生物制品原辅料及其质量控制[J]. 微生物学免疫学进展, 2012, 40(1):5.
[5] 中国药典2020 年版,生物制品生产用原材料及辅料质量控制
[6] 中华人民共和国药品管理法,2019
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱