抗击肿瘤的又一突破口:血源DC疫苗——CliniMACS Prodigy 助“旎”一臂之力
2023-05-30 16:16:18, MBCN 德国美天旎生物技术公司
在过去十年里,众多基于DC细胞作为疫苗接种完成的临床研究中,大多使用了易于操作且具有良好特异性的单核细胞衍生DC(Mo-DC)。也在一些患者中观察到了有效的抗肿瘤反应,证明了此方案的安全性并且具有很大的临床潜力。临床研究表明,DC疫苗不仅能诱发针对原发肿瘤的免疫应答,而且也能诱发针对转移肿瘤的免疫应答,并且CD4+,CD8+淋巴细胞和自然杀伤细胞(NK)都参与了抗肿瘤免疫应答1。
另一个更为方便的DC来源无外乎直接从外周血中通过一些特定的细胞表面标志物将存在于血液中的DC分选出来。
髓系又或常规DC(cDC)和浆细胞样DC(pDC)作为存在于外周血中的DC细胞,可识别不同种类的抗原刺激并产生独立的反应。

cDC在表型和功能上和Mo-Dc相似。从患者血液中富集的cDC细胞,其诱导抗肿瘤T细胞的能力在对于黑色素瘤和前列腺癌的临床研究中取得了良好的效果。
而pDC则能产生大量的I型干扰素,从而增强先天和过继性免疫力以响应toll-like或其他受体配体的刺激。
在近期的一些报告中表明,同时激活不同的DC亚群,可增强其协作抗肿瘤反应。
一项针对黑色素瘤患者的临床I/II期研究,表明了使用通过加载肿瘤衍生抗原激活的pDC或cDC 进行接种后具有显著的临床效果2,3,4。pDC和cDC的联合使用被认为是强大有效的抗肿瘤治疗的关键5。随着抗癌药物的日益普及,基于DC方案在新型联合疗法中的应用也以迅速升级。

基于美天旎CliniMACS Prodigy平台的CliniMACS Prodigy BloodDC PreDepletion系统和CliniMACS Prodigy BloodDC Enrichment and Culture系统用于从非动员外周血制品中富集三类DC亚群(CD141+,CD1C+和CD304+)。
BloodDC PreDepletion系统用于预先去除CD19+和CD14+的细胞,并同时用带生物素的抗体标记CD1c+细胞。接下来CliniMACS Prodigy BloodDC Enrichment and Culture系统可实现对血源DC亚群的富集以及刺激和抗原加载。
BloodDC系统的组合提供:
强大且稳定的对所有原代DC细胞亚群进行富集
用于刺激和抗原加载的全自动的灵活培养选项

图1:CliniMACS Prodigy BloodDC系统流程
✦ +
+
CliniMACS Prodigy平台
全自动,标准化的细胞制备平台
CliniMACS Prodigy作为最新一代全自动化细胞处理平台的代表,细胞分选到细胞培养、以及细胞终产品的制剂完美的整合在一台设备上,并且符合GMP生产管理规范:
全自动化细胞制备
整合离心机
基于MACS技术的细胞分选
细胞培养
感应器全程监控
功能性封闭系统,降低对于洁净间的要求
通过CliniMACS Prodigy BloodDC系统获得的血源DC,能有效的激活抗原特异性T细胞(图2)。同样,通过CliniMACS Prodigy BloodDC系统获得的cDC和pDC进行疫苗接种,可诱导去势抵抗性前列腺癌患者针对肿瘤的功能性抗原特异性T细胞应答。
表1:血源DC富集参数。使用CliniMACS Prodigy BloodDC PreDepletion系统和CliniMACS Prodigy BloodDC Enrichment and Culture系统富集血源DC,使用MACSQuant Analyzer 10流式细胞仪进行分析得到的纯度和回收率。纯度和回收率的计算基于pDC和cDC的总量(n=10).
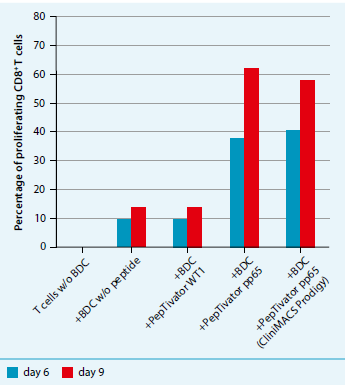
图2:CliniMACS Prodigy BloodDC系统获得的血源DC细胞,可在体外有效的激活抗原特异性CD8+T细胞。
程序运行所需主要产品*
*具体产品请咨询美天旎相关销售
文献参考:
1. Bakdash, G. et al. (2014) Crosstalk between dendritic cell subsets and implications for dendritic cell-based anticancer immunotherapy. Expert Rev. Clin. Immunol. 10: 915–26.
2. Schreibelt, G. et al. (2016) Effective clinical responses in metastatic melanoma patients after vaccination with primary myeloid dendritic cells. Clin. Cancer Res. 9: 2155–2166.
3. Tel, J. et al. (2016) Preclinical exploration of combining plasmacytoid and myeloid dendritic cell vaccination with BRAF inhibition. J. Transl. Med. 14: 88.
4. Tel, J. et al. (2010) The potency of human plasmacytoid dendritic cells to induce immune responses in melanoma patients. DC2010: Forum on Vaccine Science 11th International Symposium on Dendritic Cell in Fundamental and Clinical Immunology.
5. Westdorp, H. et al. (2019) Blood-derived dendritic cell vaccinations induce immune responses that correlate with clinical outcome in patients with chemo-naive castration-resistant prostate cancer. J. Immunother. Cancer 7: 302.
原创作者 | Josh Wang
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱