抗体验证——拯救“重现性危机”
2023-05-03 13:15:37, MBCN 德国美天旎生物技术公司
近年来,生物学界对实验的可重复性关注度越来越高。这在许多出版物和文章中都得到了体现1-4,而抗体被认为是结果不一致的关键原因之一。据估计,全球每年约有8亿美元浪费在未经充分验证的抗体上。



美天旎如何解决对重现性和抗体验证的需求?
作为抗体生产商,美天旎非常重视这一主题,30年来一直致力于提供可信赖的高质量抗体。无论抗体是用于我们领先市场的MACS®细胞磁分选技术,还是流式细胞应用,都采用严格的生产和质量控制标准,以确保产品稳定可靠。
随着2012年REAfinity™重组抗体的面世,我们在提高REAfinity重组抗体的质量和一致性方面进行了重大投入,优化的抗体序列、突变改造的Fc区域、从DNA序列开始的标准化抗体生产流程以及批次间质量控制,可确保抗体的高纯度和批次间一致性。而抗体验证作为抗体生产的最后一步,也最靠近抗体实际应用场景,对于保证抗体的质量、使用效果以及实验的可重复性至关重要。这些优势使REAfinity抗体成为提高实验可重复性的理想工具。
抗体验证的三大支柱:
重现性、特异性和敏感性

抗体重现性和一致性

纯度分析
REAfinity抗体源于一段只编码一种重链和轻链的DNA序列,从而确保抗体的高纯度。
对纯化得到的REAfinity抗体进行质谱分析,数据表明:REAfinity抗体纯度非常高,而杂交瘤来源的抗体是一种混合物。
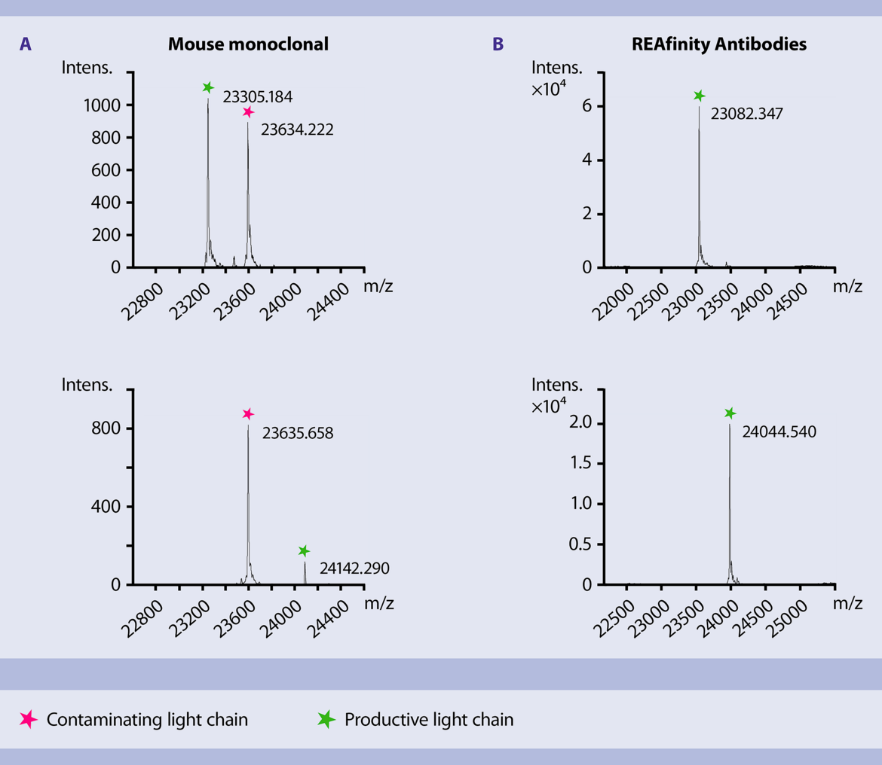
A. 对两个杂交瘤来源的单克隆抗体样本进行质谱分析,可以看出,它们都含有一条分子量接近23,635 Da的污染轻链。B. 两个REAfinity重组抗体样本的质谱分析结果显示,其含有极高纯度的轻链。
批次稳定
此外,在抗体原料生产以及荧光色素结合过程中,对所有抗体进行了批次间一致性测试。
这包括从混合物中除去未结合的荧光染料和抗体的纯化步骤,以及与先前批次的并排比较。
不同批次的REAfinity抗体染色结果几乎一致。用两个批次的5个CD56 REAfinity类抗体,对同一供者来源的PBMC进行染色,然后用MACSQuant 流式细胞仪检测。直方图中的两条曲线(黑色和红色)代表了两个不同批号的抗体,数据显示,不同批次的REAfinity 抗体的染色结果几乎一致,从而证明其批次间稳定性极高。

抗体特异性

为了验证REAfinity抗体与其靶抗原结合的特异性,我们引入了以下几种方法来验证抗体。
表位竞争测定
为了比较抗体的表位特异性,将细胞与过量的未标记荧光的REAfinity抗体孵育,然后用其他已知克隆的抗同一标记物的荧光标记的抗体染色。基于获得的荧光信号,将克隆分为三类,表位完全重叠(++)、部分重叠(+)或完全不同的表位(-),下表中列出了REAfinity克隆CD56(REA196)的测定结果。
敲除验证
在合适的细胞系中,用位点特异性核酸酶敲除靶基因,并对靶基因座进行测序以确认敲除。
用荧光显微镜以及流式细胞术分析样本,如果无法检测到与敲除细胞结合的抗体,则表明该抗体与预期的表位特异性结合。
CD53敲除细胞的荧光显微镜图像。 野生型(WT,左)和敲除细胞(KO;右)用CD53-PE(REA259,红色)染色,并用DRAQ5(蓝色)作为DNA染色剂。
CD53敲除细胞的流式细胞分析。 排除重复和死细胞后,用CD53-APC(REA259)对野生型(红色)和基因敲除细胞(蓝色)进行染色,并使用MACSQuant Analyzer 10通过流式细胞仪进行分析。
RNAi敲低
使用RNA干扰(RNAi)敲低靶抗原。用非编码RNA寡核苷酸转染细胞,来抑制靶RNA的翻译。
转染的细胞与未转染对照细胞之间的对比,表明了被测抗体对其抗原的特异性。
RNAi敲低靶抗原。左峰表示用AKT1 RNAi转染的HeLa细胞,右峰是未转染的对照。将细胞固定、透性化,并用抗AKT1抗体-荧光染料结合物进行染色。使用MACSQuant Analyzer 10进行流式细胞术分析。
抗体敏感性

抗体的敏感性,对于能够可靠地鉴定靶细胞至关重要。我们采用以下方法来确保抗体的敏感性。
产品发布前功能测试
所有荧光标记的抗体,包括同一克隆的多个荧光标记物,都会在实际样品上进行测试,并尽可能在多色通道中测试抗体。
另外,对源自组织的细胞,常规地使用酶处理,这样能够验证抗体对经过酶促处理的表位的敏感性。
性能比较
我们通常将美天旎的偶联抗体与其他供应商的偶联抗体的性能进行比较,以确保在流式细胞仪应用中具有更好或至少相似的性能。
每批产品均通过一系列滴度梯度验证,以确保产品在滴度范围内的有效性。
REAfinity重组抗体具有高染色指数。用来源于杂交瘤细胞和REAfinity克隆REA196的CD56抗体,对人PBMC进行染色。使用了抗体供应商的推荐滴度。
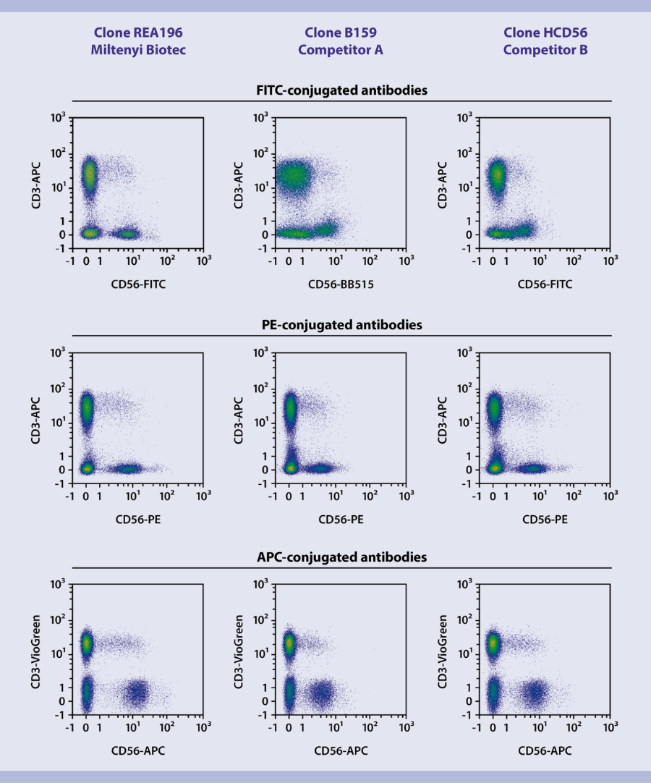
克隆REA196的对比数据。用REAfinity克隆REA196的CD56抗体和其他品牌的CD56抗体,对人PBMC进行染色,并用MACSQuant Analyzer 10进行分析。
固定试剂兼容性
我们的抗体在固定过程中也经过了稳定性测试。该测试验证了细胞固定后仍然可以检测到抗原的表位。固定试剂的兼容性信息可在说明书中找到。
参考文献:
1. Goodman, S.L. (2018) The antibody horror show: an introductory guide for the perplexed.N Biotechnol. 45: 9-13.
2. Baker M., (2015) Reproducibility crisis: Blame it on the antibodies. Nature 521(7552): 274-6.
3. Bradbury A. and Plückthun A., (2015) Reproducibility: Standardize antibodies used in research. Nature 518(7537): 27-9.
4. Journals unite for reproducibility. (2014) Nature 515(7525): 7.
5. Bradbury A.R.M. et al., (2018) When monoclonal antibodies are not monospecific: Hybridomas frequently express additional functional variable regions. Mab 10(4): 539-546.
原创作者 | Yuanyuan Liu
06-06 Unimicro
Nature 发文! 如果有一天,线粒体也能被移植……06-06 小 M
实验操作 | 小白第一课!基础细胞培养方法及步骤06-06 小 M
科研助攻 | Nature Review:癌症治疗抗体药物最新综述06-06 小 M
端午礼遇 | 玩游戏,选周边,宠粉福利,只 "粽" 意 你~06-06 小 M
发货通知 | MCE 中国祝大家端午安康06-06 小 M
“岛津森林”项目06-05 医疗中心
浙江以检测赋能新质生产力06-05
2025版《中国药典》收官在即,变化要点有哪些?要注意哪些方面?06-05
吸附管采集固定污染源废气中的VOCs时的采样流量要求?06-05 检测家
内卷加剧,检测机构如何破局应对?06-05
【人民日报国际】在收获与播种交织的芒种中国时刻,张轶昊谈创新。06-05
德国元素耗材之星 | 固体压样器/液体封样器06-05
夏日焕新 谱写新章 | 德米特第四届“互动日”惊喜而至06-05
祝贺嫦娥六号月背采样成功 | 盘点标乐助力月球样品分析06-05
2024年德国元素巡检活动 | 第一站:成都站!免费申请06-04
会议通知|第一届小动物活体成像技术前沿与应用网络研讨会06-04
蛋白质组学从发现组学跃入临床怀抱的跨越之旅06-04
内毒素检测的思考 - 采用药典方法同时减少鲎试剂的使用06-04 Sievers分析仪
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-04