新版欧盟GMP无菌附录1的变化- PUPSIT及应用
2023-02-13 10:08:16, 默克工艺解决方案 Merck工艺解决方案
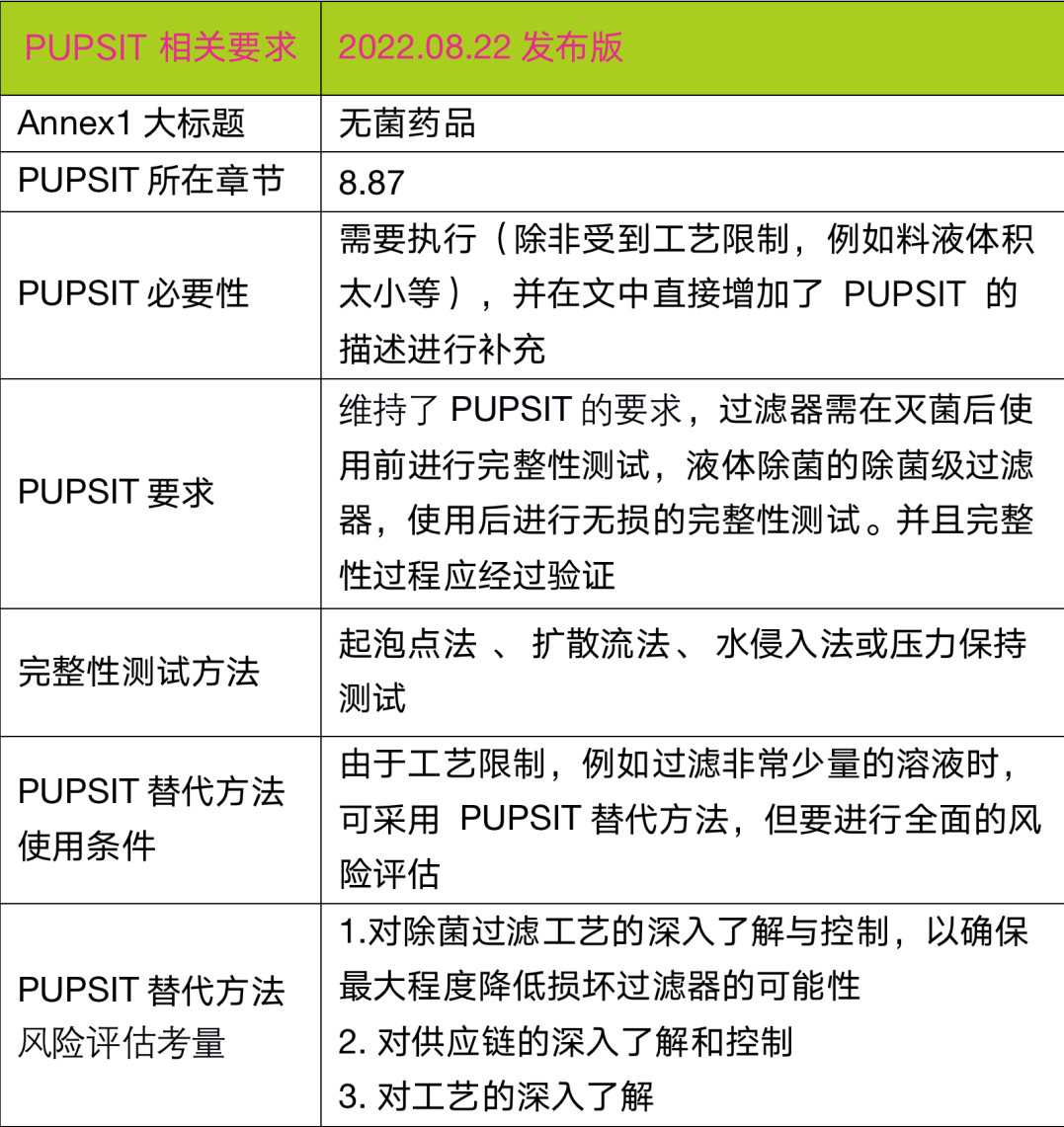
2022年8月25日,欧盟(EU)发布新版药品生产管理规范(GMP)附录1《无菌药品生产》指南的终版文件,文件要求此指南最后实施期限是2023年8月25日,指南中的第 8.123条的最后实施期限为2024年8月25日。
《无菌药品生产》作为欧盟成员国所有制药企业必须遵循的法定规范,起草专家除欧盟(EU)外,还拥有世界卫生组织(WHO)以及国际药品认证合作组织(PIC/S)两大国际高影响力组织专家的共同参与。文件的正式发布代表着国际多方统一认可的高标准无菌药品生产要求,同时意味着全球无菌药品生产商将会进入一个紧锣密鼓实施新版无菌附录要求的阶段。随着中国国家药品监督管理局(NMPA)申请加入PIC/S进程的推动,新版指南对中国制药行业尤其是生物制药行业也将带来可见的影响,如制药质量体系提升(包括无菌保证体系的完善、污染控制体系的建立等)以及硬件设施的改造等。
相较于2008版欧盟GMP无菌附录,这份指南有了很多变化:
➢ 对指南的适用范围进行了延展
涵盖多种无菌产品类型(原料药,辅料,内包装材料和成品制剂)。
➢ 增加了新的独立章节
如公用系统部分的水系统、灭菌用蒸汽系统等;生产和具体生产技术部分的成型-灌装-密封、吹灌封、冻干、密闭系统、一次性系统(SUS)等。
➢ 引入质量风险管理
要求无菌药品生产商将风险管理理念与无菌产品的生产过程更好地结合。
➢ 强调了制药质量体系适用于无菌产品时的具体要求
生产商的药品质量体系(PQS)应涵盖并符合无菌产品生产的特定要求,并确保所有活动得到有效控制,以尽可能降低无菌产品中的微生物、微粒和内毒素/热原污染风险。
➢ 更加强调无菌保证
比如没有隔离装置的冻干机手动进出料系统每次操作前应进行灭菌,除菌滤器在使用前灭菌后进行完整性测试(PUPSIT),一次性技术的应用、限制进入隔离系统(RABS)和密闭系统的应用、自动化系统和机器人系统的应用、快速/替代方法和连续监测系统的应用、对无菌工艺和终端灭菌工艺采用方法的指导、对如冻干和成型-灌装-密封技术的指导、无菌工艺模拟(APS)的指导等。
➢ 新增污染控制策略
污染控制策略(CCS)应在整个设施内实施,从而明确所有关键控制点,并评估所有用于管理药品质量和安全风险的控制措施(设计,程序性、技术性和组织性措施)和监测措施的有效性。
➢ 新技术的应用
如密闭技术(包括屏障技术)、自动化系统、机器人系统、快速检测技术、连续监测系统等。
这期小编和大家看看国内外一直广受关注的除菌滤器灭菌后使用前完整性测试(PUPSIT)部分, PUPSIT在2020版欧盟 GMP 附录1第十二版草案中引起了广泛的关注及讨论,在此次新版文件中仍然被保留了下来,指南要求需要执行PUPSIT(除非受到工艺限制,例如料液体积非常小),以下是新版指南和V12草案关于PUPSIT两段原文描述:
2020V.12:The integrity of the sterilized filter assembly should be verified by integrity testing before use, to check for damage and loss of integrity caused by the filter preparation prior to use. A sterilizing grade filter that is used to sterilize a fluid should be subject to a non-destructive integrity test post-use prior to removal of the filter from its housing. Test results should correlate to the microbial retention capability of the filter established during validation. Examples of tests that are used include bubble point, diffusive flow, water intrusion or pressure hold test. It is recognized that pre-use post sterilization integrity testing (PUPSIT) may not always be possible after sterilization due to process constraints (e.g. the filtration of very small volumes of solution). In these cases, an alternative approach may be taken providing that a thorough risk assessment has been performed and compliance is achieved by the implementation of appropriate controls to mitigate any risk of non-sterility. Points to consider in such a risk assessment should include but are not be limited to: ……
2022新版:8.87 The integrity of the sterilised filter assembly should be verified by integrity testing before use(pre-use post sterilisation integrity test or PUPSIT), to check for damage and loss of integrity caused by the filter preparation prior to use. A sterilising grade filter that is used to sterilise a fluid should be subject to a non-destructive integrity test post-use prior to removal of the filter from its housing. The integrity test process should be validated andtest results should correlate to the microbial retention capability of the filter established during validation. Examples of tests that are used include bubble point, diffusive flow, water intrusion or pressure hold test. It is recognized thatPUPSITmay not always be possible after sterilisation due to process constraints (e.g. the filtration of very small volumes of solution). In these cases, an alternative approach may be taken providing that a thorough risk assessment has been performed and compliance is achieved by the implementation of appropriate controls to mitigate any risk of a non-integral filtration system. Points to consider in such a risk assessment should include but are not limited to: ……
整体上来说,终版文件中对于PUPSIT的要求做了额外的补充说明,也提出了在某些特定工艺上无法执行PUPSIT需要执行相关的风险评估, 小编在此总结了新版附录1对于PUPSIT的相关要求以供参考:
基于现行Annex1中对于PUPSIT的要求,我们需要对过滤器组件进行灭菌后使用前完整性测试,这就需要我们在设计过滤链时将这个需求考量在内,保障在后续操作过程中包括但不限于润湿,完整性测试以及吹扫等步骤的无菌性就显得至关重要。常见的设计方式包含了主过滤器下游增加储罐/冲洗袋加呼吸器或是使用屏障式过滤器的设计方式。
在一次性或是不锈钢系统上执行包括润湿,完整性测试以及吹扫等操作的情况下不破换整体系统的无菌性,默克所提供的Millipak® Barrier以及Millidisk® Barrier屏障式过滤器同时包含了除菌级0.22 μm 孔径的Durapore® PVDF过滤膜,从而能够达到既能通气,又能过水的表现,简化了灭菌后系统中的相关操作。

图1:屏障式过滤器单元结构
屏障式过滤器能够在正常的过滤器操作中达到简化操作和降低风险的表现
系统冲洗及过滤器润湿
在过滤料液之前,整体系统组件中的可提取物需要从系统中冲洗出去,冲洗的料液可以通过屏障式过滤器直接排出的同时保障系统无菌性
过滤器有时候会在使用前完整性测试的过程中失败,在重复润湿的过程中,通过屏障式过滤器直接排水,可以达到无上限的润湿体积的同时不增加整体系统的占地面积。
过滤器完整性测试
在完整性测试过程中,过滤器下游要保持常压的状态,所以下游应该能够通气。屏障式过滤器不仅能排液,也能排气,同时保证过滤器下游的无菌性。屏障式过滤器支持通过气体及液体,可以快速的将系统排空,从而简化系统设计以及减少过滤器的数量。
系统吹扫并且保持无菌性
在完整性测试结束之后,如果要进行系统吹扫,屏障式过滤器仍然可以在保证除菌过滤器下游无菌的情况下,既排水又排气。
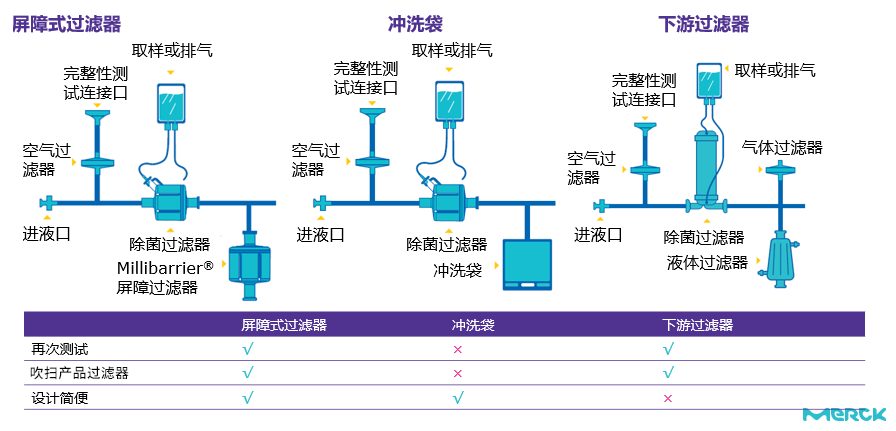
图2:不同在线完整性测试设计对比
在新版欧盟GMP附录1中,一次性系统(SUS)作为独立章节呈现并且被要求一次性系统有关的特定风险应作为污染控制策略(CCS)的一部分进行评估,这无疑显示出了这几年一次性技术的迅猛发展和广泛使用
一次性技术由于其灵活和密闭的特性赋予了终端灌装工艺更大的灵活性和高效性,提高了操作人员和产品安全性,并减少了工艺验证要求和工艺周转时间。拥有丰富的一次性技术,膜过滤技术产品线和相关产品验证经验,使得默克在终端灌装一次性系统设计领域也积累了丰富的经验。我们凭借和客户的深度沟通和对于除菌法规和灌装技术的理解,为全球生物制药客户提供定制化的带有PUPSIT设计一次性灌装系统。

图3:用于终端过滤的Mobius® 一次性组件有助于 PUPSIT 的实施
一次性使用过滤和灌装组件设计通常是生物制药企业独有的,其组件的设计排列取决于设备、所生产的药品和单个组件过滤器、取样和连接器的特点。通过和客户及灌装机供应商的三方深入沟通,从过滤器的选型,过滤器冲洗方式选择,产品回收方式,过滤器放置位置,等多个方面进行综合考量,设计出符合其需求的PUPSIT一次性系统。
设计案例分享:

图4 传统一次性冗余过滤系统(SURF)
图5 流线型一次性冗余过滤系统(SURF)
许多生物制药企业在标准过滤操作中不包括产品回收步骤,对于灌装规模较大的工艺,增加产品回收率可能需要更多额外的步骤及延长生产所需的时间,那么传统一次性冗余过滤系统(SURF)是一个理想选择。
对于小批量、高价值的药品的生产过程,灌装系统中残留的样品会更受关注,因为无法回收的产品可能会转化为比较大的经济损失。这时流线型一次性冗余过滤系统的优势更为明显,这个设计利用带有AMPP过滤器的无菌优势,连接完整性测试仪和排气、取样袋,这种布局使得两个过滤器之间的连接和管路更少,有助于减少系统中残留的产品体积,提高产品的回收率。
对于一次性系统,前文中也提到终版附录 1 认可在无菌产品生产中使用一次性系统 (SUS),并有一个专门的段落进行阐述,其中列出了“与 SUS 相关的一些特定风险,应作为 CCS 的一部分进行评估”:与药物的相互作用产品、完整性(“孔洞和泄漏风险”)和颗粒物污染。列出了诸如供应商验证、可提取物评估、整个工艺的完整性验证、进入物料控制、操作员培训等期望。对于这些描述,默克有非常完善的服务平台帮助用户满足监管期待。
7*24 小时在线的Emprove®文件系统,登录默克官网, 即可获得一次性组件和过滤器标准验证资料和标准完整可提取物报告
Mobius® 一次性灌装组件,100%完整性检测,确保制药企业安心使用
BioReliance® 验证服务,专业验证团队,为制药企业提供过滤器和一次性组件的可提取和浸出物验证服务,同样可以支持终端过滤的细菌截留验证,保证患者安全
”
这次我们简单地介绍了PUPSIT在最新版附录1中的相关描述及默克的解决方案,在讨论终端过滤以及PUPSIT的时候,我们也会经常讨论到冗余过滤的设计以及冗余过滤如何执行PUPSIT,我们也将在下一期的内容中做更多的解析,敬请期待。
关于默克工艺解决方案
默克工艺解决方案,凭借可信赖的产品、丰富的生物制药工艺专业知识和卓越的法规支持,为生物制药客户提供全方位支持,以应对各种工艺挑战。
默克工艺解决方案全新平台上线,
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱