神经元特异性启动子-hSyn
2022-11-18 07:19:54, 阿迪 上海吉凯基因医学科技股份有限公司
腺相关病毒(AAV)作为动物实验首选的工具病毒,具有标记体内细胞、调控基因表达、递送表达元件等功能。AAV的特点为体积小、扩散能力强;本身具有十数种血清型,搭配上特异性启动子,使得AAV成为了脑科学研究中,强有力的工具病毒[1]。
中枢神经系统中,存在几十种不同的细胞类型。为了精准的靶向神经元,我们可以选择神经元特异性启动子hSyn。hSyn启动子来源于人SYN1基因的启动子,该基因表达产生的Synapsin I蛋白,是特异表达在神经元内的蛋白,因此一般选择hSyn启动子作为神经元的特异性启动子[2]。接下来为了展示hSyn在高分文献中的应用,将会使用神经元特异性启动子载体发表的文献[3]:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal,帮助老师们了解神经元特异性启动子-hSyn。
这篇文献是经典的A基因,通过B机制,在C疾病中,发挥了D功能。
腹侧被盖区(VTA)神经元的可塑性对药物依赖的建立至关重要。然而,调节正向效应和负向效应之间转换的回路的重塑仍不清楚。在本研究中,我们使用神经元活动依赖标记技术来表征和暂时控制由最初吗啡暴露引起的VTA神经元集合,优先投射到NAc,并诱导多巴胺依赖性正强化。
一、吗啡驱动了多巴胺依赖行为的正向强化
为了验证吗啡正向强化多巴胺行为的功能,作者使用了载有CreERT2的AAV,启动子E-SARE(功能与c-fos相似),与AAV-DIO-mcherry,来标记吗啡激活的VTA神经元。腹腔注射tamoxifen(TAM)后24小时,进行免疫荧光验证。结果显示:在矢状图上显示,VTA核团的Fiber投射到了NAc核团(Figure 1A-B)。为了验证神经环路的特异性,作者将逆行示踪剂CTB注射NAc核团,并分析VTA中的投射集合,结果显示:吗啡驱动了VTA-NAc更多的多巴胺连接(Figure 1C-D)。为了更充分的说明问题,作者借助了遗传学+行为学的操控方法。在光遗传方面,作者借助AAV双载体(AAV-E-SARE-CreERT2与AAV-DIO-ChR2-mCherry),注射在VTA核团,3周后进行电生理和行为学的检测(Figure 1G-H)。同时,记录DA传感器DA4.4的荧光动态来确定多巴胺(DA)的释放(Figure 1K-I)。这些数据说明,吗啡驱动了NAc释放多巴胺的正向强化。
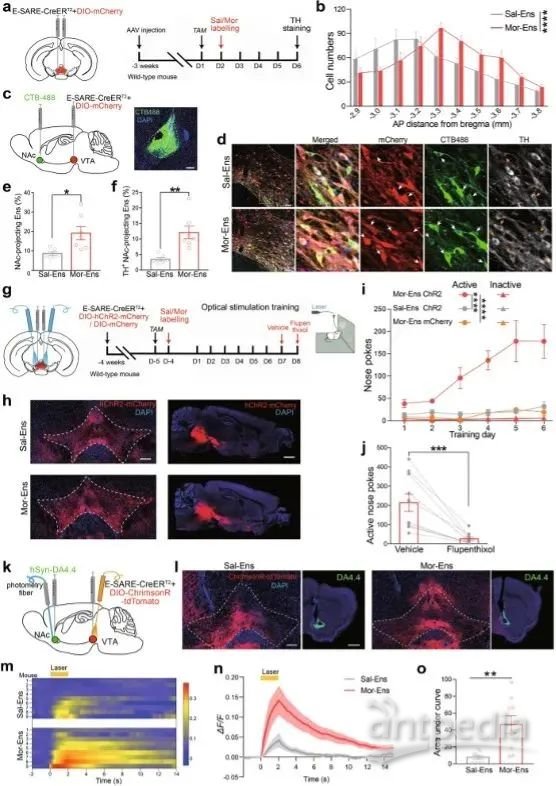
图片来源于:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal.
二、戒断过程中,慢性吗啡给药增强了抑制性突触传递
长期服用阿片类药物可引起VTA可塑性的病理变化。因此,我们使用全细胞膜片钳记录来评估慢性吗啡给药的膜电位变化(Figure 2A-C)。随着吗啡的剂量增加,实验组的IPSC振幅和频率明显增加,而EPSC未见明显差异(Figure 2D-I)。为了评估Mor-Ens的活性对突触抑制是否至关重要。作者借助化学遗传学(AAV双载体:AAV-E-SARE-CreERT2与AAV-DIO-hM3Dq/hM4Di-mCherry)搭配行为学的方法,证明了最初吗啡暴露所招募的集合的激活减少了条件厌恶,减轻了负性躯体症状和鸦片戒断期间的焦虑。

图片来源于:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal.
三、CRHCeA→VTA神经元的激活促进了条件场所厌恶和鸦片戒断时的焦虑
慢性吗啡治疗后,CRHCeA→VTA神经元中c-Fos表达增加。为了评估慢性吗啡给药后,CRHCeA→VTA神经元的抑制性输入是否发生变化,作者将AAV-Retro-EF1a-DIO-EYFP注入CRH-ires-Cre小鼠,成功标记CRH阳性神经元,随着给药剂量的增加,慢性吗啡给药组的CRH神经元的激活、兴奋传递和膜兴奋性增强(Figure 3D-J)。为了验证CRHCeA→VTA神经环路的激活,对吗啡戒断的CPA和焦虑的影响,作者将AAV-DIO-eNpHR3.0-EYFP注入CRH-ires-Cre小鼠,并在VTA上植入光纤,473nm激光激活CRHCeA→VTA神经元,结果显示:CRHCeA→VTA神经元活性增加有助于鸦片戒断过程中CPA和焦虑的发生。

图片来源于:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal.
四、慢性吗啡给药对CRHCeA→VTA神经元之间回路的特异性重构
前面的实验已经证明,慢性吗啡给药对CRHCeA→VTA神经元活性的特异性调节,为了研究CeA的单突出输入,作者使用了缺陷的狂犬病毒(AAV-DIO-H2B-EGFP-TVA and AAV-DIO-RVG),在标记CRH神经元后1天,将RV-EnvA-dsRed注射到VTA区。Mor-Ens连接的CeA神经元中CRH+细胞数高于对照组,慢性吗啡给药对CRHCeA→VTA神经元之间回路的特异性重构(Figure 4F-G)。

图片来源于:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal.
五、CRHR1信号的干预减弱了来自CRHCeA→VTA的抑制输入
为了确定CRHR1是否CRHCeA→VTA的抑制输入。作者构建了一个携带sgRNA靶向CRHR1的AAV载体,实现了CRISPR-Cas9介导的CRHR1缺失。小鼠VTA感染AAV-sgcrhr1-mcherry、RAM-tTA-TRE-Cre和Cre依赖性AAV-DIO-saCas9(Figure 6I)。经过光遗传学+行为学的验证,最终证明:CRH-CRHR1信号通路有助于抑制CeA输入和Mor-Ens回路的突触和功能重塑,从而调节阿片类药物戒断过程中的负面影响。

图片来源于:CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal.
小 结
文章的最后,我将作者使用的工具病毒罗列出来,老师们可以根据自己实验的需求,选择合适的工具病毒。
1.标记细胞
AAV-ESARE-CreERT2+AAV-DIO-mCherry
AAV-Retro-DIO-EYFP + Retro-hSyn-tdTomato
2.基因操控
AAV-ESARE-CreERT2+AAV-DIO-hChR2-mCherry
AAV-DIO-eNpHR3.0-EYFP
AAV-ESARE-CreERT2+DIO-ChrimsonR-tdTomato
AAV-ESARE-CreERT2+DIO-hM4Di-mCherry
AAV-ESARE-CreERT2+DIO-hM3Dq-mCherry
AAV-RAM-tTA-TRE-hM3Dq-HA
3.递送元件
AAV-hSyn-DA4.4 RV-ENVA-deltaG-dsRed
AAV-DIO-H2B-EGFP-TVA + AAV-DIO-RVG
4.双载体介导基因敲除
AAV-sgCrhr1
AAV-RAM-Cre + DIO-saCas9
【参考文献】
1. Challis RC, Ravindra Kumar S, Chan KY, Challis C, Beadle K, Jang MJ, Kim HM, Rajendran PS, Tompkins JD, Shivkumar K, Deverman BE, Gradinaru V. Systemic AAV vectors for widespread and targeted gene delivery in rodents. Nat Protoc. 2019 Feb;14(2):379-414. doi: 10.1038/s41596-018-0097-3. Erratum in: Nat Protoc. 2019 Aug;14(8):2597. PMID: 30626963.
2. Hynes TJ, Hrelja KM, Hathaway BA, Hounjet CD, Chernoff CS, Ebsary SA, Betts GD, Russell B, Ma L, Kaur S, Winstanley CA. Dopamine neurons gate the intersection of cocaine use, decision making, and impulsivity. Addict Biol. 2021 Nov;26(6):e13022. doi: 10.1111/adb.13022. Epub 2021 Feb 8. PMID: 33559379.
3. Jiang C, Yang X, He G, Wang F, Wang Z, Xu W, Mao Y, Ma L, Wang F. CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal. Mol Psychiatry. 2021 Nov;26(11):6170-6186. doi: 10.1038/s41380-021-01321-9. Epub 2021 Oct 12. PMID: 34642456; PMCID: PMC8760059.

1.实验技术干货
2.蛋白质组学研究
3.腺病毒简介及应用
4.临床基础研究思路解析
5.组织特异性腺相关病毒
6.单细胞测序
7.慢病毒实验操作指南
8.悬浮细胞专用病毒
9.靶点设计/数据库教程
10.测序技术研究与应用
11.非编码RNA研究技术与应用
12.腺相关病毒选择/应用
13.表观遗传研究
14.文章解析
15.国自然课题设计思路解析
16.生物信息分析及工具
17.外泌体研究
18.肿瘤免疫研究
19.高分文章
20.吉凯病毒神经方向应用案例
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家