项目文章 | 多组学联合(转录组+代谢组)在环境暴露方向的应用案例
2022-04-25 22:53:01, 小迈 武汉迈特维尔生物科技有限公司
新书首发(免费+包邮)详情请

2022年3月,第三军医大学西南医院眼科徐海伟教授研究团队在环境科学与生态学JCR分区Q1EnvironmentInternational(IF9.621)期刊发表了题为“Evaluationof the influences of low dose polybrominated diphenyl ethers exposureon human early retinaldevelopment”的研究论文。本研究采用代谢组学和转录组学揭示了低水平BDE-47(2,2,4,4-四溴二苯醚,是生物样品中最常检测到的多溴二苯醚同系物)的视网膜毒性潜在机制,并强调了hESC-RO模型的有效性,加深了对BDE-47驱动的人类早期视网膜发育毒性的理解。迈维代谢为本次研究提供了非靶向代谢组检测分析服务。
● 发表单位:第三军医大学西南医院
● 期刊:EnvironmentInternational
● 影响因子:9.621
● 发表时间:2022.03
最近,环境化学物质在视网膜中的积累及其对视网膜发育的毒性作用越来越受到重视。在动物模型中,越来越多的证据表明,多溴二苯醚(PBDEs),一种溴化阻燃剂,可以引起视网膜毒性。然而,由于缺乏适当的模型,关于多溴二苯醚对人类视网膜发育影响的研究十分匮乏。
近年来,hESC-ROs(人类胚胎干细胞-视网膜类器官)被认为是剖析环境应激引起的人类视网膜发育障碍过程的一个很好的模型。本研究首次采用hESC-RO模型研究了低剂量多溴二苯醚暴露对人类早期视网膜发育的影响。

■ ■ ■ ■ ■
1. hESC来源的视网膜类器官的产生和鉴定
为了模拟人类胚胎视网膜的发育,参考已发表的方法构建hESC-ROs,实验数据表明,hESC-RO模型成功建立。

■ ■ ■ ■ ■
图1所示。hESC来源的视网膜类器官的产生和鉴定。A:不同分化时间点(D1、D6、D18、D32、D53)的hESC-ROs相差显微镜图像,显示神经视网膜层(黑色三角形、红色矩形)的连续形态变化。B,C: HuC/D和RAX,SOX2和PAX6在D32的hESC-ROs免疫染色。D、E:BRN3、SOX2、Crx、CHX10在D39的hESC-ROs免疫染色;白色矩形的放大倍数,如d1和d2所示。F-H:ZO-1和CHX10、HuC/D和CHX10、recoverin和HuC/D在D53时的hESC-ROs免疫染色。
2. 多溴二苯醚引发hESC-ROs形态异常
从D18开始进行持续五周的PBDE处理(图2A)。基于BDE-47剂量依赖性,选择低剂量的0.01μM和0.1μM。有趣的是,暴露于BDE-47两周和三周后,NRs(神经视网膜)和hESC-ROs的厚度、面积和NR的百分比均有所增加(图2C,D),而暴露于BDE-47五周后,NRs和hESC-ROs的厚度、面积和NR的比例均有所下降。
处理5周后,与对照组相比,0.01μM和0.1μM BDE-47处理可显著降低NRs厚度,且hESC-ROs面积减少。0.1μM BDE-47处理后,hESC-ROs的NR百分比显著降低,而0.01μMBDE-47暴露组与对照组相比差异无统计学意义。为了进一步验证多溴二苯醚诱导的形态改变,hESC-ROs暴露于另一种多溴二苯醚同系物BDE-209,以及BDE-47,BDE-47/209混合物中,与上述结果相似。为了验证多溴二苯醚的毒性作用,作者还对BDE-47、BDE-209和BDE-47/209暴露进行了毒性评估。结果表明,多溴二苯醚对hESC-ROs的生长具有剂量和时间依赖性,其形态学变化包括厚度、面积、NRs的百分比。

■ ■ ■ ■ ■
图2所示。多溴二苯醚暴露对hESC-ROs生长的影响。A:诱导方案和多溴二苯处理hESC-ROs的示意图。hESC-ROs暴露于多溴二苯醚中,时间从D18到D53(持续5周)。B:经BDE-47治疗2周、3周、5周的hESC-ROs代表性相位对比图(NR层:红色三角环区)。C,D: BDE-47暴露2周、3周、4周、5周后hESC-ROs中NRs的厚度和面积定量分析。
3. 多溴二苯醚影响hESC-ROs细胞增殖和凋亡
为了揭示多溴二苯醚对hESC-ROs视网膜神经元的影响,进行免疫荧光染色和TUNEL染色。与对照组相比,0.01μM和0.1μM的BDE-47处理5周后Ki67增殖细胞阳性率降低,暴露于BDE-47在2周或3周时,Ki67水平没有显著变化。相反,BDE-47暴露诱导细胞凋亡。0.01μM和0.1μM BDE-47处理组tunel阳性凋亡细胞比例明显高于对照组;0.1μMBDE-47对tunel阳性细胞比例也有影响,但0.01μM BDE-47对tunel阳性细胞比例的影响不显著(图3A,C)。此外,免疫荧光染色显示,0.01μM和0.1μM BDE-47处理5周后,cleaved-caspase3阳性细胞比例显著增加(图3D)。有趣的是,暴露于BDE-47在5周后,NRs中发现了典型的玫瑰花状结构(图3A)。玫瑰结的形成可能是由BDE-47诱导视网膜细胞异常增殖引起的(Shiraiet al. 2016)。提示BDE-47能抑制视网膜细胞增殖,促进细胞凋亡。

■ ■ ■ ■ ■
图3所示。暴露5周后,hESC-ROs的增殖和凋亡受到影响。A:经PBDE(0.01 μM和0.1μM)处理5周后,hESC-ROs中ki67阳性增殖细胞、TUNEL和cleaved-caspase3阳性凋亡细胞的代表性免疫染色图像。NRs上可见典型的神经玫瑰状结构(白色三角形)。B-D:定量分析BDE-47作用5周后NRski67增殖阳性细胞和TUNEL、cleaved-caspase3阳性凋亡细胞的比例。
4. 多溴二苯醚影响hESC-ROs的细胞分化
作者进一步研究了BDE-47对视网膜细胞分化的影响。免疫染色数据显示,对照组视网膜无长突细胞/神经节细胞(HuC/D)有规律地分布于NRs基底侧(图4A、1B、1G、1H)。暴露于BDE-47在5周后,NRs上发现HuC/D阳性细胞分布紊乱(图4A),HuC/D阳性细胞比值明显降低;此外,BDE-47暴露5周后,BRN3-阳性神经节细胞的比例显著降低;有趣的是,在BDE-47处理后,CHX10阳性视网膜祖细胞(RPCs)在NRs的顶端侧排列紊乱,并填补了HuC/D阳性细胞之间的间隙。此外,在NRs的基底侧也发现PAX6阳性细胞排列紊乱。
与NRs顶端和基底两侧的光感受器前体细胞(Crx)的规律性分布相比,BDE-47暴露引起Crx阳性细胞排列紊乱(图4A)。此外,部分Crx阳性的光感受器前体细胞分布成玫瑰花状结构。同时,0.01μM BDE-47处理组Crx阳性前体细胞比例显著增加,而0.1μM BDE-47处理组Crx阳性前体细胞比例没有显著增加(图4D)。此外,经0.01μM BDE-47处理5周后,hESC-ROs中CrxmRNA表达上调,提示低水平BDE-47可诱导Crx阳性的光感受器前体细胞分化。0.1μM BDE-47处理5周后,恢复素阳性的光感受器细胞明显减少,而0.01μMBDE-47处理5周后恢复素阳性的光感受器细胞明显减少(图4E)。同样,暴露于BDE-47后,恢复素阳性的光感受器细胞在NRs中分布不规则。
用qRT-PCR检测mRNA的表达。结果显示,BDE-47暴露5周后,BRN3b(视网膜神经节细胞标志物)和recoverinmRNA表达下调。这些结果与上述HuC/D的免疫染色数据一致(图4A,B)。此外,BDE-47还引起了CHX10(RPC标记物)的失调。这些结果表明,BDE-47暴露5周后,视网膜细胞(包括无长突细胞/神经节细胞和光感受器细胞)的分化受到影响。

■ ■ ■ ■ ■
图4所示。暴露5周后,hESC-ROs的分化受到影响。A:经BDE-47处理5周后的hESC-ROsHuC/ D阳性无长突细胞/神经节细胞、BRN3阳性神经节细胞、Crx阳性光感受器前体细胞和恢复素阳性光感受器细胞的代表性免疫染色图像。B-E:定量分析BDE-47暴露5周后NRs细胞HuC/D-、BRN3-、Crx-和恢复阳性细胞的比值。
5. hESC-ROs对多溴二苯醚应答的转录组分析
应用RNA-seq分析方法研究BDE-47暴露后hESC-ROs的差异表达基因(DEGs)。DEGs定义为P-value< 0.05 且foldchange >1.2或者<0.8.。其中,与对照组相比,BDE-47暴露于0.01μM和0.1μM的hESC-ROs中,分别有154个和309个基因表达显著上调,对应55个和63个基因表达显著下调。火山图表示了这些DEGs的分布(图5A、B)。Venn图显示,在0.01和0.1μM BDE-47暴露组中,均发现了101个DEGs,其中82个基因上调,19个基因下调。
为了进一步了解这些DEGs,作者进行了GO注释分析以确定其生物学过程。细胞外结构组织、细胞外基质组织、ERK1和ERK2级联、细胞底物黏附、感觉器官形态发生、BMP信号通路、细胞解毒、细胞氧化解毒、干细胞发育、根据基因数目,0.01μM BDE-47显著富集胰岛素样生长因子受体信号通路(图5D)。数据还显示,与对照组相比,0.1μM BDE-47暴露组比0.01μM暴露组识别出更多的差异项(图5D,E)。此外,0.01μM与0.1μMBDE-47影响的条目有大量重叠,包括细胞外结构组织、细胞外基质组织、细胞底物黏附、ERK1和ERK2级联、BMP信号通路等。前两项:细胞外结构组织和细胞外基质组织,参与了脱细胞间质微环境,表明BDE-47可能破坏了在胚胎发生、组织特异性发育和干细胞分化中发挥关键作用的细胞外基质。

■ ■ ■ ■ ■
图5所示。0.01μM和0.1μM BDE-47对hESC-ROs的转录组分析。A、B:0.01 μM和0.1μM BDE-47暴露组与对照组的hESC-ROs中DEG的火山图。C:DEG维恩图。D、E:GO注释分析。
KEGG通路注释在BDE-47暴露的hESC-ROs中显示,DEG可以被分为5项,如代谢、环境信息处理、细胞过程、有机体系统和人类疾病(图6A,B);KEGG通路注释显示,被识别的部分DEGs与环境信息处理中的信号转导相关。此外,与DMSO(二甲基亚砜)对照相比,蛋白消化吸收和细胞外基质(ECM)受体相互作用被确定为0.01和0.1μM BDE-47处理的重要途径。
考虑到基因相互作用在发育过程中的重要性,作者利用STRING在线数据库对101个DEGs进行分析,创建一个相互作用网络(图6C)。在这些相互作用的基因中,利用qRT-PCR进一步验证候选蛋白包括:对样同源结构域转录因子2(PITX2)、ephrintype-A receptor 2 (EPHA2)、胶原α-1(V) (COL5A1)、胶原α-1(I) (COL1A1)和S100钙结合蛋白A9(S100A9)。结果显示,BDE-47治疗5周后,PITX2COL5A1、COL1A1和S100A9mRNA表达上调,EPHA2表达下调(图6D)。

■ ■ ■ ■ ■
图6所示。hESC-ROs暴露于BDE-47的关键途径分析。A、B:0.1 μMBDE-47对hESC-ROs富集的前20条通路。第一圈显示了富集的通路和相关基因的数量,第二圈显示基因组背景中的基因数量和富集-log10(P-value),第三圈显示下调基因(淡紫色)和上调基因(深紫色)比例,第四圈显示了富集因子。C:基于STRING(11.5)数据库的101个DEGs基因相互作用网络。未连接的节点被隐藏;红色表示DEGs与细胞迁移有关,蓝色表示DEGs与细胞分化有关,绿色表示DEGs与眼睛发育有关,黄色表示DEGs参与抗氧化活性。D:采用qRT-PCR检测BDE-47暴露的hESC-ROs中PITX2、EPHA2、COL5A1、COL1A1和S100A9mRNA的相对表达量。
6. hESC-ROs对BDE-47应答的代谢组分析
利用LC-MS-MS对BDE-47引起的hESC-ROs代谢变化进行代谢组学分析。通过OPLS-DA分析发现BDE-47暴露后hESC-ROs的代谢变化相当明显(图7A)。火山图在0.01μM和0.1μM BDE-47暴露组中呈现出明显的上调和下调特征(图7B)。在显著失调的特征中,与对照组相比,暴露于0.01μM和0.1μM BDE-47的hESC-ROs中分别发现了84和121个显著失调的代谢物(图7C)。Venn图显示,在0.01μM和0.1μM bde-47暴露的hESC-ROs中,40种代谢物均出现异常。在这些异常代谢产物中,分别有24个代谢产物表达上调,16个代谢产物表达下调。热图显示了暴露于BDE-47在5周后显著失调的代谢产物。通过KEGG通路分析,确定了0.1μM BDE-47处理后的通路。然而,在5周时,KEGG通路将0.01μM BDE- 47与乙醛酸和二羧酸代谢、嘌呤代谢联系起来(图7D)。此外,与0.01μM BDE-47暴露组相比,0.1μM BDE-47暴露组的hESC-ROs中发现了48种显著失调的代谢产物。在这些异常代谢产物中,31个上调,17个下调。
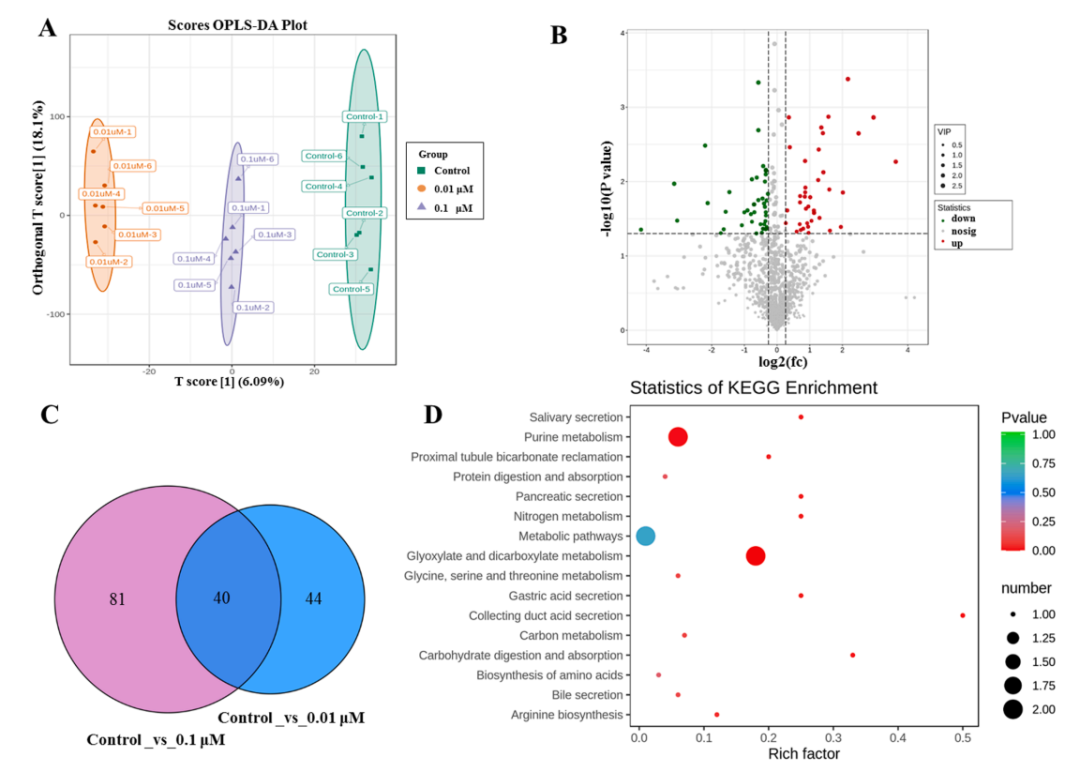
■ ■ ■ ■ ■
图7所示。0.01μM和0.1μM BDE-47对hESC-ROs的代谢组分析。A:对照组和BDE-47两剂量处理组hESC-RO代谢物的OPLS-DA评分图。B:hESC-ROs代谢紊乱的火山图,比较0.01μMBDE -47暴露组和对照组。C:剂量相关模块中代谢紊乱的维恩图。D:与对照组相比,在0.01μM BDE -47暴露的hESC-ROs中,KEGG富集失调的代谢通路。
7. 转录组和代谢组的整合分析揭示了hESC-ROs对多溴二苯醚暴露的响应
为了深入了解多溴二苯醚对视网膜发育的毒性作用,作者使用MetaboAnalyst5.0 (https://www.metaboanalyst)构建了上述代谢物和基因的综合网络分析。在0.01μM BDE-47处理后,未发现任何显著的代谢产物和基因网络。然而,0.1μM BDE-47暴露的hESC-ROs代谢产物和DEGs的整合网络主要集中在谷胱甘肽、苯乙胺和大豆黄酮和草酸代谢(图8A-C)。0.1μM BDE-47处理后,hESC-ROs中谷胱甘肽和草酸表达上调,苯乙胺和大豆苷元表达下调。暴露于BDE-47在5周后,谷胱甘肽代谢与DEGs的表达有关,包括谷胱甘肽过氧化物酶2(GPX2)、γ谷氨酰基转移酶1(GGT1)、己糖-6-磷酸脱氢酶(H6PD)、谷胱甘肽s-转移酶α1(GSTA1)、脂质过氧化物酶(LPO)和白蛋白(ALB)。qRT-PCR结果进一步验证了BDE-47处理5周后GPX2、GSTA1、ALB基因表达上调,GGT1表达下调(图8D)。
■ ■ ■ ■ ■
图8所示。基于MetaboAnalyst平台的差异代谢产物和差异基因的网络分析。A-C:分别是谷胱甘肽、苯乙胺、大豆黄酮和草酸的代谢网络。圆形代表差异基因,立方代表差异代谢物。红色表示上调,绿色表示下调。D:采用qRT-PCR检测BDE-47暴露的hESC-ROs中GPX2、GSTA1、GGT1和ALBmRNA的相对表达量。
总之,本研究通过hESC-RO模型揭示了多溴二苯醚潜在的人类早期视网膜发育毒性。本文证明,低剂量多溴二苯醚可能会产生多方面的早期发育毒性,影响视网膜祖细胞的增殖、迁移和分化。代谢组学和转录组学分析是识别分子标记的有力工具,并证明了细胞外基质组织和嘌呤和谷胱甘肽的代谢参与了多溴二苯醚的视网膜毒性。今后研究仍然需要进一步阐明多溴二苯醚引起视网膜发育毒性的完整分子机制。
本文采用非靶向代谢组学检测分析方法。在此技术基础上,迈维代谢研发了TM广靶:该方法将非靶(高分辨、广覆盖)与广靶(高灵敏、精定量)完美结合:首先用高分辨TOF对样本进行二级谱扫描,提取MRM离子对信息,再整合广靶库构建样本的特异性数据库,最后利用Q-TRAP对库中物质开展MRM精准检测,极大地提升了有效数据量。
技术优势
1. 广泛靶向定位重要常见物质;
2. 非靶向挖掘特色功能物质(高分辨自建库、DB-all公共库、AI预测库、MetDNA2.0);
3.“MRM模式”黄金定量标准;
4. 通量更大,稳定准确检出1300+;
5. 尤其适合复杂样本。
99%的代谢组学研究者都在阅读下文:
●免费+包邮 | 2022版迈维医学项目文章集锦,扎实沉甸全网首发!
●非靶代谢组原始数据上传保姆级教程
●视频实操SCI作图课(9):如何利用upsetR快速提取多组交集信息
●微生物专题 | 值得收藏!16S和宏基因组送样要求汇总

客服微信:metware888
咨询电话:027-62433042
邮箱:support@metware.cn
网址:www.metware.cn
我就知道你“在看”
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱