一种Maurice-nrCE-SDS方法测试26种FDA批准的单抗和2种ADC
2020-08-14 03:07:58 ProteinSimple
法国IRPF-CIPF生物制剂CMC开发研究中心和瑞士药物科学研究所的科学家,利用Maurice中CE-SDS功能,测试了26种FDA和EMA批准的单克隆抗体(mAbs)和2种抗体药物偶联物(ADCs),该文章在Journal of Pharmaceutical and Biomedical Analysis发表:Determination of size variants by CE-SDS for approved therapeutic antibodies: Key implications of subclasses and light chain specificities, J Pharm Biomed Anal. 2020 May 30;184:113166.
--研究摘要--
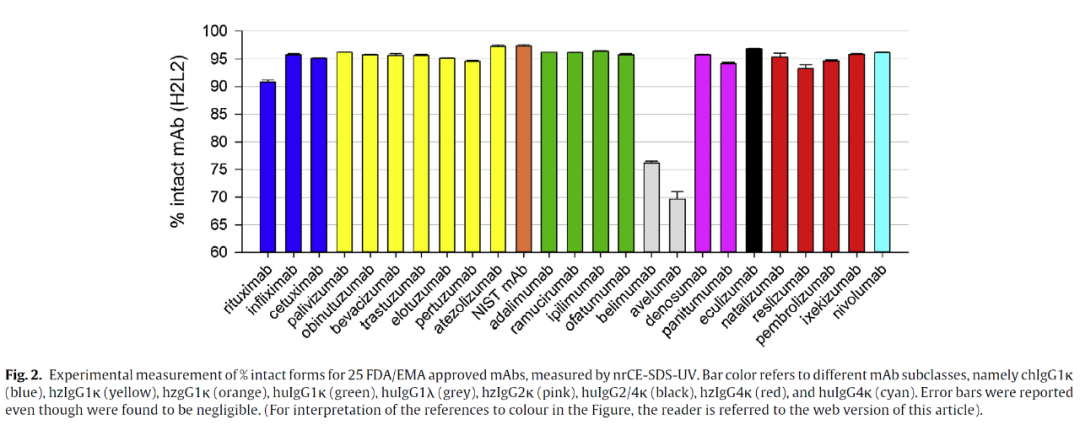
本研究利用Maurice-nrCE-SDS(一种非还原十二烷基硫酸钠毛细管电泳)方法测试了,在质量控制环境中符合测试批生产或批放行的质量要求的26种FDA和EMA批准的单克隆抗体(mAbs)和2种抗体药物偶联物(ADCs)。本方法允许在大约40分钟内快速、准确地获得药物产品中分子量变异体的数量,并且该方法可用于批放行、一致性、稳定性和保质期评价。首先,由于添加了内部标准,该方法在相对迁移时间和片段的相对百分比方面(平均RSD值分别为0.3%和0.2%)重复性很好。本研究测试了一组属于不同的亚类(重链γ1、2、2/4和4)和轻链类型(κ或λ),以及在不同的细胞系(CHO、NS0和SP2/0)中产生的嵌合、人源化和人单克隆抗体。对于所有这些生物制药产品,H2L2种类的含量介于90.9%至97.7%之间,但属于IgG1λ亚类的两种mAb除外(即avelumab和belimumab在70°C的样品制备过程中出现部分还原)。本研究利用的Maurice-nrCE-SDS方法获得的多种治疗性抗体(涵盖了广泛的结构和物理化学性质)的测试结果,显示可以达到大于90%的完整抗体含量(H2L2)的规格。
--研究内容--
在过去30年中,药品监管机构已批准了80多种mAb。考虑到目前在临床试验中各个阶段评估的570种抗体的数量,以及为了确保药物的质量和安全性,必须在药品生命周期的各个阶段,生产和保质期内评估各种药物的变异体,例如大小,电荷和疏水性变异体。分子量变异体是潜在的关键质量属性(pCQA),通常被认为是质量评估研究中最重要的CQA之一,因此必须为批放行和货架期设定规格。
Maurice-nrCE-SDS方法的高精密度
检测mAb的细碎片段对于确定制造和产品稳定性一致性至关重要。本研究通过在非还原条件下应用通用的CE-SDS方法(nrCE-SDS)对碎片物种进行实验监测。片段化物种主要是天然抗体亚基:轻链(L,25kDa),重链(H,50kDa),重-轻链(HL,75kDa),重-重链(H2,100kDa)和重-重-轻(H2L,125kDa),它们与完整mAb(H2L2,150kDa)分开,并根据其相对迁移时间(RMT)进行鉴定。
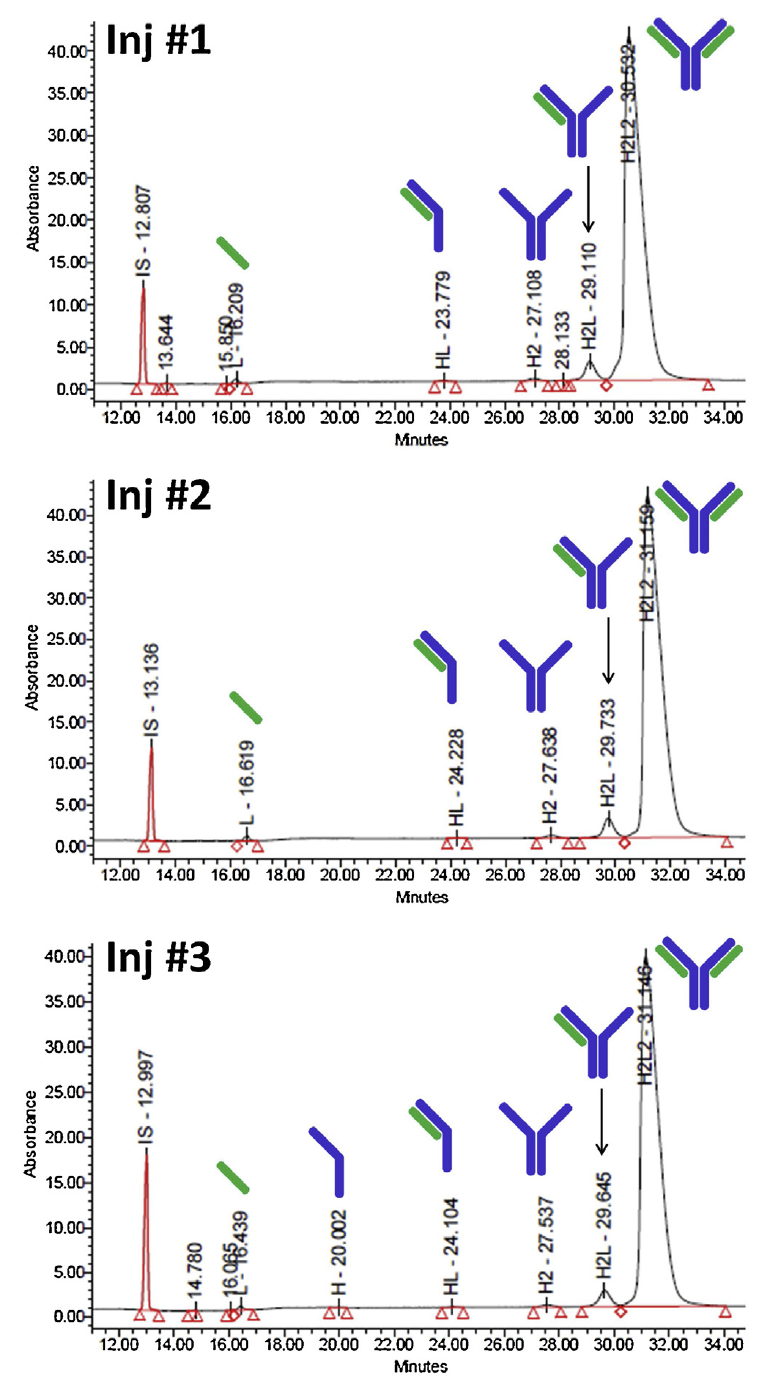
首先利用Maurice-nrCE-SDS方法检测和解析常见mAb分子trastuzumab单抗的能力,并在同一天使用单个样品制备和三个重复进样评估了重复性。结果表明,该方法具有极高的精密度,相对片段百分比的平均RSD为9.6%,RMT的平均RSD为1.1%,在使用IS的支持下降至0.3%。
Maurice-nrCE-SDS测试原研药和生物仿制药的生物相似性
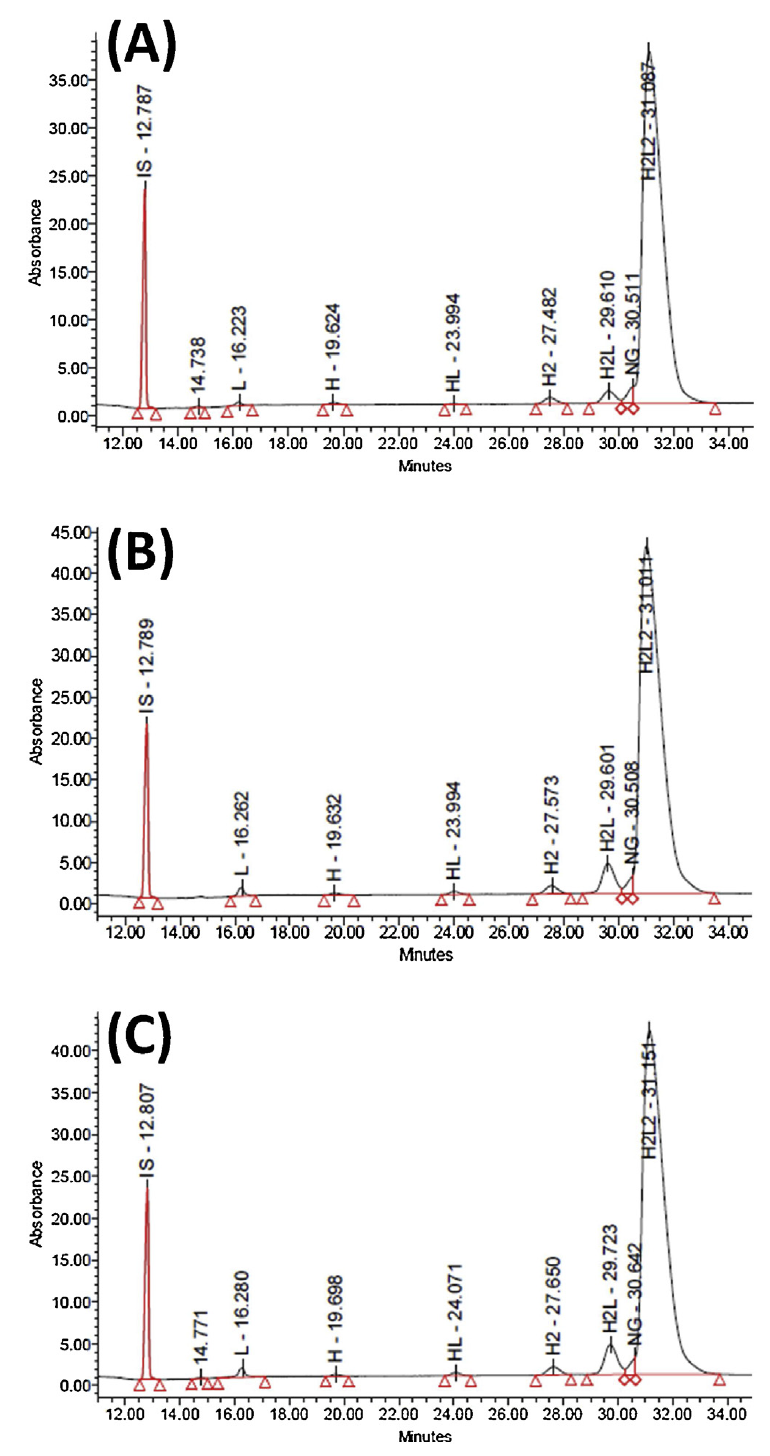
利用Maurice-nrCE-SDS方法,分析三种chIgG1 infliximab单抗产品:原研药Remicade(图a)和两种EU生物仿制药Remsina(图b)和Inflectra(图c)的电泳图。结果显示,每个峰的RMT的显著平均RSD为0.4%,片段相对百分比的平均RSD为2.2%(Remicade)、5.5%(RemSina)和2.3%(Inflectra),且这三个mAb的H2L2含量在92.1%到95.7%之间,总体而言,生物仿制药电泳图在很大程度上显示出相似的碎片模式(其中H2L代表主要的碎片亚基)。并且所有样品除主峰以外的所有相对峰面积的总和始终低于8%,这表明在nrCE-SDS条件下生物相似性评估的在接受的标准。
Maurice-nrCE-SDS测试IgG1亚类(轻链κ和λ)
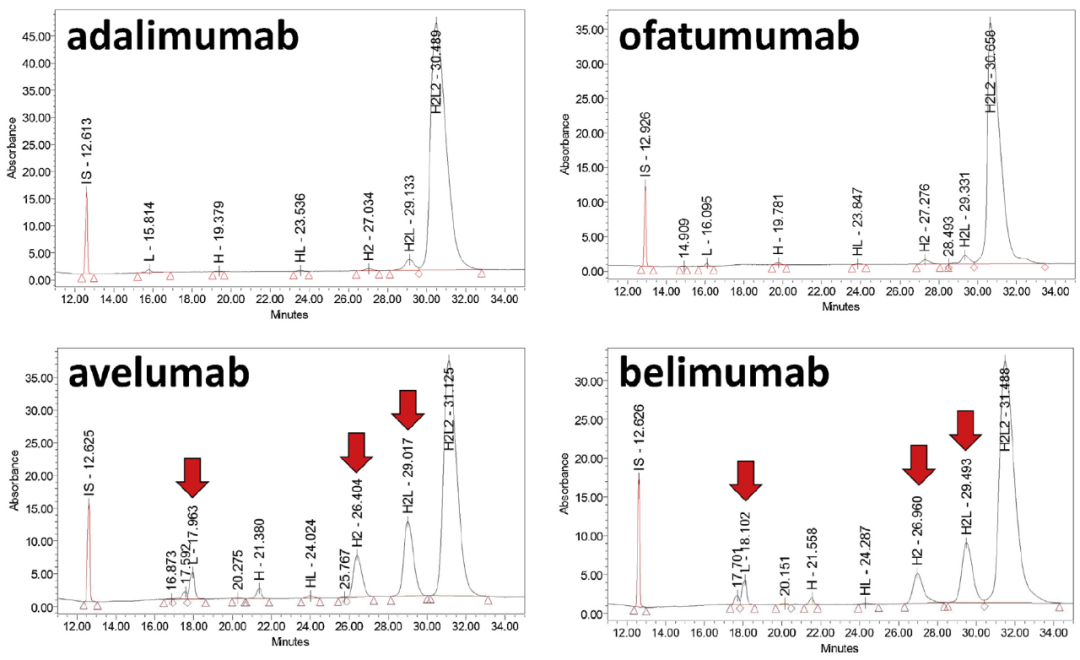
此图显示针对Maurice-nrCE-SDS方法测试的两种huIgG1κ(adalimumab和ofatumumab)和两种huIgG1λ(avelumab和belimumab)的电泳图谱。结果显示,huIgG1κ中H2L2的相对含量等于95.9%(ofatumumab)和96.2%(adalimumab),而huIgG1λ则显着降低,分别为75.7%和69.4%(belimumab和avelumab)。huIgG1κ产物的主要片段为H2L(相对量在2.2%至2.6%之间),而所有其他片段的含量都低得多(0.1%至1.1%之间)。huIgG1λ产品呈现了一个片段化模式:主要亚基由H2L(>13%),H2(>5%)和L(>2%)表示,而其他亚基与HL和H片段的总体趋势一致(HL的0.2%至0.4%,H的0.6%)。其原因在于IgG1末端丝氨酸的存在对链间L-H结合的稳定性有重大影响,使该键弱于链间H-H结合的二硫键。所以H2L、H2和L碎片的相对百分比特别高可能被解释为H-L结合的脆性而导致断裂。因此在分析huIgG1的应用时,样品制备步骤(70°C中出现部分还原))可能需要进一步优化。
Maurice-nrCE-SDS测试IgG2亚类
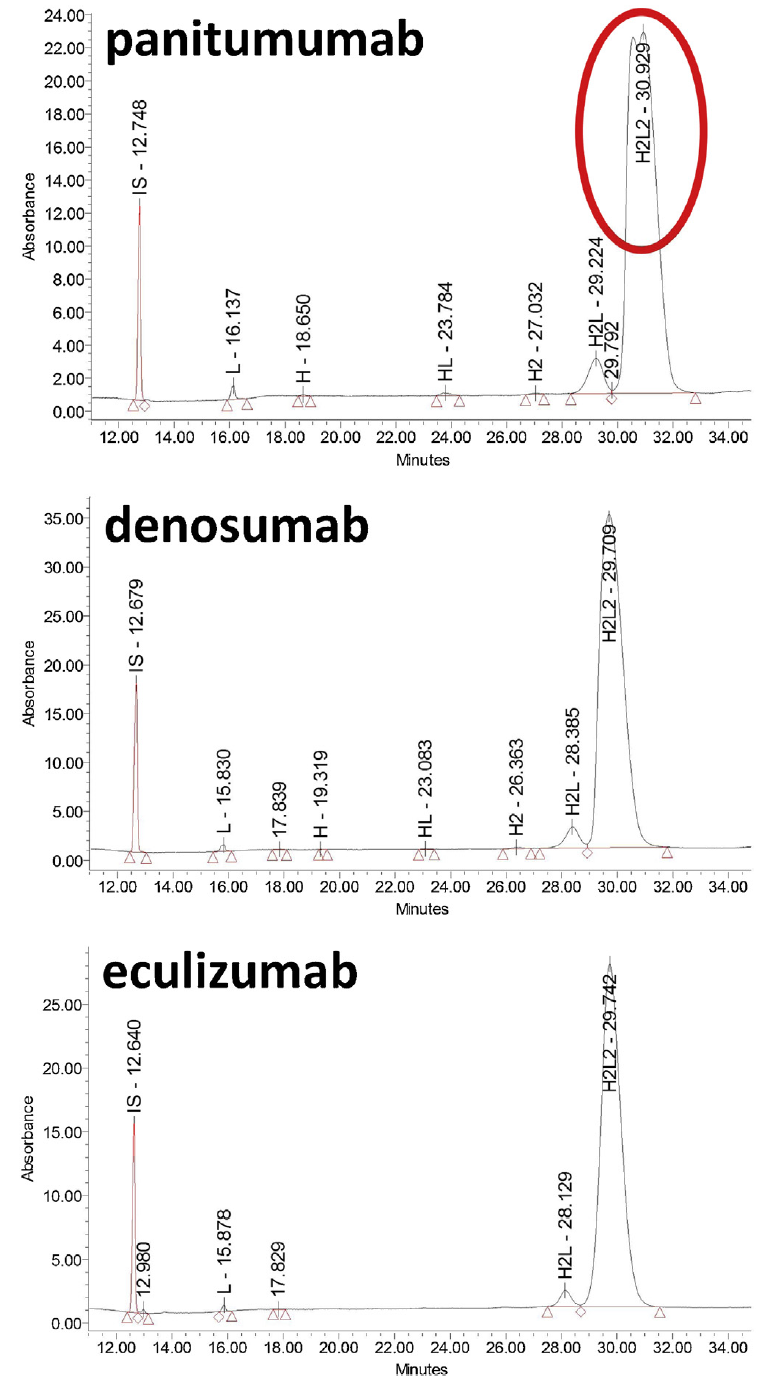
此图显示针对Maurice-nrCE-SDS方法测试的两种人源化IgG2κ(panitumumab和denosumab)和一种人源化IgG2/4κ(eculizumab)的电泳图。同样,该通用方法在不到40分钟的时间内可以直接评估H2L2及其片段的量。结果显示这三种mAb的H2L2含量在94.6%至96.9%之间。其主要碎片是H2L,质量约为125kDa(相对量在2.6%和4.6%之间)。其它片段的含量要低得多(仅在0%至0.5%之间)。其中观察到panitumumab的H2L2峰被分离为双峰,Denosumab虽然在H2L2峰上没有观察到一个双峰,但该峰相当大,而eculizumab仅观察到一个H2L2物质的单峰。原因在于IgG2与IgG1和IgG4不同,其在连接两个重链的铰链区含有四个二硫键桥,因此容易产生二硫键相关的结构异构体。如果需要进一步分析,需要继续优化实验条件。
Maurice-nrCE-SDS测试铰链稳定型的IgG4亚类
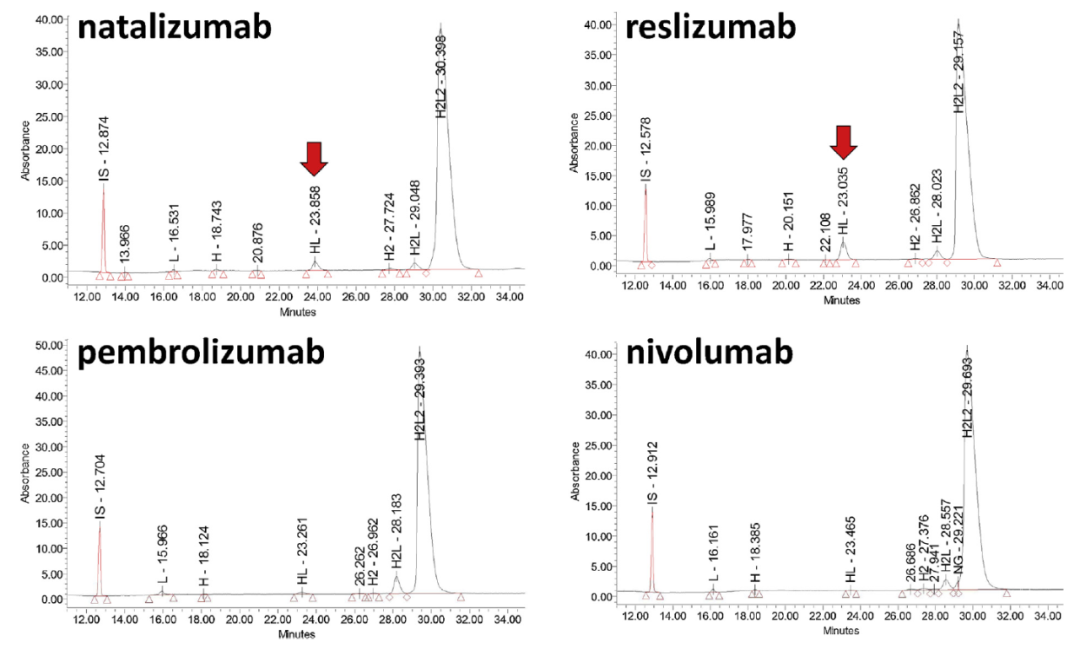
Maurice-nrCE-SDS方法测试了包括两种野生型HzIgG4k(natalizumab和reslizumab)和三种铰链稳定的hzIgG4k(ixekizumab和pembrolizumab)和huIgG4k(nivolumab)生物制药产品。结果显示H2L2种类的数量在93.7%至96.3%之间变化。与其他IgG亚类相似,在这五种产品中发现的主要片段是H2L,质量约为125kDa(相对量在1.6%至3.9%之间),其它碎片含量极低(仅在0.1%和0.5%之间)。与其它治疗性mAb相比,主要差异与%HL有关。其中野生型IgG4分别为natalizumab和reslizumab的HL%异常高,分别等于2.2%和3.9%。其原因在于野生型的IgG4:(I)铰链区相关的灵活性,(Ii)铰链区中两个重链之间相对不稳定的二硫键,(Iii)两个重链的两个CH3结构域之间的非共价相互作用,从而促进了两个IgG4s之间的h-l对交换。尽管如此,Maurice-nrCE-SDS方法仍然轻松评估IgG4亚类产品中分子量变异体的数量,并且只需对电泳图进行目视检查即可快速评估野生型和铰链稳定IgG4之间的差异。
Maurice-nrCE-SDS测试ADC药物
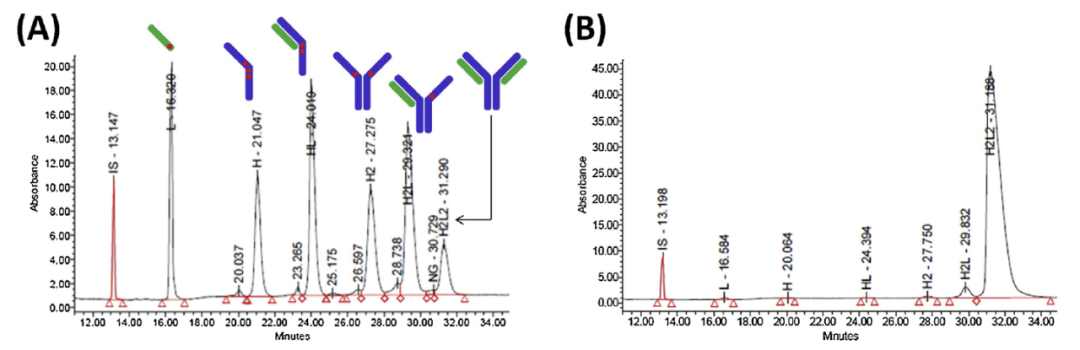
Maurice-nrCE-SDS方法检测了两种第二代ADC的适用性,即铰链半胱氨酸共轭Brentuximab vedotin和赖氨酸共轭Trastuzumab emtansine。ADC药物的特征是具有一定的药物负荷分布(DLD)、药物与抗体比(DAR)和仅由链间静电相互作用维持的H2L2结构。结果显示ADC药物brentuximab vedotin中的8.1%的H2L2与通过HIC或native-MS评估的裸抗体量一致。L(+1接头有效载荷,PL),H(+3LP),HL(+2LP),H2(+2LP),H2L(+1LP)和H2L2可以通过基线分辨率分离。NrCE-SDS虽然不是分析半胱氨酸连接的ADC DLD和DAR的首选方法,但可以用作鉴定方法和批次的一致性。Trastuzumab emtansine是一种赖氨酸偶联的ADC,在赖氨酸共轭的情况下,这些ADC的H2L2结构通过链间二硫键得以维持。因此,nrCE-SDS可以确定和分离单体和碎片,如图所示,所有的L,H,HL,H2,H2L和H2L2均已很好地分开,且H2L2天然单体形式约占96%,与trastuzumab母体裸抗一致。
Maurice-nrCE-SDS应用于药物生产工艺
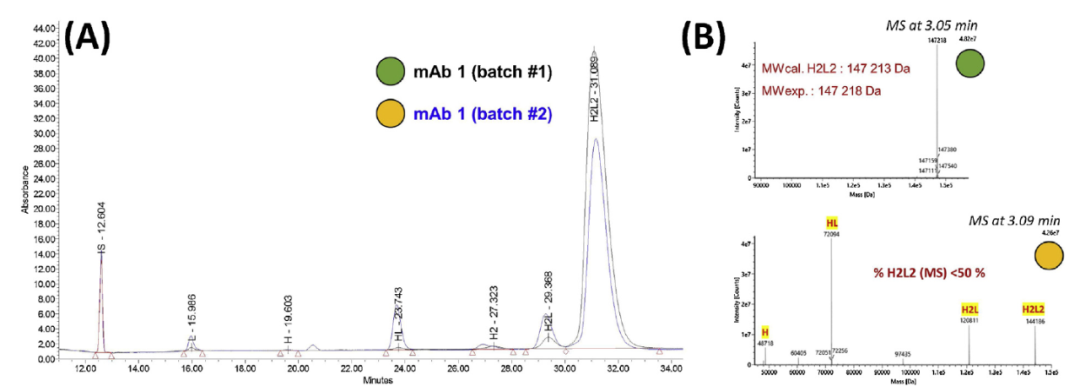
Maurice-nrCE-SDS方法检测了在两种不同培养条件下,在CHO细胞中产生的两个不同批次的相同抗体(HzIgG1k)的nrCE-SDS结果以及质谱鉴定结果。揭示了在大规模单克隆抗体生产过程中,需要优化上游和下游的生产工艺才能解决由于二硫键的部分还原而引起的抗体片段化。而nrCE-SDS与质谱联用是需要在整个药品开发阶段使用。
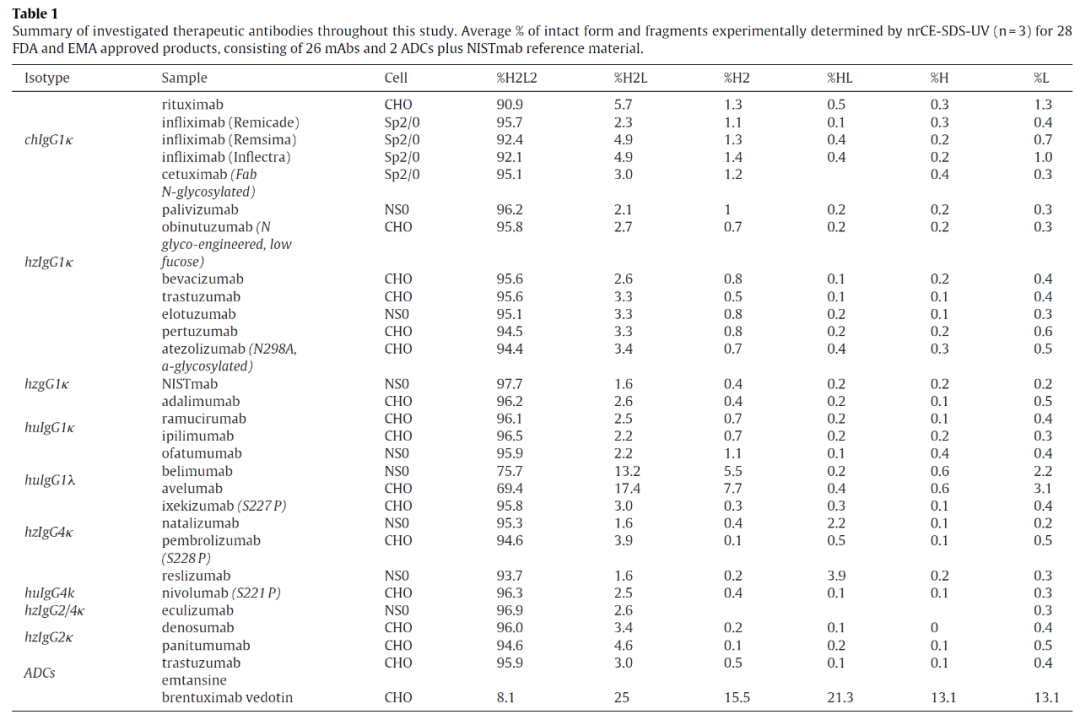
附表(Maurice-nrCE-SDS方法测试26种单克隆抗体(mAbs)和2种抗体药物偶联物(ADCs)结果)

结论:
本研究利用Maurice-nrCE-SDS方法建立了一种通用的nrCE-SDS方法,用于确定具有不同亚型和轻链特异性的多种治疗性抗体的分子量变异体(H2L2和LMW)的适用性。就相对迁移时间和片段与完整mAb的相对百分比而言,Maurice-nrCE-SDS方法重复性极佳。且该方法已成功应用于IgG1,IgG2和IgG4亚类和ADC药物。因此此方法可用于QA/QC环境下生物制药产品的放行、稳定性、批次一致性和保质期评价。


04-30
致敬每一位辛勤的劳动者04-30
实践校企联合 | 院士团队师生到访兰友科技04-30
职业健康,与您同行 | 英盛生物助力《职业病防治法》宣传周04-29
欢迎来到聚合物的神奇世界04-29 Nouryon诺力昂
五一劳动节 | 致敬每一位追光人(内含互动游戏,点击参与)04-29 光电行业都会关注
“劳”有所获 “动”有所乐 | 卓立汉光五一放假通知请查收04-29
如何站在“小巨人”的肩膀上做好质谱产品?——ACCSI2024访衡昇质谱(北京)仪器有限公司总经理祝敏捷04-29
探索国产自主创新 | 国科大杭州高等研究院师生一行到访谱育科技参观学习04-29 点击关注→
热点应用丨“小”花粉“大”奥秘—RMS1000带你解密花粉热(下)04-28 天美
仪器推荐丨一体化全自动显微共聚焦拉曼光谱仪 RM504-28
仪器推荐丨科研级模块化显微共聚焦拉曼光谱仪RMS100004-28
HyperQuant与您一起破解呕吐毒素之谜04-28
用户速递 | 酸碱度对混合SOA 代理物-无机气溶胶液滴液-液相分离的影响04-28 光电行业都会关注
“元素分析自动化创新的一大步”---ACCSI 2024衡昇质谱展示革命性创新产品04-28 衡昇质谱
In China, For Global|微纯生物科技参加LAB-Indonesia 202404-28
中关村论坛之高端仪器创新,天隆智造再获殊荣04-28
天隆产品说丨天隆方案为动物健康保驾护航04-27
世界兽医日 | 与他们共同守护动物健康04-27
政策响应丨奥谱天成显微拉曼光谱仪重磅来袭!所有ATR8300用户免费升级04-26