”计算机化系统验证 CSV 法规解析及应对策略“,6 月 27 日开讲啦!
2018-11-10 10:52:03, 安捷伦 LED 团队 安捷伦科技(中国)有限公司

CFDA 2010 版 GMP 法规的新附录之一《计算机化系统》(Computer System Validation,以下简称 CSV)是制药企业必须遵守的指南,随着该法规的发布以及监管部门对制药企业监管力度的不断加强,大部分的制药企业不对计算机化系统进行验证或者仅仅是做一些简单的确认已经不能满足法规的要求。其中,新修订的《计算机化系统》附录、《确认与验证》附录更是对制药企业提出了更高的要求,然而很多人对什么是计算机化系统,什么是计算机化系统验证等方面仍然不够清晰,对如何为实验室搭建全面的合规体系更是无从谈起。
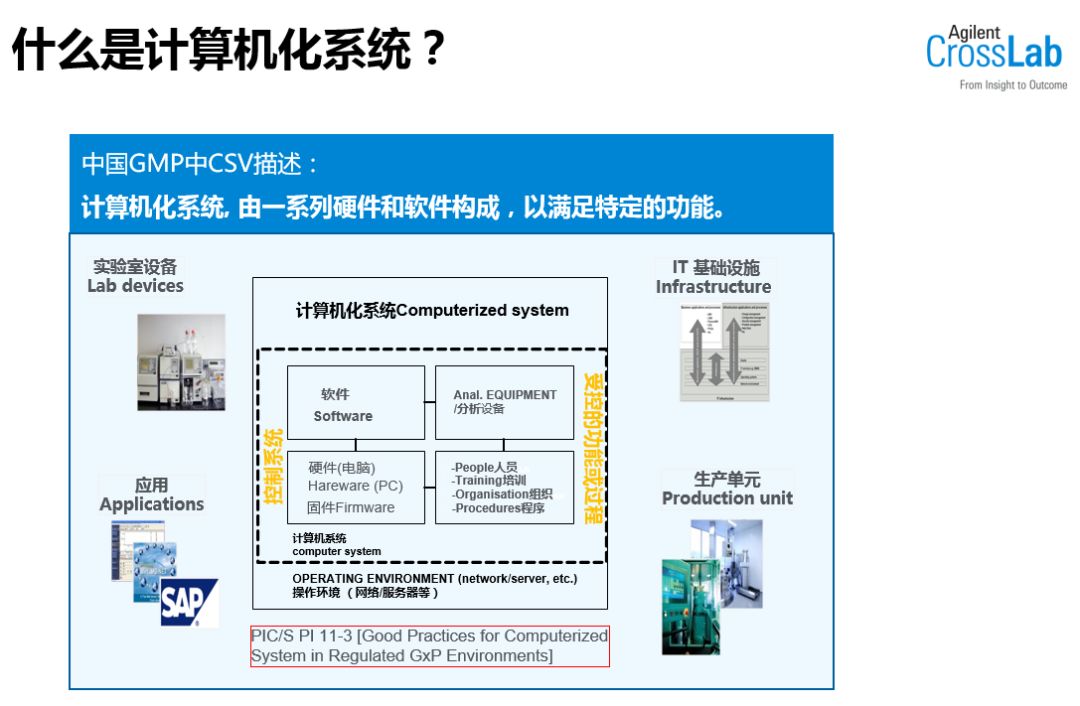

《计算机化系统》附录需要制药企业
基于风险-质量风险管理要贯穿系统生命周期全过程;
基于学科对流程和产品充分理解;
采用软件分级管理的策略;
基于质量体系-有效质量体系下实施计算机化系统(及电子数据)管理;
基于生命周期-在整个生命周期内保持计算机化系统验证受控状态等。
此外还包含了国际制药工程协会(ISPE)GAMP5 良好自动化生产实践指南中的一些知识观点:例如供应商审计、物理的和逻辑的防护、权限管理、审计跟踪、电子数据的备份与恢复、应急及突发事件管理等。
事实上,《确认与验证》附录的颁布对我国制药行业提出了更高的要求, 中国正在通过法规拉近国内制药企业同欧美等发达国家和地区的差距。

所以对制药企业而言针对 CSV 的计算机系统合规体系建设已经刻不容缓,你还在为如何应对而感到困惑嘛?安捷伦邀请到全球合规投资顾问 Michael Korbel 和中国实验室合规项目经理方敏为您详细解析计算机化系统验证 CSV 法规解析及应对策略。


05-21 Criron——谱临晟
仪器优势丨CP8400自动进样器在脂肪酸甲酯双通道测试中的优势05-21 天美色谱
Cytiva与丹纳赫生命科学携手亮相第二十三届中国生物制品大会05-20
【会议邀请】微纯生物科技邀您参加“CIS-Asia 2024 第十六届百世化学制药国际大会暨展览会”05-20
热点应用丨prepASH在饲料领域的应用05-20 天美
热点应用丨如何实现饲料快检——prepASH全自动水分灰分分析仪05-20 天美
热点应用丨药品快检好帮手之中药分析——prepASH全自动水分灰分分析仪05-20
热点应用丨prepASH在食品领域的应用——灰分检测05-20 天美
热点应用丨prepASH在食品领域的应用——水分检测05-20 天美
名家专栏 | 量子理论系列—量子理论的产生与发展05-20 光电行业都会关注
会议预告 | 质在精准,谱于“英”用 —— 临床质谱“专家云讲堂”肿瘤人群精准营养专题05-20
成都科林分析诚邀您参加2024年深圳市分析测试协会年会05-20
【仪器百科】LS-909丨干湿二合一激光粒度分析仪05-20 欧美克仪器
提高检测效率 | 复杂工件编程的自动化解决方案05-20
TIDES学术海报|30μm硅胶填料在GLP-1及其类似物分离纯化中的应用05-18
释放你的血管年轻活力05-18 医疗中心
昨天(世界高血压日)、今天(全国血管健康日)和未来(共创无界关爱)05-18
创新突破,精准提取——镁伽质粒小量抽提仪震撼上市!05-17
“你拍一,我拍一,火车上有了CT机”,开往无界创新的关爱专列05-17
5月20日长沙理工大学站丨【光谱梦工场-生态学与遥感技术研讨会】诚邀莅临!05-17 奥谱天成Optosky