自动化水镜系统配套高内涵成像显著提高复杂生物学检测的精度和成像质量
2020-08-22 00:24:57, 美谷分子仪器 美谷分子仪器(上海)有限公司

本文的研究目的是确定在复杂生物测定中,使用水镜成像提高图像质量的同时是否可以应用于高通量场景。

本文涉及的所有测试均在 96/384 孔板或市售的单器官芯片板中进行。研究中使用空气镜或水镜的实验流程包括样品的激光自动聚焦等环节保持相同。研究发现,通常在相同信噪比的条件下,使用水镜可以明显缩短曝光时间;因而,基于成像过程中荧光通道数量、荧光强度以及样品是 2D 成像还是 3D 成像等不同条件,整板成像的时间最高可比标准空气物镜的快 30%。此外,在需要注水之前,使用水镜可以对多达数百个样品板成像。
+
水镜与空气镜的比较实验如下:

•使用鱼藤酮和氯喹处理得到剂量反应曲线,并进行线粒体融合和膜完整性评价。
•化合物处理 HCT116(结肠癌细胞)后,对细胞球生长情况进行评价并计算细胞死活率。
•用血管生成抑制剂处理后,于单器官芯片上培养复杂的 3D 血管生成样品,并采集图像数据。
此外,我们用低倍镜对整个微孔板成像,识别感兴趣的稀有个体后,可以再使用高倍的水镜自动重新成像。
+
材料和方法:

实验模型:
• 实验耗材:
Corning® spheroid microplates (384 well format)
Mimetas OrganoPlate® 3-Lane
InSphero Akura™ 384 well plate
Greiner SensoPlate™ - 96 and 384
• 细胞:
3D InSight™ 肿瘤微组织(InSphero)
HUVEC(人类原代内皮细胞)
HCT-116(人类结肠直肠癌细胞)
Caco-2(人类结肠直肠癌细胞)
PC-12(大鼠神经母细胞瘤细胞)

高内涵成像系统 ImageXpress Micro Confocal 及其水镜系统

图 1
比较 20X 0.75NA 空气镜和 20X 0.95NA 水镜的细胞球重构侧视图表明,由于降低了球面畸变,图像质量得到了明显改善。水的折射率与样品所悬浮介质的折射率更接近,因此位于平板底面上方 > 300 um 肿瘤球体的图像可以更准确地反映细胞和整个球体的形态特征,而不会出现z轴的拉伸现象。此外,使用水镜(FITC波长)产生相同的信号强度只需要相对空气镜 1/3 的曝光时间。
+
结果:

线粒体完整性和融合测定
线粒体的形成和完整性的表征对于理解疾病的机制和毒性评估很重要。线粒体的长度、亮度和数量会在线粒体循环、代谢变化或凋亡过程中发生变化。成像后光强度和线粒体形状可以通过使用 Meta Xpress 软件中的工具来确定,该工具可以通过用户自定义标准来测量“颗粒度”,“纤维数”或“自定义区域数”等指标,这些指标可以用于计算各种化合物的剂量效应和有效浓度。

图 2
用氯喹(线粒体循环抑制剂)和鱼藤酮(氧化磷酸化抑制剂)在指定浓度下处理 PC12 细胞 24 小时。用 MitoTracker Orange CMTMRos(黄色)和 Hoechst(未显示)染细胞,用 40X 水镜和非水镜分别拍摄图像(A),使用 MetaXpress 软件处理数据,分析确定“颗粒度”(左)或“纤维数”(右)(B),自定义区域模拟图层显示了完整的颗粒、纤维或区域定量(C),计算 EC50(四个复孔),水镜可以提高图像质量,更准确地计算颗粒数,从而获得更高的 Z 值(D)。
器官芯片
水镜提高了物镜附近 2D 表面不平整的样本分辨率和球形度。这在做 3D 模型成像(尤其是器官芯片样本)时具有优势。我们使用水镜以 OrganoPlate 3-Lane 模式对芯片上肠道和血管生成模型进行成像。
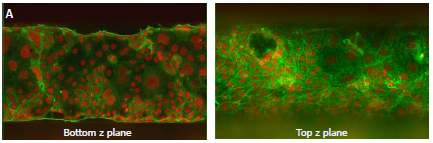
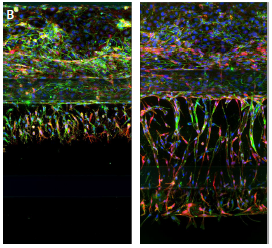
图 3
以 Mimetas 提供的方案培养 Caco2 细胞,形成完整的肠管模型。用 Hoechst 和 AlexaFluor-488 耦合的鬼笔环肽对细胞进行染色,并在整个管路中拍摄Z轴层扫共聚焦图像。(A)使用40倍水镜成像的细胞底层(左)和顶层(右)。(B)拍摄鬼笔环肽-AlexaFluor 555、Hoechst 和抗 VE 钙黏着蛋白染色的 HUVEC 细胞的血管生成模型,用 20X 水镜采集 50 个 z 轴的 2D 投影显示未处理的细胞(右)和抗血管生成化合物处理的细胞(左)。
3D 筛选(quick ID、靶点成像)
通常,有多种用以筛选抗肿瘤药物的培养细胞球的方法。在某些拍摄过程中,椭球体并非始终位于孔的中心,这可能使得镜头很难以高放大倍数在单个视场(FOV)中获取感兴趣的对象。QuickID 允许我们使用 20X 的水镜对 FOV 中心的每个球状体进行自动成像,以收集多个通道的 Z 轴层扫图像,而无需获取额外的位置信息。

图4
用 10 倍物镜执行 QuickID,快速对整个微孔板成像。然后识别出球形物体,并使用其 X,Y 坐标自动获取在多个通道和 z 轴的 20X 水镜中包含肿瘤显微组织的位置。通过图像分析来寻找和测量三维卷积的样本。
对细胞球活力的定量测量
3D 肿瘤模型越来越多地用于癌症研究。在此示例中,我们使用从 HCT116 结肠癌细胞培养形成的 3D 球体,通过计算细胞死活率来评价药物对细胞球体的毒性作用。

图5
用 HCT116 细胞(4000个)在 U 型底 384 孔板中的培养形成细胞球体。抗癌化合物处理细胞球48小时,然后用 Hoechst 和 EthD-1 染色3小时(A)。使用具有 20X 物镜的共焦选件对孔板进行成像(水镜或者非水镜(B)),将 11 张间隔 10um 的图像进行z轴堆叠,然后使用核计数或自定义模块编辑器分析最大投影图像。统计细胞核或活细胞的数量来定量 EC50 进而研究化合物的性质。由于对整个球体中细胞的计数更加精确,使用水镜会得到更大的 Z 值。
结论
•水镜非常适合标准微孔板或单器官芯片形式的自动化成像分析。
•如果在采集过程中使用了水镜,则距板底 100 um的物体的球面像差会降低。
•在 384 孔板中进行2色分析时,使用水镜的图像采集时间最多可减少 30%。
•在复杂的生物学检测中,使用水浸镜头成像使图像质量以及数据质量得到了改善。

每周五下午 5 点与您相见
好玩的、划算的、有用的、前沿的
帮助您获取生命科学研究及药物研发全方位的解决方案
产品覆盖微孔板检测分析、高通量筛选、
高内涵成像、高效克隆筛选等。

我知道你在看哟

03-08 Opentrons
Opentrons 华东区销售经理热力招募,亟待有识之士,共享行业先机!03-08 Opentrons
邀请函 | 高砂电气CACLP2024参展通知03-08 高砂电气
哈克(HAAKE)旋转流变仪在皮肤外用制剂上的应用(文末有惊喜)03-08
仪器租赁 | 赛默飞 气质联用,月租金13220元起03-08
璀璨如你,自成光芒03-08
实验室常见不良习惯揭秘,你中了几个?03-08 实验与分析
【邀请函】东西分析仪器邀您共聚CACLP03-08
活动回顾|东西分析亮相CHINA LAB 2024 展会03-08
3.8国际妇女节 | 致敬每一位“她”03-08
致敬不被定义的她 | 福立仪器祝所有女同胞们节日快乐!03-08 福立仪器
妇女节 | Wǒmen,做自己的样子真美!03-08
短/中链氯化石蜡暴露与妊娠期糖尿病患病风险关系研究03-08
心有光芒,芳华自在,致敬“她力量”03-08
专业解读|一文搞定CAR-T 细胞产品的非临床研究!FDA指南解读系列03-08 生物医药市场部
技术问答|污染看得见?解密荧光PCR如何控制污染,提高灵敏度!03-08 生物医药市场部
产品质量鉴定大揭秘:判定依据竟然有这些?!03-08 微谱产品质量鉴定
干活分享|关于稳定性测试方法与要求的探讨【附资料包】03-08
节日祝福|微谱祝福大家女神节快乐03-08
3.8妇女节快乐|万般姿态 不被定义03-08