热门通路解析丨一文了解Hippo信号通路前沿研究
2024-05-11 14:20:49, 助力药物研发的
近年来文章频出的Hippo 信号转导通路到底隐藏着些什么样的奥秘?来,搭上T仔号文献列车,出发~
背景介绍
Hippo 信号通路,又称“河马通路”,是最早在黑腹果蝇中发现的一条与发育相关的信号通路,其名称来源于通路中的关键成员—— Hippo蛋白激酶,至今已有 20 年的研究历史。
该通路由一系列保守的激酶组成,在多种生物体中通过调控细胞增殖、凋亡、干细胞自我更新,参与组织发育、组织稳态维持以及再生修复等多项生物学功能。
而 Hippo 通路的失调则会导致肿瘤细胞的发生、侵袭、迁移、治疗耐药以及心脏病、肝病、肺病和免疫功能障碍等种种疾病的发生。
Hippo 通路关键组成
在哺乳动物中,Hippo 通路由几个关键成分组成,包括:
◆ 哺乳动物 STE20 样激酶 1/2 (MST1/2)
◆ Salvador 同源蛋白 1 (SAV1)
◆ MOBKL1A/B (MOB1A/B)
◆ 大肿瘤抑制激酶 1 /2 (LATS1/2)
◆ Yes 相关蛋白 1 (YAP)
◆ 含有 WW 结构域的转录调节因子 1 (TAZ)
◆ 转录增强相关结构域家族 1 (TEAD1)
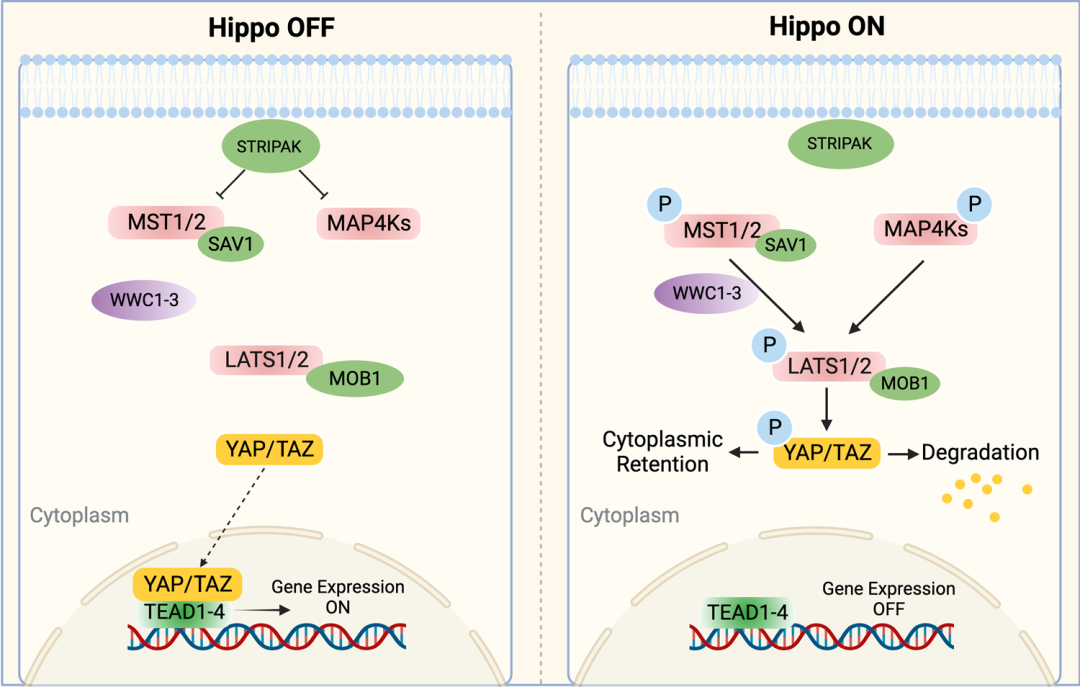
▲ 哺乳动物的核心Hippo通路
通常,STRIPAK (Striatin-interacting phosphatases and kinases) 复合物在MAP4Ks (Mitogen-activated protein kinase kinase kinase kinases) 和 MST1/2 的上游起作用并抑制 Hippo 途径。
然而,当 Hippo 途径被激活时, MST1/2 、 MAP4Ks 及其支架蛋白 SAV1 会磷酸化 LATS1/2 及其支架 MOB1A/B 。被激活的 LATS1/2 磷酸化并抑制 YAP 和 TAZ ,阻止它们转移到细胞核中与 TEAD 1-4 相互作用。
◆ 作为丝氨酸/苏氨酸激酶, MST1/2 或 MAP4K 蛋白的活性可以通过其 C 端的 SARAH (Sav/Rassf/Hpo) 结构域与支架蛋白 SAV1 形成复合物来增强。
有研究表明, MST1/2 能通过作为支架蛋白的 WWC 蛋白 (WWC1/2/3) 促进 MOB1A/B 和 LATS1/2 之间的结合。而 MAP4K 家族蛋白则被报道无需 SAV 即可参与 LATS1/2 的激活。这三种蛋白质的联合消耗已被证明会极大地阻断下游信号传导。
因此, MST1/2 或 MAP4K 蛋白的激活被认为是 Hippo 通路的起始信号。
◆ LATS1 和 LATS2 是 AGC 激酶家族中的丝氨酸/苏氨酸激酶。在被激活后,它们直接与下游 YAP/TAZ 交互。这种相互作用可能由 YAP/TAZ 上的 WW 结构域和 LATS1/2 上的 PxY 基序介导。
种种证据表明,被激活的 LATS1 和 LATS2 磷酸化以及被抑制的 YAP 和 TAZ ,是Hippo 通路的主要下游效应子。
YAP/TAZ 是与 TEAD1-4 结合的转录共激活因子,可调节多种介导细胞增殖、凋亡和干细胞自我更新的基因的表达。
◆ 当 Hippo 通路被激活时,YAP/TAZ 的活性通过 LATS1/2 介导的磷酸化被抑制。
◆ 当 Hippo 通路失活时,去磷酸化的 YAP/TAZ 易位进入细胞核并与转录因子 TEAD1-4 结合以诱导基因表达。
TEAD1-4 可以通过招募退化样家族蛋白 (如 VGLL3 43 和 VGLL4) 作为转录抑制因子。这些因子竞争性结合 TEAD 和 YAP/TAZ 并导致转录沉默。
然而, YAP/TAZ 和 TEAD1-4 异常激活会导致该途径其他组分的激活,从而引起各种疾病的发生。
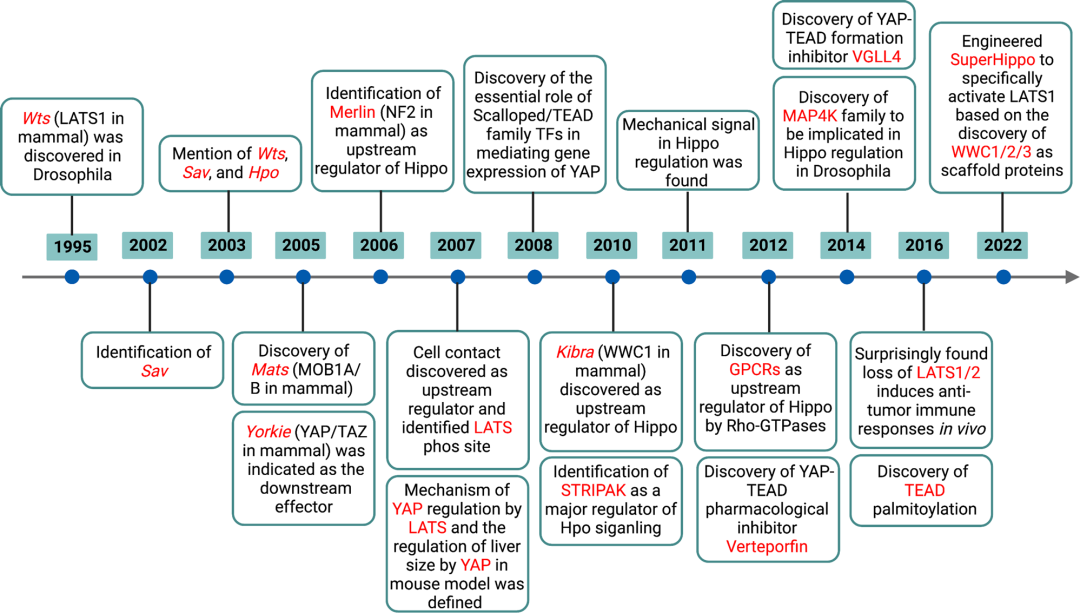
▲ Hippo 途径的主要发现和过程的时间表
Hippo 通路上游信号
作为进化上保守的信号网络,Hippo 通路在众多生物过程的调节中发挥着至关重要的作用。
与此同时,还有多种上游信号,如细胞极性、机械信号、细胞密度、可溶性因子和应激信号,参与 Hippo 通路的调节。

▲ Hippo 上游信号的五个亚组与每个亚组的详细信息
细胞极性
Cell polarity
细胞极性是指与细胞形状和结构有关的不同空间特征。通常分为两种类型:顶-底极性 (AP) 和平面细胞极性 (PCP),两者互相垂直。
1. 顶-底结构域或细胞连接复合物中许多蛋作为上游信号调控 Hippo 通路
在果蝇中,定位于顶端结构域的肿瘤抑制因子 Mer/NF2 (Merlin/neurofibromin-2) ,通过连接肌动蛋白细胞骨架与质膜,促进 Hippo 激酶的募集并参与 Hippo 通路的激活。此外, Mer/NF2 的翻译后修饰,如 NEDD4L 介导的泛素化,也被证明是 Lats1 的激活所必需的。
在哺乳动物中, NF2 缺陷小鼠的白内障形成表型可以通过 YAP 基因的消耗来抑制。在小鼠心肌中, YAP 的表达水平在心肌细胞特异性 NF2 敲除小鼠的心肌细胞中上调。而 YAP 耗竭会降低心肌细胞特异性 NF2 敲除小鼠对 I/R 的保护,提示 NF2 对 YAP的调控作用。此外,基底结构域膜蛋白 Scrib (Scribble) 的抑制,会在果蝇中引发由 Yki 介导的细胞迁移增强。Scrib 和 YAP 之间的相互作用还会诱导癌症相关表型,抑制 YAP 的活性。
2. 物理分离顶-底结构域的细胞连接蛋白作为上游信号调控 Hippo 通路
血管动蛋白家族 (AMOT、AMOTL1 和 AMOTL2) 对于紧密连接和细胞极性至关重要。AMOT 蛋白可作为 LATS1/2 的支架,促进 MST1/2 对 LATS1/2 的磷酸化。此外,AMOT 还促进 LATS1/2 和 YAP 之间的连接,在YAP 的激活中起到重要的作用。α-Catenin 是 E-钙黏素-连环蛋白复合物的重要组成部分,其功能对于粘附连接的完整性至关重要。α- Catenin 可以抑制 YAP 的核定位。这种抑制作用与 α-Catenin 的肿瘤抑制作用有关。闭锁小带蛋白 (ZO-1、ZO-2、ZO-3) 是一种为紧密连接提供结构基础的支架蛋白,ZO-2 的沉默会激活 YAP 并导致肾肥大。
3. PCP作为上游信号调控 Hippo 通路
PCP受到参与 Hippo 通路调节的原钙粘蛋白 (Ft) 和 Dachsous (Ds) 的调节。Ft-Ds 系统作为 Hippo 通路的配体-受体对发挥作用。研究表明, Ft-Ds 系统对 Hippo 通路的调节作用受 Ds-Fj 梯度的陡度调节。较浅的梯度会激活 Hippo 通路,但较陡的梯度会抑制 Hippo 通路的活性。Dachs 是脂肪的重要下游效应器,在 Hippo 通路的调节中起关键作用。Dachs 可以通过与 Mats 竞争结合疣来影响 Hippo 途径的活性。
机械信号
Mechanical cues
机械信号是细胞感知微环境中十分重要的信号。通过机械转导系统,细胞可以将机械信号转化为生化信号来控制它们的行为。
早在 2011 年, Sirio Dupont 等人的研究就揭示了 YAP/TAZ 在机械转导系统中的重要作用。这一发现表明 Hippo 通路与机械信号之间存在紧密联系。
通过 Hippo 通路,细胞感知并响应机械信号,例如细胞外基质 (ECM) 刚度、细胞几何形状、液体流动力、张力和附着。这些机械信号通过 Hippo 途径对细胞的增殖、存活和分化产生强烈影响。
ECM 刚度的变化是一种重要的机械信号。据报道, Ras 相关的 GTPase RAP2 可被低ECM 刚度激活,从而导致 LATS1/2 的激活。此外, Agrin 作为一种 ECM 蛋白多糖,可与脂蛋白相关受体 4 (Lrp4) 和肌肉特异性激酶 (MuSK) 结合,通过中断 Merlin 和 LATS1/2 的功能将基质刚性信号传递给 Hippo 通路。Tenascin C 蛋白的异常表达会导致 ECM 粘附力的抑制和 Hippo 通路的激活,从而促进新骨的形成。
细胞几何形状的变化也会影响 Hippo 通路级联的活性。YAP/TAZ 倾向于定位于具有矩形形状的小鼠成肌细胞的细胞核中。细胞的几何形状可以通过调节 Hippo 通路的活性来影响 YAP/TAZ 的分布。此外,在 NIH-3T3 小鼠胚胎成纤维细胞中,发现了类似的几何介导的 Hippo 通路调节。在扁平扩散细胞中,YAP积累于细胞核,而在圆形紧凑细胞中,YAP 则定位在细胞质中。
液体流动力是调节Hippo通路的另一个上游机械信号。人体体液中有很大一部分是流动的液体,如血液和淋巴液。因此,许多细胞受到不同程度的液体剪切应力。而 Hippo 通路是细胞对液体剪切力作出反应的一个渠道。流体流动的增加会促进 YAP 的表达,并与间充质干细胞 (MSCs) 中的成骨和脂肪生成减少有关。在软骨细胞中,流体流动的增加也会促进 YAP 的表达并导致去分化。
细胞骨架张力和细胞-细胞附着也与 Hippo 通路的上游调节有关。几种调节蛋白,如 Rho、Jub 和 Ajuba LIMD1 ,参与了从细胞张力和附着到 Hippo 通路的传递。其中, Rho蛋白 参与调节细胞附着诱导的 YAP 去磷酸化,并在 Hippo 通路的细胞附着依赖性调节中起关键作用。Jub 蛋白可通过调控与细胞骨架张力有关的 Yki 的活性来对疣进行负反馈调控。Ajuba 家族蛋白 LIMD1 和收缩蛋白 Spectrin 参与的则是细胞骨架张力介导的 Hippo 通路变化。
细胞密度
Cell density
由于细胞-细胞接触效应,细胞增殖率往往与单层培养的细胞密度呈负相关。
有研究表明,哺乳动物细胞的高度融合会导致 LATS 的激活以及 YAP 的磷酸化和失活。而YAP 的过表达能逆转细胞密度诱导的生长抑制,表明 YAP 在细胞接触抑制中的关键作用。
然而, Hippo 通路受细胞密度调节的机制尚未完全阐明。迄今为止,已有几种复合物与蛋白质被报道,作为传感器将细胞密度信号传输至 Hippo 通路。包括 Crumbs 复合物与 YAP/TAZ 相互作用并促进其磷酸化、细胞表面肿瘤抑制因子 KIRREL1 通过感知细胞-细胞相互作用,介导 SAV1 募集到细胞-细胞接触位点,在哺乳动物细胞中充当 Hippo 通路的反馈调节剂、细胞密度调节 TEAD 的棕榈酰化。以及其他其他细胞密度递质,如 E-钙粘蛋白(E-cadherin),膜联蛋白A2(annexin A2)和极性调节激酶 PAR1b。
可溶性因子
Soluble factors
可溶性因子对于很多生物和生理过程具有调控作用。其中也有一部分影响着 Hippo 途径的活性。
G 蛋白偶联受体 (GPCR) 是哺乳动物可溶性因子中最大的膜受体家族。而 Hippo 通路也受到 GPCR 信号传导的调节。GPCR 配体,如凝血酶或溶血磷脂酸 (LPA) 可以激活成纤维细胞中的 YAP 并使它们对 TGF-β1 敏感。1-磷酸鞘氨醇 (SIP)可以诱导YAP的核定位,促进YAP靶基因在小鼠胚胎细胞和肝细胞中的表达。
除 GPCR外,还有一些可以影响 Hippo 途径的可溶性因子,如IL-17A 可以在 HaCaT 和 NHEK 细胞中诱导 MST1 的募集,从而抑制MST1-LATS1 的相互作用,导致 YAP 去磷酸化,促进银屑病中的细胞增殖。糖皮质激素可通过提高纤连蛋白的表达,激活人乳腺癌中细胞骨架依赖性的 YAP。转化生长因子-β (TGF-β) 可以通过 p38 和 MRTF 介导的信号传导调节 Hippo 通路。
应激信号
Stress signals
细胞应激,如缺氧、内质网 (ER) 应激、能量应激、渗透应激或热应激,可以作为 Hippo 通路的上游信号,调节细胞的行为、存活和代谢。
缺氧是细胞氧气供应有限的应激情况。据报道,缺氧对 Hippo 途径的调节是由 Zyxin、 SIAH2 泛素 E3 连接酶和缺氧诱导因子 1 亚基 α (HIF-1α) 介导的。在上皮性卵巢癌细胞中, 1% O2或缺氧模拟会下调 YAP 磷酸化,但上调 TAZ 磷酸化。
当细胞暴露于不稳定或不利的环境时,内质网中错误折叠的蛋白质的积累会诱导 ER 应激。在人类肝细胞癌细胞中,ER 应激已被证明可通过促进 GADD34/PP1 复合物的组装来抑制 YAP 的活性并增强细胞凋亡。
能量应激的特征是细胞能量稳态的破坏。AMP 活化蛋白激酶 (AMPK) 作为能量传感器可以诱导 AMPK 依赖性 Lats 激活并导致 YAP 的磷酸化。
梨糖醇处理引起的渗透胁迫可以诱导 YAP 激活和抑制之间的动态平衡。如诱导 YAP 在 Ser128 位点被 Nemo 样激酶 (NLK) 磷酸化,干扰其与 14-3-3 的结合,导致 YAP 核积累和激活。以及通过 Ser127 位点的磷酸化抑制 YAP、改变 4,5-二磷酸磷脂酰肌醇的细胞膜分布 [PI( 4,5)P2],使得质膜募集神经纤维蛋白 2 (NF2),激活下游的 Hippo 通路。
热应激作为 Hippo 通路的重要上游信号之一。可通过与 HSP90 和 PPP5 相互作用抑制 LATS 激酶,从而激活 YAP/TAZ 以诱导热休克转录组。
Hippo信号通路失调相关疾病与治疗靶点
Hippo 信号通路作为控制细胞增殖、分化和生存的信号通路,在器官的发育和稳态中发挥着至关重要的作用,其失调会导致包括癌症、眼病、心脏病、肺病、肾病、肝病和免疫功能障碍在内的多种疾病。

▲ Hippo通路失调引起的疾病总结
由于与多种疾病的密切联系,Hippo 通路已被纳入热门治疗靶点的研究范畴。但由于该途径的历史相对较短,目前尚未有专门针对 Hippo 途径的药物上市。
不过别急~还有不少在开发中的临床前(表1)和临床试验(表2)阶段潜在 Hippo 靶向药物,T仔已经列在下方啦,
表1 临床前阶段靶向 Hippo 通路的潜在药物
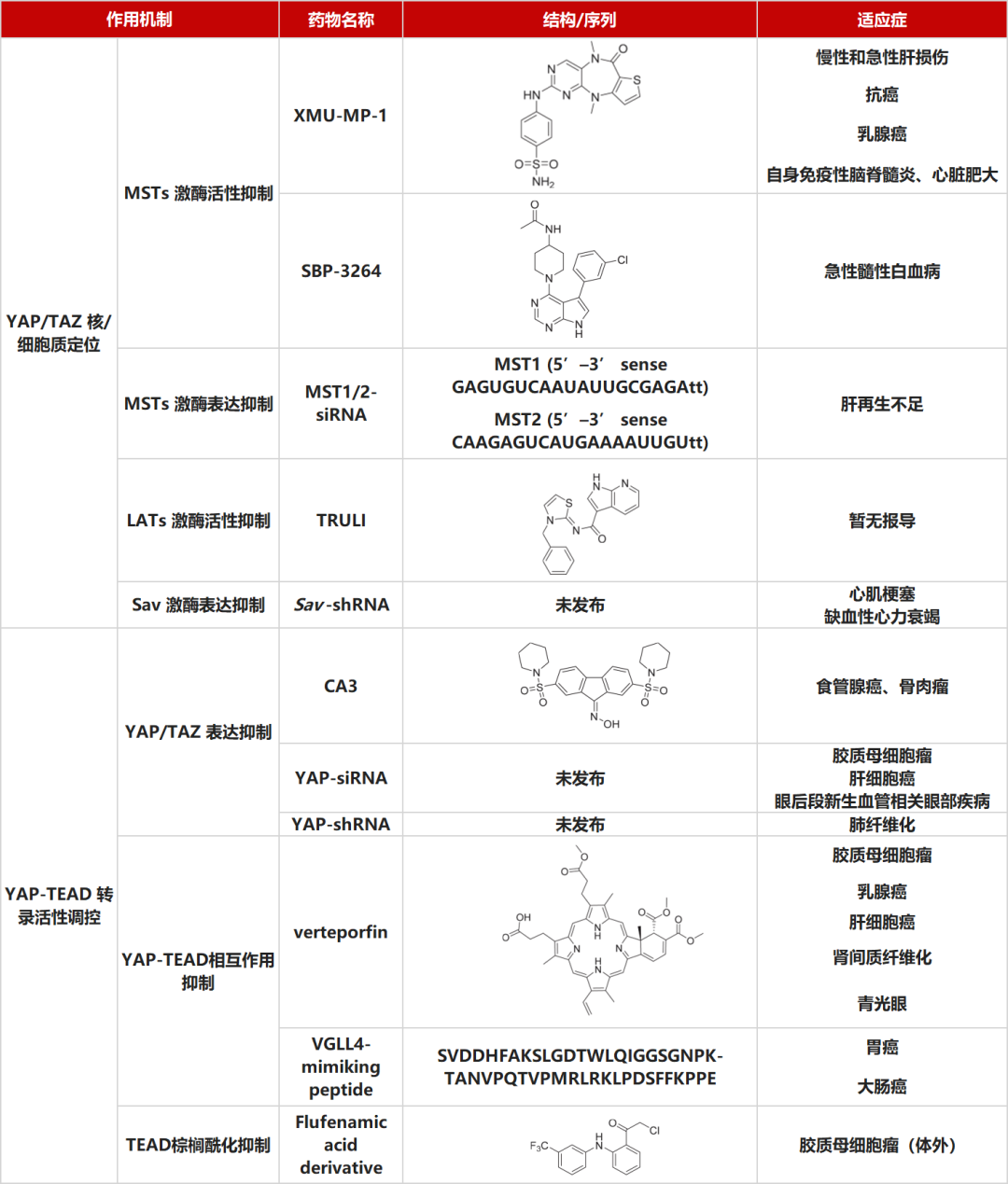
向下滑动查看👇
目前,潜在药物的开发主要集中在 Hippo 通路的三个方面,包括 Hippo 核心激酶活性/表达、下游 YAP/TAZ 表达水平和 YAP/TAZ-TEAD 相互作用。
Hippo 核心激酶抑制 YAP/TAZ 以控制其位置并随后影响 Hippo 靶基因的表达。而当 YAP/TAZ 易位进入细胞核时,Hippo 相关基因的转录和表达依赖于 YAP/TAZ 和 TEAD1-4 之间的相互作用。因此,YAP-TEAD 转录活性可以通过降低 YAP/TAZ 的表达、破坏 YAP-TEAD 相互作用或抑制 TEAD 活性来抑制,从而使这些潜在靶点干扰 Hippo 通路。
表2 临床阶段靶向 Hippo 通路的药物

◆ Hippo核心激酶抑制
Hippo 核心激酶可以通过激酶抑制或蛋白质表达的改变来控制。
MST 激酶活性抑制剂是临床前研究中最常见的 Hippo 核心激酶活性抑制剂。特别是 XMU-MP-1,一种由 Fan 等人鉴定的 MST1/2 抑制剂,已在多种疾病中得到广泛研究,如慢性/急性肝损伤、前列腺癌、乳腺癌、自身免疫性脑脊髓炎和心脏肥大等。但由于易脱靶的特性,XMU-MP-1 并非最理想的 MST 抑制剂。近期,MST1/2小分子抑制剂SBP-3264被设计用于急性髓系白血病的治疗。此外,潜在的 LATS 抑制剂, TRULI也已被鉴定,处于病理功效研究阶段。多项研究表明, Sav 的敲低可显著改善心力衰竭。在部分肝切除小鼠模型中,siRNA 介导的 MST1/2 敲低可有效诱导肝再生。
◆ YAP/TAZ 表达/活性抑制
YAP/TAZ 蛋白水平或活性的调节在临床前和临床研究中主要涉及两种方法:药理学抑制和遗传抑制。
CA3是一种通过化学文库筛选鉴定的具有代表性的YAP表达药理抑制剂,使用其治疗可减少食管腺癌和骨肉瘤的生长。
siRNA 疗法,作为小分子抑制剂的替代疗法,通过遗传抑制降低YAP/TAZ蛋白的表达,具有更高的特异性。D/R@Ang2-Lip+Au 是一种负载阿霉素和 YAP-siRNA 的阳离子脂质体,能够有效抑制胶质母细胞瘤。此外,还有一种 YAP-siRNA-脂质纳米颗粒被报导在小鼠模型中抑制肝细胞癌。除癌症治疗外,YAP-siRNA 在治疗后段新生血管相关眼部疾病方面也很有效。除 siRNA之外,shRNA 也是另一种常用的遗传抑制工具。使用 AAV5-sh-YAP1 和 AAV-miR-15a 处理下调 YAP 时,可以减弱博来霉素诱导的肺纤维化。多项研究的验证均提示了,YAP/TAZ 基因抑制剂具有令人兴奋的潜在发展前景。当前,针对 YAP1 的反义药物 ION537 已进入到 I 期临床试验,对于Hippo靶向药物(NCT04659096)的开发具有重大的意义。
◆ TEAD 和/或 YAP-TEAD 相互作用抑制
YAP-TEAD 相互作用抑制剂也是Hippo 通路相关药物开发的潜在靶点。维替泊芬(VP)被发现可以与 YAP 结合,从而破坏其与 TEAD 的相互作用。并被广泛用于治疗各种疾病,包括癌症、纤维化疾病和青光眼。然而,与其他潜在的 Hippo 靶向小分子抑制剂相似,VP也具有脱靶与 YAP 非依赖性的毒性作用。
此外, VGLL4 肽模拟物也是一种被广泛讨论的Hippo 靶向的 YAP-TEAD 抑制剂。基于 VGLL4 可以与 TEAD 结合并与 YAP/TAZ 竞争的机制设计VGLL4肽模拟物,以破坏 YAP-TEAD 相互作用。相关功效研究主要集中于癌症治疗。例如,Super-TDU可抑制肿瘤生长,在小鼠模型中治疗胃癌、结直肠癌。
随着对 YAP-TEAD 复合物结构的进一步探索,TEAD 的棕榈酰化口袋已成为抑制 YAP-TEAD 转录活性的新靶点。棕榈酰化在 TEAD 和 YAP/TAZ 之间的结合中起到重要的作用。氯甲基酮 2 是 2019 年发现的一种 FA 衍生物,通过与 TEAD4 棕榈酸酯口袋的结合来破坏 TEAD4 与 YAP1 的结合。已经在体外被证明了治疗胶质母细胞瘤的潜力。目前为止,已有 VT3989 (NCT04665206) 和口服抑制剂 IK-930 (NCT05228015) 两种 TEAD 棕榈酰化抑制剂进入到临床试验阶段。
展望
大量的基础研究已经定义了包括 MST1/2、LATS1/2、MOB1A/B、SAV1、YAP/TAZ 和 TEAD1-4 在内的一系列 Hippo 通路网络的关键组件。以及NF2、MAP4Ks 和 WWC1/2/3 等对 Hippo 途径具有重要作用的蛋白和许多影响 Hippo 通路活动的上游信号。
其在多种疾病中的重要作用,使得针对Hippo信号通路的靶向药物开发,成为近期的热门研究方向。
然而由于Hippo 通路不仅与疾病的发展有关,且在生理稳态的维持中也起到至关重要的作用。也提示我们未来的药物开发需要在研究提高药物疗效的方法的同时,尽量减少药物对 Hippo 通路正常功能的不利影响。让我们一起期待后续的药物开发进展吧~
助力科研产品
当下,Hippo 信号通路 研究依旧如火如荼,TargetMol® Hippo 抑制剂 可助力您靶向Hippo信号通路后续的药物研发。欢迎
好了,今天的T仔号文献列车即将到站。希望大家科研顺利奥,我们下次再见~
参考文献:
[1] Fu, M., Hu, Y., Lan, T. et al. The Hippo signalling pathway and its implications in human health and diseases. Sig Transduct Target Ther 7, 376 (2022). https://doi.org/10.1038/s41392-022-01191-9
[2] Meng Z, Moroishi T, Guan KL. Mechanisms of Hippo pathway regulation.Genes Dev. 2016;30(1):1-17. doi:10.1101/gad.274027.115
[3] Huh HD, Kim DH, Jeong HS, Park HW. Regulation of TEAD Transcription Factors in Cancer Biology. Cells. 2019;8(6):600. Published 2019 Jun 17. doi:10.3390/cells8060600
[4] Dupont S, Morsut L, Aragona M, et al. Role of YAP/TAZ in mechanotransduction. Nature. 2011;474(7350):179-183. Published 2011 Jun 8. doi:10.1038/nature10137
[5] Johnson R, Halder G. The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment.Nat Rev Drug Discov. 2014;13(1):63-79. doi:10.1038/nrd4161
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱