NC项目文章 | 中国医学科学院花芳团队发现结直肠癌治疗新靶点ID1
2023-12-01 11:04:51, 莲莲看 北京青莲百奥生物科技有限公司
肿瘤起始能力和抑制肿瘤免疫微环境是驱动肿瘤发生、进展、转移和治疗耐药的两个关键决定因素。肿瘤相关巨噬细胞(TAM)是肿瘤微环境(TME)免疫细胞的主要组成部分。更深入地了解TAM表型转换的分子机制对于剖析治疗耐药机制至关重要,有助于开发合理的组合治疗方法。分化抑制剂1(ID1)是螺旋-环-螺旋转录调控因子中的一员,在多种人类癌症类型中高表达,与癌症患者预后不良、肿瘤化疗耐药、血管生成、转移和癌症干细胞特性增加相关。然而,ID1在TAM的免疫抑制表型形成中的作用仍然未知。
近日,中国医学科学院药物研究所花芳团队在国际著名期刊《Nature Communications》( IF=16.6)发表题为“ID1 expressing macrophages support cancer cell stemness and limit CD8+ T cell infiltration in colorectal cancer”的研究成果。该研究提出了分化抑制因子1(ID1)在TAMs中的高表达与结直肠癌(CRC)患者的不良预后相关。降低ID1表达可改善结直肠癌进展,提高肿瘤对免疫治疗和化疗的敏感性,为ID1在结直肠癌中的治疗靶向奠定了基础。青莲百奥为该研究提供蛋白质组学检测和分析服务。

发表期刊:Nature Communications
影响因子:16.6
发表时间:2023年11月
发表单位:中国医学科学院药物研究所
研究思路
挖掘基因芯片数据集筛选关键转录因子,通过WB,免疫组化,组织芯片验证Id1与结直肠癌的关系;
构建小鼠模型验证TAMs中Id1的高表达促进结直肠癌肿瘤的生长与转移;
使用免疫缺陷小鼠模型验证Id1降低CD8+T细胞浸润转移的作用;
探究TAMs中Id1对肿瘤干性特征的维持作用及其相关机制;
评估ML323(促进Id1降解药物)与化疗或免疫治疗联合使用的潜在效果。
研究结果
一、ID1在TAMs中的表达增强与结直肠癌患者的临床预后不良相关
结直肠癌细胞衍生条件培养液(CM)刺激下和未刺激(Ctrl)的腹膜巨噬细胞(PM)的基因差异表达分析发现TAMs中有10个编码转录因子的基因在结直肠癌中表现出致癌特性(图1a)。在CT26或MC38来源CM处理的RAW 264.7细胞中验证蛋白丰度,发现c-Myc、Snai1和Id1在结肠癌细胞来源的CM处理组中高表达(图1b,c)。其中c-Myc和Snai1已被证明是替代巨噬细胞激活的关键参与者,因此该研究重点关注Id1在TAMs中的作用。与正常结肠组织中相比,多种CRC模型中浸润的TAMs均表达更多的Id1(图1d-f)。101例人类结直肠癌的组织芯片结果也表明CD68+ TAMs中Id1的表达高于癌旁的巨噬细胞(图1i,j),且CD68+ TAMs中Id1的高表达与结直肠癌患者的不良预后相关(图1k)。总体而言,ID1在结直肠癌的TAMs中高表达,尤其是晚期结直肠癌,预示着不良的临床结果。

图1:ID1在TAMS中的表达增强与结直肠癌患者的临床预后不良相关
二、表达ID1的TAMs促进结直肠癌生长和转移
通过将含有ID1外显子的小鼠(Id1f/f)与表达Cre重组酶的小鼠杂交,构建骨髓特异性ID1缺陷小鼠(Id1Lyz-KO),并将小鼠MC38结肠癌细胞皮下(s.c.)接种于Id1f/f和Id1Lyz-KO小鼠,然后使用两种TAMs转移模型研究巨噬细胞中ID1敲除是否抑制肿瘤进展(图2a),发现含有Id1Lyz-KO TAMs的肿瘤比含有Id1f/fTAMs的肿瘤生长速度慢得多(图2b,c),且肿瘤结节中Ki67+细胞比例较低(图2d)。这些结果表明,TAMs中Id1的缺失会抑制CRC的生长。
为了研究巨噬细胞中的Id1是否参与控制肿瘤转移,建立了三种CRC转移模型。其中,在脾肝转移模型中,将荧光素酶标记的CT26细胞脾内注射,同时腹膜内注射TAMs(图2e)。注射来自Id1f/f小鼠的TAMs显示出增强的生物发光信号、肝脏/体重比、肿瘤直径和具有转移性肿瘤结节的肝叶数量增加,当Id1被敲除时,这些情况发生逆转(图2f-k)。此外,高表达Id1同样可以逆转经典活化巨噬细胞的抗肿瘤表型(图2q,r)。总而言之,表达Id1的TAMs通过影响其分泌成分促进结直肠癌肿瘤的生长和转移。
图2:表达ID1的TAMs促进了CRC的生长和转移
三、表达ID1的TAMs可通过阻止CD8+T细胞募集促进结直肠癌的发生发展
为了评估表达Id1的TAMs是否具有免疫抑制功能,将MC38细胞和TAMs的混合物接种到免疫缺陷的BALB/c裸鼠(图2a)。BALB/c裸鼠的抑瘤率约为50%,而C57BL/6J小鼠的抑瘤率超过80%(图3a),表明表达Id1的TAMs可能破坏T细胞介导的抗肿瘤免疫反应。TAMs中Id1的缺失增加了肿瘤中CD8+T细胞的渗透以及CD8+T细胞中干扰素-γ(IFN-γ)和颗粒酶B的表达(图3b-d)。与Id1f/f组相比,Id1Lyz-KO TAMs处理减少了CT26S.C.模型的肿瘤生长,但这种现象会被CD8+T细胞的耗尽(注射抗CD8β抗体)所逆转(图3k-n)。此外,Id1Lyz-KO促进CD8+T细胞的迁移(图3o,p),在人原代细胞共培养体系中也证实了这个结果(图3q)。这些数据表明,表达Id1的TAMs的促肿瘤作用依赖CD8+T细胞。
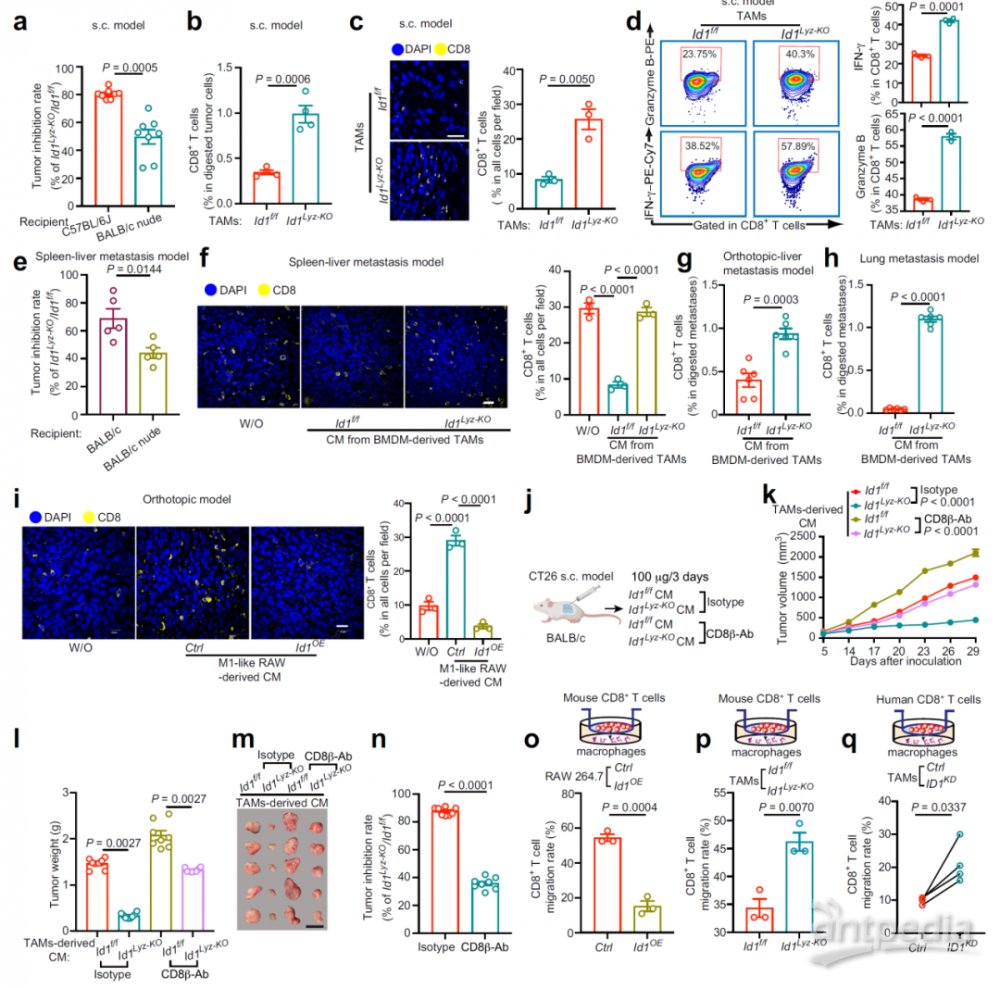
图3:表达ID1的TAMs通过抑制CD8+T细胞募集促进CRC进展
四、表达ID1的TAMs激活FAK-YAP信号通路维持 CRC干性特征
造血干细胞被认为是肿瘤发生、转移、耐药和复发的起源。从Id1Lyz-KO组分离的肿瘤细胞表达的CD44和Lgr5(CSC标记物)低于Id1f/f组(图4a,b)。此外,Id1KD或Id1Lyz-KO TAMs的CM抑制了CRC细胞的肿瘤球形成能力(图4f)和侵袭性,而Id1过表达后则相反(图4f)。这些数据表明,表达Id1的TAMs维持CRC细胞的干性特征。
转录组测序及差异基因组富集分析(GSEA)表明,TAMs中缺失Id1会抑制局灶粘附激酶(FAK)和Yes相关蛋白(YAP)信号通路,但不会抑制其他与肿瘤干性相关的信号通路(图4h,i)。FAK通过磷酸化YAP的Y357来增强其蛋白稳定性、核转位及其转录活性,从而维持肿瘤干性特质。Id1过表达则会增强YAP蛋白的稳定性、YAP(Y357)磷酸化、核转位以及下游靶基因的转录(图4l-o)。一系列实验验证了表达Id1的TAMs通过激活癌细胞中的FAK-YAP信号维持CRC肿瘤细胞的干性。
图4:表达ID1的TAM通过激活FAK-YAP信号对维持CRC干性特征至关重要
五、TAMs中的Id1通过抑制CCL4和SerpinB2的转录介导肿瘤免疫逃避和CRC干性的维持
基于转录组测序结果,Id1Lyz-KO TAMs中有2000多个基因增加(图5a,b)。其中有20个表达上调的趋化因子基因,其中Ccl3、CCl4、Cxcl9和Cxcl16既具有抑瘤作用,又具有促进T细胞浸润的作用(图5c)。在这四种趋化因子中,只有CCl4在Id10ERAW 264.7细胞中的转录水平降低(图5d)。低CCl4与CRC患者的不良预后相关。生化实验验证表达Id1的TAMs减少CCL4的分泌,并阻碍了CD8+T细胞向肿瘤部位的运输。
从肿瘤内在属性调控方面,选择了12个编码分泌型肿瘤抑制因子的上调基因,其中仅有Serpin家族B成员2(SerpinB2)被报道抑制FAK信号转导(图5h)。TAMs中Id1的缺失增加了SerpinB2蛋白的丰度,而Id1的过表达降低了其丰度(图5i,j)。当同时敲除SerpinB2和CCl4这两个基因时,TAMs中Id1缺失对肿瘤生长和肝转移的抑制作用被完全消除(图5n-p)。因此,Id1通过抑制巨噬细胞SerpinB2和CCl4的转录,促进肿瘤免疫逃逸,增强结直肠癌细胞的致瘤能力,最终加强肿瘤的生长和转移能力。

图5:TAMs中的ID1通过抑制CCL4和SerpinB2转录介导肿瘤免疫逃避和CRC干性维持
六、ID1与STAT1相互作用抑制CCl4和SerpinB2的转录
采用免疫共沉淀-质谱法(Co-IP/MS)鉴定RAW 264.7细胞中可能与Id1相互作用的转录因子。STAT1是16个TF中唯一与Id1有相互作用的(图6a)。双荧光素酶报告证明Id1通过与pCcl4-2和pSerpinb2-8启动子区域结合而抑制CCl4和Serpinb2的转录(图6f)。CRM1识别STAT1的DNA结合域中的一个区域,将其重新分配回细胞质。ID1增强了CRM1与STAT1的相互作用(图6h,i)。IP分析进一步证实,这三种蛋白质都相互作用,ID1、STAT1和CRM1之间形成了异三聚体蛋白质复合体。这些数据表明,ID1促进CRM1向STAT1的募集,从而促进STAT1的细胞质分布,并抑制STAT1诱导的CCL4和SerpinB2转录。

图6:ID1与STAT1相互作用,抑制CCL4和SerpinB2的转录
七、靶向ID1可抑制癌症进展,并使肿瘤细胞对化疗和免疫疗法敏感
泛素化特异性蛋白酶1(USP1)是一种去泛素化酶,有报道称它能保持Id1蛋白的稳定性。在s.c.模型中,USP1选择性抑制剂ML323能减少TAMs中Id1的表达,并表现出明显的肿瘤抑制作用,肿瘤体积和肿瘤重量均有所减少,肿瘤浸润CD8+T细胞增加,肿瘤细胞干性特征受到抑制(图7a-i)。验证了ML323的作用后,本研究使用临床前小鼠模型中评估ML323(3mg/kg)与化疗或免疫治疗联合使用的潜在效果(图7w),结果表明联合治疗的抗肿瘤效果更强(图7x-z)。因此,通过抑制USP1活性来靶向Id1可能是提高化疗和免疫疗法治疗CRC疗效的一种潜在策略。
此外,关于表达Id1的TAMs促进肿瘤进展的研究结果不存在性别差异,且可能对其他类型的癌症具有广泛的相关性。

图7:靶向ID1可抑制癌症进展,并使肿瘤细胞对化疗和免疫疗法敏感
研究结论
该研究提出了分化抑制因子1(ID1)在TAMs中的高表达与结直肠癌(CRC)患者的不良预后相关。表达ID1的巨噬细胞维持肿瘤干细胞的干性,阻止CD8+T细胞浸润。在机制上,ID1与STAT1相互作用,诱导其胞浆分布,并抑制STAT1介导的SerpinB2和CCL4转录,这两种分泌因子与肿瘤干细胞抑制和CD8+T细胞募集有关。降低ID1表达可改善结直肠癌进展,提高肿瘤对免疫治疗和化疗的敏感性。该研究强调了ID1在控制TAMs原癌表型中的关键作用,并为ID1在结直肠癌中的治疗靶向奠定了基础。
青莲百奥合作文章
青莲百奥深度参与众多前沿研究,与中国医学科学院、中国科学院、军事医学研究院、国家蛋白质科学中心、四川大学华西医院等单位通力合作,累计发表SCI论文100余篇,累计影响因子(IF)800+,多项重磅文章问鼎Nature、Science Translational Medicine、Nature Communications等顶级期刊。

关于青莲百奥
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱