冻干过程实时监测与控制中的PAT技术
2023-11-10 12:02:45, 莱奥德创 德祥科技有限公司


莱奥德创冻干技术分享会-上海场报名正火热进行中,冻干理论+实操体验!名额仅限30位!
近年来,生物制药领域的兴趣和增长显著增加,产品已被证明可以显著改善患者的健康。随着用于治疗用途的生物分子增加,监管机构的期望也在增加。
随着美国FDA发起的QbD指南和过程分析技术(PAT)的推出,以及国际协调委员会(ICH)的活动,特别是Q8、Q9和Q10指南,要求产品和工艺性能特征应该科学地设计以满足特定目标,而不是经验地从测试批次的性能中得出[1-6]。这需要基于目标产品概要和基于关键质量属性(CQA)的关键过程参数的目标过程定义,以及监视和控制它们的工具。
问
为什么推荐使用PAT?
答
FDA将PAT定义为通过及时测量(即在加工过程中)原材料和过程中的材料和工艺的关键质量和性能属性来设计、分析和控制生产的系统,其目标是确保最终产品质量[6]。
如果没有PAT会怎么样?
在没有PAT的情况下,工艺通常是经验设计的,没有对关键产品质量和工艺参数之间的关系的透彻理解。在商业生产中,在冷冻干燥机中加工的产品每批价值可能超过数百万美元。
因此,不使用PAT的方法会使高附加值药品面临损失的风险,原因是未预料到的工艺偏差和缺乏对这些偏差如何影响产品质量的了解。PAT工具的使用不仅有助于监测和控制制造过程,而且有助于提高科学认识。

我们先来了解一下冷冻干燥技术的原理:
1
冷冻干燥
在液体剂型中药物稳定性差的治疗性蛋白质通常被干燥以增强其稳定性。冻干,也被称为冷冻干燥,相对于其他干燥技术,它仍然是最优选的稳定方法之一,因为它是一个低温过程,允许处理生物溶液,保证生物活性[7,8]。
然而,冻干是一个复杂的过程,如果没有正确的理解和设计,它本身就会导致过程和储存的不稳定性。
冻干过程分为三个阶段
• 冷冻
• 一次干燥
• 二次干燥
在冻结阶段,通过将溶液暴露在≤-40°C温度下并保持直到几乎所有水都冻结,溶液中的水转化为固体冰。初级干燥阶段构成升华阶段,在此期间,冰通过热和真空的应用而升华。在一次干燥结束时,根据配方组成,仍然会有部分水没有形成冰,并在二次干燥阶段通过高温解吸除去。
2
冻干过程设计
冻干过程的设计需要深入了解材料科学,冻干过程中发生的多个过程,对过程和产品的独立/因变量的影响,以及与放大和制造操作相关的挑战。这些挑战源于环境的差异(例如,无颗粒环境的影响),负载大小的差异(规模相关问题),设备(冻干机)设计的差异,以及实验室冻干和生产之间的时间和程序差异。从商业制造的角度来看,干燥过程应该短(即经济上可行和有效),在设备的能力范围内运行,具有适当的安全边际,并在既定的“设计空间”内有效和可重复地进行。
在工艺开发过程中,表征配方的热特性,建立关键工艺参数和产品质量属性之间的关系,并确定了一个强大的“设计空间”,使工艺能够在加工设备的能力范围内运行。这是结合先验知识、实验和基于风险的评估来完成的,该评估确定了所有可能影响过程性能和产品质量属性的参数。
这些参数通常分为:
1. 冷冻干燥过程操作参数(货架温度,腔室压力,斜坡速率和保持时间);
2. 产品相关参数(蛋白质浓度,赋形剂及其浓度,小瓶规格,塞设计,填充体积);
3. 设备(能力和限制,批量负载/大小,规模效应);
设计了多变量实验,并支持稳定性研究,以确定每个参数对CQA的影响程度。这种评价可以基于实验和工艺参数的统计显著性,这些工艺参数对CQA有显著影响,被归类为关键工艺参数(CPP)。这是监管机构理解过程和期望的关键。在工艺表征过程中,必须识别和理解驱动CQA变异性的CPS,以便在制造过程中对其进行实时测量和控制。
因此,关键参数的测量和控制应该能够使用与生产工厂相连接的广泛分析技术,并纳入标准程序[9]。

多元数据采集和分析工具
这些工具能够确定多个关键因素及其对产品质量属性的影响,并结合多元数学方法,如实验的统计设计和过程模拟,以及知识管理系统。

现代过程分析仪或过程分析化学工具
这些工具可以是测量一个变量(如温度、压力)的常规系统,也可以是确定生物或化学属性的高级工具。进行这些测量的地点可分为at-line (移除样品,靠近工艺的分析),on-line(从工艺中转移样品,测量,并返回工艺)和in-line (在工艺中进行侵入性或非侵入性测量,不去除样品)。这些系统最重要的好处是它们能够确定过程属性的相对差异和变化,并能够调整过程参数以补偿可变性。通过反馈和/或前馈机制,根据产品质量属性和实时过程信息进行实时过程调整。

过程和终点监视和控制工具
这些工具的设计目的是监视流程的状态,并对其进行主动操作以维持所需的状态。该策略基于对关键材料和工艺属性的识别,以及能够实时确定所有关键参数的工艺测量系统。来自这些传感器的信息可用于调整工艺,考虑材料的可变性,并通过关键材料和工艺属性之间的数学关系来控制产品质量。工艺的终点不是固定的时间,而是在合理的工艺时间内达到所需的材料属性。验证可以通过使用经过验证的过程测量和过程终点对持续监控和调整的过程进行持续质量保证来证明。

持续改进和知识管理工具
这些工具用于产品生命周期内的持续改进,并用于批准后的更改和对过程和潜在问题或变化的额外理解。
3
PAT用于冷冻干燥过程的监控和控制
冷冻干燥的因变量/关键工艺参数
直接影响关键质量属性的过程参数称为关键过程参数(CPP),影响目标产品概况的质量属性称为关键质量属性(CQA)。独立的关键工艺参数是货架温度和腔室压力,与冻干过程相关的依赖关键工艺参数是产品温度、成核温度(过冷程度)、产品阻力和升华速率,下面将会为大家简要介绍。
除了关键参数外,需要对一次和二次干燥阶段的终点进行控制和监测,因为它们影响工艺性能和产品质量属性。
产品温度
产品温度是决定工艺性能和产品质量属性的关键工艺参数。期望冻干产品具有低残留水分含量、短复水时间、过程中保持活性和足够的保质期等特点。为了达到这些目标,产品必须在最大允许产品温度以下干燥,也就是低于是非晶系统的塌陷温度或结晶系统[10]的共晶共熔温度。因此,在生产过程中对产品温度进行准确的测量、控制和监控,以控制产品质量是至关重要的。
产品阻力
产品阻力定义为已经干燥的产品层对水蒸气流动产生的阻力,通常显示为干燥层厚度的函数。产品阻力取决于配方组成、固体含量和工艺特性,如冷冻速率。干燥结构内部的坍塌或微坍塌以及饼状开裂的发生都会影响产品的阻力分布。例如,在冷冻过程中通过应用退火步骤引起的冰晶尺寸和互连的改变也会影响产品的电阻。在初级干燥过程中产品阻力的变化取决于配方,并且由于升华冷却的减少,在初级干燥结束时产品温度相应增加,阻力会显示出显着的增加。
升华速率
在初级干燥阶段确定冰的干燥速率或升华速率对于工艺性能至关重要,并且对于在放大和技术转让期间进行工艺比较具有价值。用于确定两种冻干机或工艺的性能等效性的标准之一是证明相同的升华速率(每瓶或单位表面积)。
从工艺性能的角度来看,需要监测升华速率,以确保在进行二次干燥之前,在指定的时间内完成一次干燥阶段。此外,它需要保持在一定的水平以下,这取决于设备的能力,包括腔室和冷凝器之间的管道直径和冷冻干燥器冷凝器的水蒸气捕获能力。通过控制货架温度和压力来控制升华速率将避免冷凝器过载和“阻塞流”的情况。阻塞流点定义为当水蒸气通过连接腔室和冷凝器的管道的速度接近声速极限1马赫时的过程状态。
在这些条件下,流速不再增加,腔室内的水蒸气压力增加,导致压力控制丧失。由于向小瓶传递热量的主要来源是通过气体碰撞,因此腔室压力的升高导致产品小瓶的热量传递增加,升华速率进一步增加,并且出现正反馈失控状态。当进入的水蒸气的速率快于制冷系统能够从快速冷凝的水蒸气中除去热量并保持冷凝器盘管温度的速率时,冷凝器过载就会发生,该温度在冷凝器表面上的蒸汽压力与产品中的蒸汽压力之间提供足够的负梯度,以维持升华,并保持腔室压力以实现气体输送。这两种情况的特点都是失去腔室压力控制[11]。
成核温度
成核温度是冰晶在冷却过程中在溶液中首次形成的温度,它与冰的生长速率结合决定了冰晶的大小和形态。平衡凝固点与成核温度之间的差被定义为过冷程度。
成核温度影响产品的传质阻力,进而影响后续工艺性能和产品质量属性。成核温度取决于冷却/冻结速度:冷却/冻结速度越快,过冷程度越高,导致冰晶尺寸越小。更小的冰晶导致更小的孔隙和通道,在升华过程中水蒸气的逸出和更高的产品抗干燥性。较高的电阻导致较低的升华率和增加的处理时间。
冰成核是一个随机过程,小瓶设计的不同、与货架的接触、传热系数和产品溶液中颗粒物质的水平都可能导致过冷程度的不同(见图1),这反过来又可能导致产品在小瓶之间和批次之间的不均匀性。因此,在生产冻干机中确定成核温度的分布,并在可能的情况下对其进行监测和控制,以消除非均质性,提高干燥效率是有价值的。
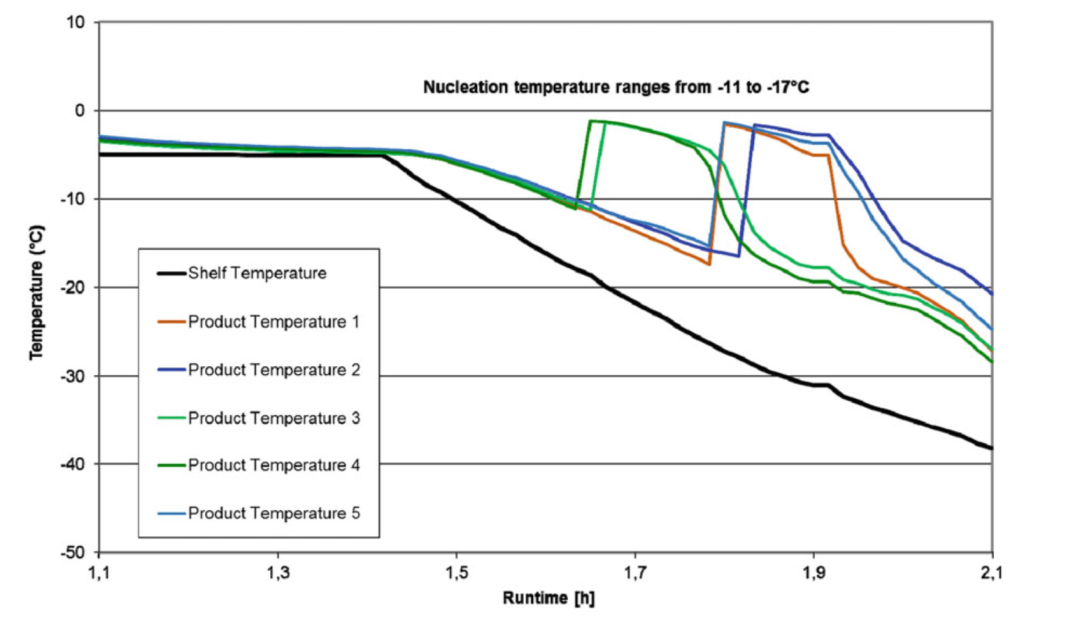
图1:随机成核温度的差异
初级干燥阶段终点的确定
初级干燥阶段的终点确定在工艺设计/优化和制造过程中都是一个重要的信息。它与冰升华率直接相关,并且是一个因变量,受诸如腔室压力、货架温度、小瓶传热系数、填充体积和产品阻力等自变量影响。一种精确确定产品小瓶内所有冰升华时间的方法不仅对最大限度地提高工艺吞吐量很重要,而且从产品质量的角度来看也很重要。在没有完成冰升华的情况下,通过提高货架温度将干燥过程推进到二次干燥阶段,会带来产品塌陷、产品质量下降、批次失败的风险。
二次干燥阶段终点的确定
大多数生物制药对残留水分和高温很敏感,在二次干燥过程中需要最佳的处理时间和温度条件。不必要地将产品长时间暴露在高温下会损害其稳定性。此外,干燥到低于或高于所需/最佳剩余水分含量会损害产品的稳定性。因此,精确了解二次干燥阶段的终点不仅有利于提高工艺效率,而且有利于提高产品质量。
4
用于冷冻干燥过程监控的PAT
有几种商业上可用的分析工具,用于确定冻干过程的关键过程和产品参数,其中一些工具的应用仅限于工艺开发,而一些工具的设计用于在商业制造环境中监测和控制过程。
这些工具可以进一步分类为单瓶和批量过程监控技术。批量监控技术通常是可取的,因为它们具有提供与干燥器内所有小瓶相关的信息的优势,代表整个批次。单瓶测量不仅缺乏批次的真实代表,而且在某些情况下,测量技术本身可能会影响所选小瓶的干燥情况。然而,来自单瓶技术的信息也可以提供关于位置效应和批次异质性的信息,这是批次方法无法获得的。
用于冻干的PAT测量工具包括基于传热(热电偶,RTD, TEMPRIS等),传质(微天平,TDLAS),压力(电容压力表,皮拉尼,露点传感器,压力温度测量)或气体成分(质谱仪,等离子体发射光谱,近红外/拉曼光谱,TDLAS)的测量工具。很明显,目前单一的PAT工具不能提供足够的过程监控和理解所需的所有过程信息。有时需要使用工具组合来获取所需的所有信息,所使用技术的选择不仅取决于目标过程参数,还取决于可用的资源。
要成功地使用和接受在线监测工具,有一定的要求和优选的仪器属性,包括:
(1)提供了整个批次的测量代表,而不仅仅是单个小瓶;
(2)提供了绝对的定量测量;
(3)监测批内最慢干燥小瓶的测量能力(见表1);
(4)与工艺程序和流程兼容,例如托盘/小瓶的装卸;
(5)与清洁和蒸汽灭菌兼容;
(6)不损害冻干机的真空或无菌;
(7)通过生产规模的冷冻干燥设备,可与实验室进行规模化使用和集成。
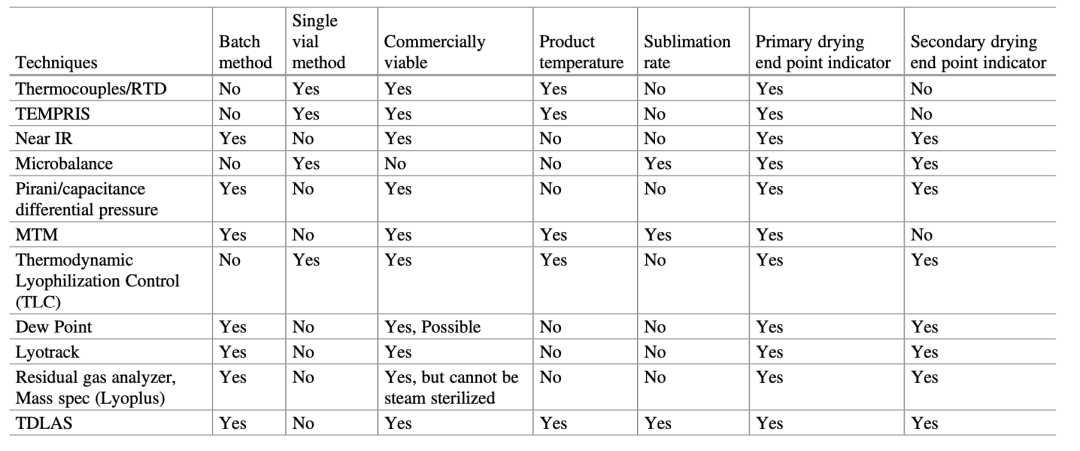
表1:用于冷冻干燥过程监控的过程分析工具的优缺点
相关技术详解
+
冻干前沿|TDLAS技术在药物冻干中的应用详解
+
成核控制技术在冻干过程中的应用
+
先进的冻干PAT工具—助力生物制药生产放大
+
如何测定冻干机的极限性能——可支持的最大升华速率
你说还有疑问没有被解答

5
莱奥德创冻干技术分享
关注“莱奥德创冻干工场“,立即获取冻干线上技术分享内容。
基于对于冻干研发的一些考量,莱奥德创创建了金字塔冻干技术分享平台:包含了从冻干理论基础,到配方和工艺开发,再到放大及生产,以及进阶的设备管理和线上线下专题内容分享。
内容结合了来自Biopharma的冻干理论指导体系、来自于莱奥德创产品经理及应用工程师的实践经验总结及国内外专家的专题内容。
获取方式
Step 1:关注公众号

扫码关注
莱奥德创公众号
Step 2:点击菜单栏“冻干讲堂”
Step 3:点击你感兴趣的内容Banner

Step 4:开始学习
更多关于冻干技术分享平台的介绍请点击下方阅读:
|
6
莱奥德创冻干技术分享会详情
万众期待,莱奥德创冻干技术理论及实操技术分享会重磅回归!12月7日-12月8日,您将在上海莱奥德创冻干工场(中国 (上海) 自由贸易试验区巴圣路160号4-1-1002)体验到:
✔ 资深冻干专家多年冻干经验分享;
✔ 莱奥德创冻干工场实操分享,观察Controlyo瞬间成核过程;
✔ 体验Smart主干燥自动优化技术操作及运行;
✔ 学习冻干产品前后性能测试分析设备操作及作用;
✔ 深度理解科学的冻干配方开发和工艺开发过程;
✔ 理解QbD理念的冻干工艺空间设计及放大化;
✔ 同行业内部深度交流。
席位限定:30位
报名方式:
1. 扫码填写报名信息

2. 缴纳报名费用
参会费用:3288元/人
*11月26日前报名享受早鸟价2888元/人
帐户名称:上海莱奥德创生物科技有限公司
帐户号码: 1219 4564 1610 106
开户银行:招商银行股份有限公司上海长阳支行
*付款时请备注:12月上海+姓名
如果您其他问题需要咨询,欢迎随时联系莱奥德创,可拨打热线400-006-9696。
莱奥德创冻干工场
上海莱奥德创生物科技有限公司由德祥科技有限公司创办,专注于提供高品质的冻干设备应用和制剂开发相关服务。
德祥科技有限公司服务冻干行业十余年,在涉及冷冻干燥领域的工艺开发/工艺优化/商业化等各方面拥有丰富的经验,迄今为止已为500+客户提供冻干设备及相关服务。客户产品类型涵盖:蛋白、抗体、ADC、疫苗、核酸、多脑、脂质体、IVD、食品等领域。依托于合作伙伴美国ATS SP Scientific和英国Biopharma Group的紧密合作,掌握先进的冻干理念与技术,使用优质的冻干设备和软件致力于促进中国生物医药技术创新升级,助力中国大健康行业的持续发展。
服务优势
Innovation
创新
Professional
专业
International
国际化
Our Mission
莱奥德创冻干工场专注于提供优质的冻干设备应用和制剂开发相关服务,致力于促进中国生物医药技术创新升级,助力中国大健康行业的持续发展。
Our Vision
做冻干工艺的创新者,为生物医药开发提供优质制剂产品解决方案。
莱奥德创冻干工场官网


觉得内容不错的话点个在看和赞吧

12-18 基泰生物
NS-90 Plus丨纳米粒度分析仪12-18 欧美克仪器
连载 | OMEC 纳米粒度及电位分析仪的新功能新特性(Ⅱ)12-18 产品经理 沈兴志
橙达应Kurti教授邀请参加WIPOS 2023(3rd Winter In-Person Organic Symposium)12-17 Orienda
传承40载 • 创新“谱” 未来 | 中国离子色谱产业高质量发展研讨会暨40周年纪念活动成功举办!12-16 SHINE
GLMY创想仪器丨参加2023广西铸造年会12-16 国产精密仪器厂家
橙达仪器受邀参加WIPOS 2023(3rd Winter In-Person Organic Symposium)12-16 Orienda
使空间转录组学变得更容易:使用双重条码探针和sciFLEXARRAYER S3微量点样仪;经济高效地制造DNA阵列12-15
尽揽博才英杰,共赴锦绣未来:多个职位等你加入!12-15 HORIBA
科研人专属新春好礼火热申领中!12-15 HORIBA
新品上线|300M单/双通道高频锁相放大器12-15 赛恩科仪
Opentrons 亮相 P4 2023:自动化NGS文库制备工作站赋能精准医疗新发展12-15 Opentrons
高质量、规范化的院内实验室自建NGS性能确认如何开展? ——因美纳诚邀您参加第九届肿瘤病理诊断新进展研讨会12-15
炙热的双抗纯化,如何高效去除错配体、聚体、半抗等杂质?毫厘SpreX系列轻松搞定!12-15
与阿拉丁一起探索抗菌配体的奥妙!12-15 aladdin
网络讲座12.21 | ICP/XRF光谱仪在润滑油、润滑脂分析中的应用12-15 市场部
空间蛋白质组进入新时代,揭示基于timsTOF HT的项目经验12-15
提升实验效率的秘密武器:质粒提取试剂盒全新登场!!12-15 BEAVER
色谱质谱新国标12-15 基泰生物
智慧赋能 笃行致远 | 供水水质保障与水质管理人员能力 提升技术交流会召开12-15
