泛素化蛋白质组学方法——TMT和DIA技术进展
2023-07-21 12:27:37, Untangled

背景介绍
BACKGROUND
泛素是一种小的球状多肽,蛋白质底物与其共价结合发生泛素化,需要涉及三种酶的一系列连续的酶反应:E1泛素激活酶、E2泛素结合酶和E3泛素连接酶。泛素上的每个赖氨酸残基本身都可以被另一个泛素分子的C末端修饰,泛素化可以形成不同的拓扑结构,包括单泛素化、多单泛素化、链连接专一性多泛素化和混合或分叉多泛素化。泛素或多泛素链对蛋白质的修饰改变了蛋白质之间的相互作用、蛋白质的定位、蛋白质的稳定性等。因此,泛素化调控着真核细胞中几乎所有的细胞过程,包括蛋白质运输、激酶激活、DNA修复、细胞增殖、细胞凋亡。同时,蛋白质底物上的结合泛素也可以被脱泛素化酶去除,称为去泛素化。
泛素化位点的鉴定是众多生物学实验的核心,尤其是近期蛋白降解药物(target protein degration,TPD)开发的快速发展,泛素化蛋白质组学受到越来越多的关注。泛素的C端终止于氨基酸序列RGG,因此用胰蛋白酶处理后,在赖氨酸侧链上会修饰一个甘氨酸二肽,通过LC-MS/MS蛋白质组学分析,识别出这种质量位移;利用对泛素化赖氨酸残基(K-GG)具有高亲和力的基序抗体,特异性富集复杂样本中的泛素化肽段,实现大规模泛素化蛋白质定性定量分析。泛素化肽段丰度低,实验难度高,目前只有少数国际顶尖的实验室报道了更高通量和更深度覆盖的泛素化蛋白质组学方法。
基于串联质量标签TMT标记的泛素化蛋白质组学技术
基于串联质量标签TMT标记的泛素化蛋⽩质组学可以提高泛素化分析的灵敏度和通量,TMT试剂的胺反应性NHS酯基团与赖氨酸残基的肽N端胺基和ε胺基反应,但不与二甘氨酰残基的伯胺反应。
Steven等人称开发了一种名为On-antibody标记的TMT的方法用于泛素化蛋白质组的分析方法UbiFast。在该方法中,K-ɛ-GG肽与抗K-ɛ-GG抗体结合,同时进行TMT试剂标记,然后将每个样品中的TMT标记的K-ɛ-GG肽结合抗体珠混合,最后将泛素化肽段洗脱,进行单针蛋白质组分析。相对于溶液中TMT标记的方法,On-antibody TMT标记,提高灵敏度,降低了基于TMT的污染物副产物的水平,增加了K-ɛ-GG肽的相对产量。在TMT10plex中,大约5小时内从细胞或组织中提取500 μg的肽,定量约10,000个泛素化位点。
随后该作者继续开发了K-ε-GG抗体磁珠和自动化处理工作站,实现泛素化富集的高通量分析。UbiFast方法的自动化大大增加了鉴定和量化泛素化位点的数量,提高了再现性,并显着缩短了处理时间。与手工方法相比,自动化方法还显著降低了过程重复的可变性。该工作流程可在一天内处理多达96个样品,使其适合于在大型样品集中研究泛素化。
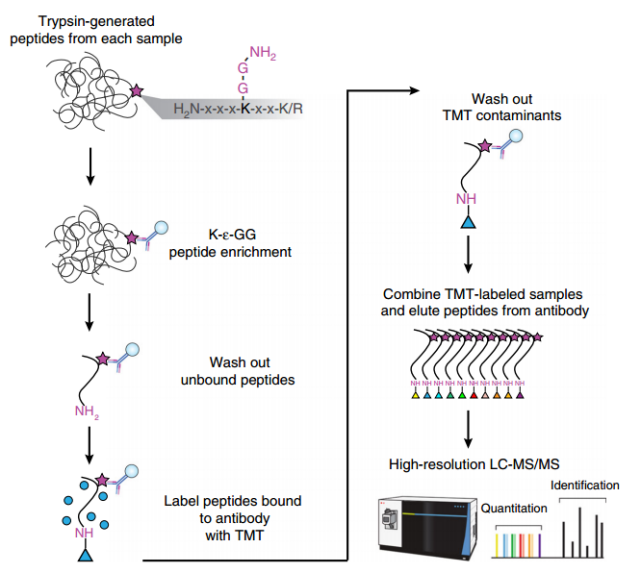
图1. 基于串联质量标签TMT标记的泛素化蛋白质组学工作流程
基于数据非依赖采集(DIA)-MS的泛素化蛋白质组学技术
数据非依赖采集(data independent acquisition,DIA)是近年来备受瞩目的质谱采集技术之一,一度引领了定量蛋白质组学新发展。DIA是一种靶向蛋白质组学技术,其对选定质荷比(m/z)范围内的所有离子进行碎裂和二级质谱分析。DIA是数据依赖性采集(Data-dependent acquisition, DDA)的替代方案,DIA相比于DDA的最大的优势在于高效测定复杂样品中丰度极低的蛋白分子,极大地提高了定量分析的可信度有更高的定量准确性和可重复性。然而由于DIA可同时采集多个MS1和MS2的数据,因此DIA谱图 (MS/MS) 较为复杂,包含了多个母离子的碎裂信息,所以直接从 DIA 数据中匹配肽段具有一定的挑战性。因此,常规的DIA方法中,需要根据多个样品组分 (fractions) 进行DDA质谱分析以建立图谱库 (Library),基于图谱库去匹配样本中的肽段信息。
Mann等人使用蛋白酶体抑制剂处理人细胞系,在蛋白质的提取和消化后,通过碱性反相(bRP)色谱将肽分离成多个级分,经MS检测用于深入构建超过90,000个K-ɛ-GG肽的Library;再将基于K-ɛ-GG抗体的富集与DIA方法相结合,在500ug MG132处理的HEK293的细胞样品,单次测量鉴定出约35,000个K-ɛ-GG肽3。近年来,随着SARS-CoV-2的出现和全球传播,对于病毒蛋白的分子机制还知之甚少,随后该课题组将该方法应用至SARS-CoV-2和SARS-CoV的并发多组学研究,深入了解病毒蛋白的分子功能及其与宿主蛋白质组的相互作用。结果发现大多数病毒蛋白也被翻译后修饰,尤其是在泛素化形式上。在基于数据非依赖采集(DIA)-MS的泛素化蛋白质组学技术基础上,检测到的27种SARS冠状病毒蛋白中,21种被泛素化。这两种病毒中,约有一半泛素化的位点在SARS-CoV和SARS-CoV-2之间保守。其余特异性调控的泛素化位点对每种病毒都是独特的,表明这些获得的适应性可以在翻译后进行修饰,并可能招募具有不同功能的细胞蛋白。此外,泛素化模式对单个宿主蛋白也存在相互作用,结果显示在感染SARS-CoV后24小时,EGFR蛋白显示6个赖氨酸残基的泛素化增加,而感染SARS-CoV-2后,EGFR上所有6个赖氨酸残基的泛素化比感染SARS-CoV时更为明显。此外,冠状病毒进入感染早期或晚期时,相同位点上显示出不同的泛素化模式。这些发现强调了翻译后修饰的价值,参与调节机制来修饰靶蛋白的功能和丰度,从而更好的诠释了冠状病毒的独特和共同的分子机制。
随着数据分析方法的发展与革新,多种无需构建图谱库的DIA分析 (Library-free DIA) 策略,例如根据数十万真实图谱经过AI机器学习用于预测图谱的技术,已成功应用于DIA数据分析,推动了DIA方法的进一步广泛应用。与传统DIA分析策略相比,不用再进行DDA分级建库,利用机器深度学习实现直接通过搜索DIA原始文件谱图生成库。深度学习打分寻找谱峰碎裂规律,预测保留时间,去除假阳性结果。改进后的这种方式提高了效率,降低了成本,保留了DIA可重复的定量的优势,鉴定到的蛋白数目与传统DIA的差距也越来越小。最近,一种基于深度神经网络的软件DIA-NN显著提高了DIA的蛋白质组学深度和定量准确性,特别是对于高复杂性的样品。
Henrik等人报告了基于质谱的泛素组学的可扩展且强大的工作流程。通过引入基于脱氧胆酸钠(SDC)的裂解方案,裂解后立即煮沸样品以及高浓度的CAA会增加泛素位点的覆盖率,因为CAA通过烷基化迅速灭活半胱氨酸泛素蛋白酶。并利用数据非依赖性采集质谱(DIA-MS)与基于深度神经网络的数据处理相结合,提高了重现性、鉴定数量和定量准确性,在MG-132处理的细胞中,仅1 mg的总蛋白就足以达到约7万个定量的K-GG肽和。而在仅使用250µg蛋白质,在没有蛋白酶体抑制的情况下量化了大约18,000个K-GG肽。并能够对体内泛素化动力学进行精确的时间分辨分析,在已知和未报告的USP7底物上绘制了数百个泛素化位点,并确定它们对蛋白质丰度调节的影响,大大的提高了检测深度。

图2. 基于数据非依赖采集(DIA)-MS的泛素化蛋白质组学工作流程3
我们的解决方案
· 利用自主研制的高特异性K-ɛ-GG抗体,增加了泛素化肽的富集效率及特异性;
· 优化了一种简单快速的DIA深度检测方法,提高了灵敏度;
· 成功开发了深度覆盖的泛素化蛋白质组学方法;
· 在未经MG132处理的单个人细胞系样品中检测到20,000个不同的泛素化位点;
· 即使样品量低至500ug也可以达到理想的富集结果。
参考文献
Untangled Biosciences
解构健康奥秘、探寻生命答案,氨探生物以一流的分子表型组平台和成熟的临床转化应用体系,为优秀的研究团队进行技术和数据赋能,致力于实现分子表型水平的精准诊疗。

04-19
全域感知,“育”见环博 | 谱育科技再赴上海环博会之约04-19 点击关注→
融合创新,质领未来 | 青源峰达“THz+ & IC+”双生态亮相2024第十七届中国科学仪器发展年会04-18 SHINE
近期热招职位 | 春暖花开之际,来和我们做同事吧04-18
来真的,揭秘药物销量榜“药王”诞生04-18
圆满收官丨慕尼黑俄罗斯分析生化展览会落下帷幕!奥谱天成创新成果闪耀全场04-18
BET系列新品即将发布!国仪量子邀您参加CIBF202404-18 CIQTEK
顺磁小课堂47期 | 操作EPR谱仪不能携带手机、银行卡、硬盘等磁性物体?04-18 CIQTEK
培训通知 | 国仪量子2024年第二期SEM线下应用培训班04-18 CIQTEK
【实验室动态】QD中国样机实验室引进M91快速霍尔测量仪,极低迁移率材料测量速度提升100倍!04-18 Dr. Shen
病原微生物测序方案,您想了解的都在这里04-18
探索生命之光,让每一次检测都清晰可见!04-18 aladiin
土壤/沉积物中的有机碳、无机碳及元素碳检测方案 | 德国元素04-18 德国元素
Moku时间间隔与频率分析仪发布!表征和控制系统应用的全面解决方案。04-18 圈内人都会关注
杂质溯源及清除率研究04-18 ACD/Labs
国际展会 | 鉴知技术探索俄罗斯实验室仪器展04-18 鉴知技术
拒绝网络谣言,守护清朗园区04-18 国产精密仪器厂家
【知识&好礼】 ATAC-seq(染色质开放性测序)速览04-17
【预告】让你的核酸检测精准高效04-17
橙达仪器受邀参加中国化学会第十八届全国有机合成化学学术研讨会04-17 Orienda