技术突破:高通量单细胞表观组学MobiChIP™上市
2023-06-19 21:23:08 上海欧易生物医学科技有限公司

在细胞的整个生命周期中,基因时空特异性表达而产生的异质性决定了细胞的类型,功能,命运等等,而这个过程能被ChIP-eq技术精准的解析。
传统的ChIP-seq能在宏观层面探讨基因的表达调控,例如不同器官,不同物种。而我们的研究对象往往是较微观的对象,一小块组织,一群具有异质性的细胞等等,不同细胞类群之间的这种表观异质性差异只能通过单细胞ChIP-seq捕获。通过单细胞层面进行表观基因组学(epigenomics)的研究,对进一步解析基因调控和探讨生命活动提供了又一利器[1]。6月20日下午2点,墨卓生物将发布全球首款商业化高通量单细胞表观组学MobiChIP™解决方案,这一方案的推出是单细胞领域的又一重大技术突破。

2015年,通过多步液滴融合的方法,单细胞级别的ChIP-seq——Drop-ChIP实现突破[2]。这项技术把ChIP-seq带入单细胞阵营,也是单细胞表观技术分群概念的首次提出,证明表观组的数据也能用来进行细胞异质性分析,解析不同细胞基因调控的差异。 该方法具有三个创新核心:
利用多步液滴融合的方法通过标签技术实现DNA的标记 (DNA barcoding);
在单细胞中用酶切法打断DNA片段;
采用油包水的液滴作为生化反应的腔室。
这项技术把ChIP-seq带入单细胞阵营,也是表观技术分群概念的首次提出。

Drop-ChIP流程
2019年,CUT&Tag、CoBATCH和ACT-seq的几乎同时报道了一种相似且具有普适性、易操作、高质量的单细胞ChIP-seq技术[3,4,5]。准确来讲,该技术的三个核心点是:
刀豆蛋白偶联的磁珠; protein A-Tn5融合蛋白; “化整为零”的split and pool思想。
但是这种单细胞的ChIP技术仍具有一定的局限性,究其原因有以下几点:
门槛高,需要长期的技术积累; 人力成本高,繁重的劳动力输出; 操作繁琐,复杂的建库流程。

基于组合标签法的单细胞ChIP-seq
MobiChIP
有没有既不费力,通量高并且测序兼容性强的单细胞ChIP-seq技术?
答案当然是肯定的。墨卓基于底层的硬核微流控技术,先是开发了商业化MobiNova®-100平台,一键式操作的方法可以在6min内产生成千上万个单细胞的液滴。然后在汲取前人优点的技术上,开发出一套全新的单细胞ChIP-seq解决方案。本方案具有众多优点,同时也实现了多个首创和第一。

高通量单细胞表观组学MobiChIP™产品特点:
首创:全球第一款商业化高通量单细胞ChIP-seq解决方案,让科研人员可以轻松上手、独立完成单细胞ChIP-seq实验;
可靠:MobiChIP™的数据质量远超文献水平,产品性能稳定,可重复性好;
便捷:文库结构设计合理,兼容MobiCube®系列产品,无需单独包lane测序,可以大幅降低测序成本;
贴心:为用户提供经过验证的6大常用抗体,避免ChIP类实验中不同厂商抗体批次差异导致的结果不稳定情况。
我们基于高通量单细胞表观组学MobiChIP™技术,还进行了下游分析流程开发。例如,基于高通量单细胞ChIP-seq可以实现组织细胞的精准分群,该分群结果可与基于Bulk水平的 ChIP-seq细胞分群很好的重叠。
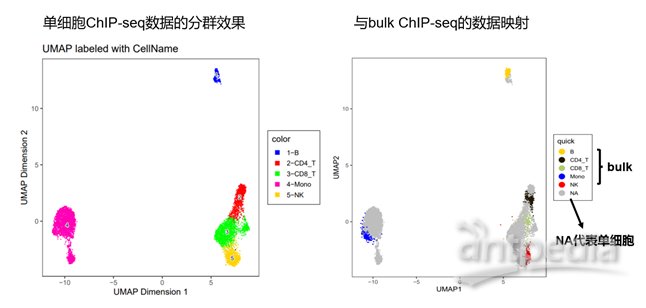
基于高通量单细胞ChIP-seq数据的细胞分群
同时,高通量单细胞ChIP-seq数据可与高通量单细胞RNA-seq数据进行映射和联合分析。这些下游分析方法的搭建,都将为高通量单细胞ChIP-seq的下游应用打下坚实的基础。
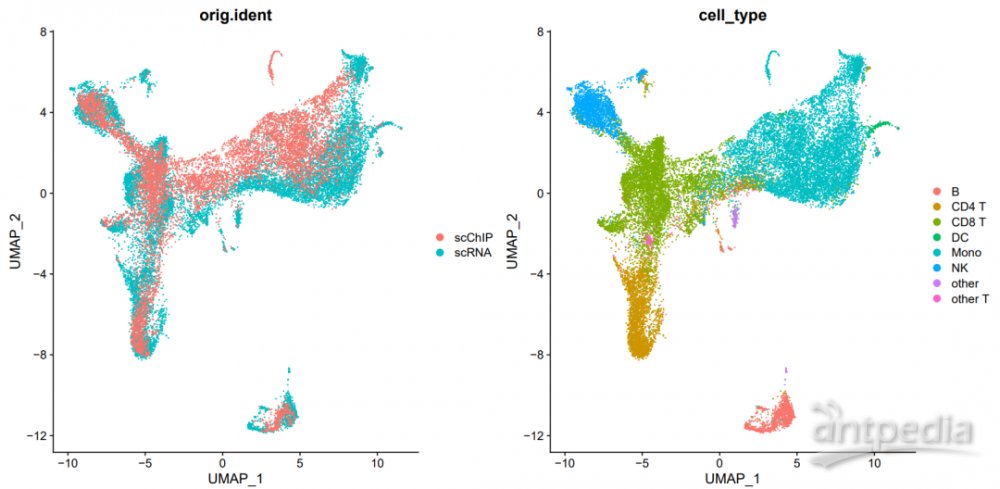
高通量单细胞ChIP-seq数据与高通量单细胞转录组数据联合分析
我们为什么需要单细胞ChIP-seq?这是非常重要的问题,只有应用需求驱使的技术革新才能持续和迭代。
在一项乳腺癌耐药性研究中,研究人员用耐药性和非耐药性小鼠的PDX模型样本进行了研究。转录组数据基于基因表达信息将细胞分成7个Cluster。

单细胞RNA-seq发现7类细胞亚群
其中归属于敏感细胞群的Cluster 6,与耐药细胞具有相同的调控通路。这可能是导致后续肿瘤复发的原因。

抗性基因表达匹配H3K27me3信号特征
在进行高通量单细胞ChIP-seq分析时候发现,抗药基因周围的H3K27me3的信号丢失,进而导致抗药基因高表达,以上可能是导致其向耐药细胞转变的生层次原因,而这些是基于单细胞转录组测序所不能得到的信息。
简言之,墨卓高通量单细胞表观组学MobiChIP™技术能够从新的视角破译表观遗传修饰,从而有助于全面解析疾病发生发展等生命活动。
墨卓生物首创推出的商业化高通量单细胞表观组学MobiChIP™解决方案将是单细胞行业一场新的技术革命,其可靠、便捷、贴心的产品设计理念将打破单细胞ChIP-seq高门槛的特点,让越来越多的实验室轻松开展单细胞ChIP-seq研究,从而推进生物医药行业的快速发展。

参考文献:
[1] Meyer CA, Liu XS. Identifying and mitigating bias in next-generation sequencing methods for chromatin biology. Nat Rev Genet. 2014, 15(11):709-21.
[2] Rotem A, Ram O, Shoresh N, Sperling RA, Goren A, Weitz DA, Bernstein BE. Single-cell ChIP-seq reveals cell subpopulations defined by chromatin state. Nat Biotechnol. 2015, 33(11):1165-72.
[3] Wang Q, Xiong H, Ai S, Yu X, Liu Y, Zhang J, He A. CoBATCH for High-Throughput Single-Cell Epigenomic Profiling. Mol Cell. 2019, 76(1):206-216.
[4] Kaya-Okur HS, Wu SJ, Codomo CA, Pledger ES, Bryson TD, Henikoff JG, Ahmad K, Henikoff S. CUT&Tag for efficient epigenomic profiling of small samples and single cells. Nat Commun. 2019, 10(1):1930.
[5] Carter B, Ku WL, Kang JY, Hu G, Perrie J, Tang Q, Zhao K. Mapping histone modifications in low cell number and single cells using antibody-guided chromatin tagmentation (ACT-seq). Nat Commun. 2019, 10(1):3747.
[6] Bartosovic M, Kabbe M, Castelo-Branco G. Single-cell CUT&Tag profiles histone modifications and transcription factors in complex tissues. Nat Biotechnol. 2021, 39(7):825-835.
[7] Wu SJ, Furlan SN, Mihalas AB, Kaya-Okur HS, Feroze AH, Emerson SN, Zheng Y, Carson K, Cimino PJ, Keene CD, Sarthy JF, Gottardo R, Ahmad K, Henikoff S, Patel AP. Single-cell CUT&Tag analysis of chromatin modifications in differentiation and tumor progression. Nat Biotechnol. 2021, 39(7):819-824
09-19
免费试用 | MPA II-DAIRY乳品分析仪09-19
应用速递 | 应对碱性化合物峰形困扰,CORTECS C18+来助力09-19 沃特世
分析二甲苯中聚合物的提示和技巧,速速来看!09-19 沃特世
关注仪器性能,提高工作效率 | 高分辨质谱性能评估09-19 沃特世
小长假来临,色谱柱/仪器维护看过来09-19 沃特世
“肽”厉害: 单杆液质在线除盐结合解卷积定性合成寡肽09-19 飞飞
“质”的飞跃:Orbitrap Astral革新修饰组学研究09-19
祝贺第四届生态环境监测专业技术人员大比武圆满落幕!09-19
Aliben动态 | 艾立本荣获2023年中国仪器仪表学会科学技术奖一等奖09-19 艾立本科技
【探访实验室】哥伦比亚大学使用 LogPhase 600 轻松确认酵母活性09-19 安捷伦细胞分析
启动“长效护盾计划” | 买一年送一年09-19 安捷伦售后服务
明月秋风,云赏CD909-19 安捷伦细胞分析
安捷伦案例研究:细胞代谢分析提供宝贵生物学见解,推动治疗药物研发09-19 安捷伦细胞分析
网络研讨会 | 如何将细胞能量分析技术运用于抗肿瘤研究09-19 安捷伦细胞分析
【重要会议】安捷伦诚邀您参加“类器官中的细胞世界”学术研讨会09-19 安捷伦细胞分析
【学术会议】马尔文帕纳科XRD专家将在药物晶型研究专题培训班倾情分享09-19
【职为你来】马尔文帕纳科秋季热聘正当时09-19
北京XRD用户沙龙同步直播开放报名!09-19
【学术会议】马尔文帕纳科NTA新品首次亮相生物药BioCMC峰会09-19