iScience | 上海药物所黄河团队揭示HBO1是哺乳动物细胞苯甲酰化修饰的“Writer”
2023-03-15 14:44:48, 景杰生物 杭州景杰生物科技股份有限公司

景杰生物 | 报道
赖氨酸苯甲酰化 (Kbz) 是一种含有苯环的酰化修饰,由芝加哥大学的赵英明教授于2018年首次报道[1]。Kbz主要发生在组蛋白的N-末端尾部,其修饰基团较大(是乙酰化的2倍),且有较强的疏水性(是乙酰化的3倍),这表明Kbz相较于乙酰化修饰具有更加显著的结构影响力和基因调控作用。
关于Kbz的调控酶目前已有一定的报道,如赵英明教授团队报道在人肝细胞癌细胞HepG2中鉴定出苯甲酰化修饰的去修饰酶(Eraser)SIRT2 [1],后续李海涛教授课题组报道DPF家族和YEATS家族是人组蛋白苯甲酰化修饰的识别蛋白(Reader)[2],最近的陈勇和彭超研究团队通过遗传、生化和结构分析等研究手段鉴定到酿酒酵母中Kbz的修饰酶(Writer) Gcn5、去修饰酶Hst2和识别蛋白Taf14和Sas5 [3]。然而,在哺乳动物细胞中催化Kbz的修饰酶仍然未知。此外,非组蛋白Kbz底物可能存在于哺乳动物细胞中,但这些蛋白目前仍不清楚。因此这些研究空白也阻碍了Kbz的进一步功能研究。
近日,中国科学院上海药物研究所黄河团队在iScience 上发表了题为“HBO1 catalyzes lysine benzoylation in mammalian cells”的最新研究成果[1]。该研究鉴定并验证了赖氨酸乙酰转移酶(KAT) HBO1为哺乳动物细胞中Kbz的“Writer”,并通过Kbz修饰组学鉴定出HBO1调控的底物蛋白,揭示了HBO1在细胞生理学中的非经典酶活性和功能。华东师范大学翁杰敏教授参与了该研究,景杰生物为该研究提供了Kbz泛抗体和Kac泛抗体(Anti-Benzoyllysine Rabbit mAb,PTM-761; Anti- Benzoyllysine antibody, PTM-763;Anti-Acetyllysine Mouse mAb,PTM-101)。

赖氨酸乙酰转移酶(KAT)除了催化Kac以外,还表现出催化其它赖氨酸酰化修饰的功能。因此,作者猜测可能存在一些KATs也具有苯甲酰转移酶活性。为了验证这一假设,作者以苯甲酰辅酶A和人工合成的人组蛋白H3或H4肽分别作为辅因子和底物,进行基于荧光法的体外KATs催化酰化试验,筛选出8个KATs,分别为MOF、Tip60、MOZ、MORF、HBO1、GCN5、PCAF和HAT1。只有HBO1和HAT1对Kbz表现出显著的催化活性。

图1 Kbz转移酶的体外筛选
为了评估HBO1和HAT1在细胞中的苯甲酰转移酶活性,作者在HeLa细胞中过表达多种KATs并进行了Kbz免疫荧光(IF)染色。鉴于p300和CBP的广泛酰基转移酶活,作者也将它们纳入分析。不出所料,这些KATs的过表达导致了Kac的大幅增加。但是只有在过表达HBO1、p300和CBP的细胞中,Kbz水平才会显著升高。进一步地,为了确定HBO1、CBP和p300在细胞中的Kbz转移酶活性,作者在293T细胞中过表达这些蛋白,并通过WB检测组蛋白H3的Kbz水平。与IF结果一致,WB分析显示HBO1、p300和CBP的过表达导致组蛋白Kbz水平升高。值得一提的是,p300和CBP在细胞中能够催化Kbz并不奇怪,因为它们的催化口袋足够大,可以容纳不同的酰基辅酶A。综上所述,这些结果表明HBO1可以在体外和哺乳动物细胞中催化底物蛋白发生Kbz修饰。

图2 在哺乳动物细胞中对候选Kbz转移酶进行评价
接着,为了研究HBO1是否在哺乳动物细胞中调控非组蛋白的Kbz,作者在293T细胞中过表达HBO1,并检测细胞整体Kbz水平的变化。结果表明,过表达HBO1可提高非组蛋白和组蛋白的Kbz水平,揭示Kbz转移酶活性确实是HBO1特有的。此外,作者通过分子对接预测了苯甲酰辅酶A可以通过氢键相互作用与HBO1的Thr477、Ile475、Leu511、Ser512残基相互作用,并且一个由Val472、Pro507、Pro510、Leu511和Gly515组成的大的疏水口袋可能通过疏水相互作用进一步稳定苯甲酰基团。
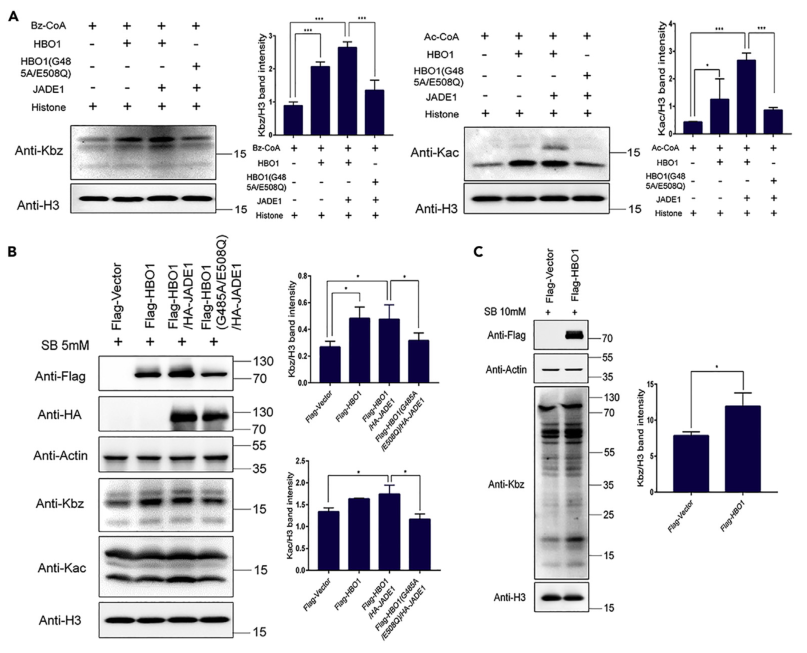
图3 HBO1在体外和哺乳动物细胞中都能催化Kbz
鉴于HBO1在哺乳动物细胞中介导Kbz,于是作者想进一步了解清楚HBO1到底靶向了哪些Kbz蛋白底物和细胞过程。为此,作者使用WT和HBO1过表达的293T细胞进行了Kbz定量修饰组学分析,总共鉴定到1747个Kbz位点,其中1344个位点可进行定量,77个位点发生显著上调。有趣的是,H4K8bz和H3K14bz分别增加了292.8倍和63.9倍,这表明HBO1可能通过调控H4K8bz和H3K14bz发挥表观遗传功能。此外,对HBO1靶向的Kbz修饰蛋白质的GO生物过程富集分析表明,HBO1可能通过Kbz通路在巨核细胞分化、着丝粒染色质重塑和核小体组装中发挥重要作用。进一步地KEGG通路分析表明,这些Kbz修饰蛋白参与了酒精中毒、剪接体和脂肪酸代谢等过程。以上分析结果表明HBO1可能通过介导细胞整体的Kbz修饰来调节细胞的多种生理和病理过程,暗示了其巨大的研究潜力。
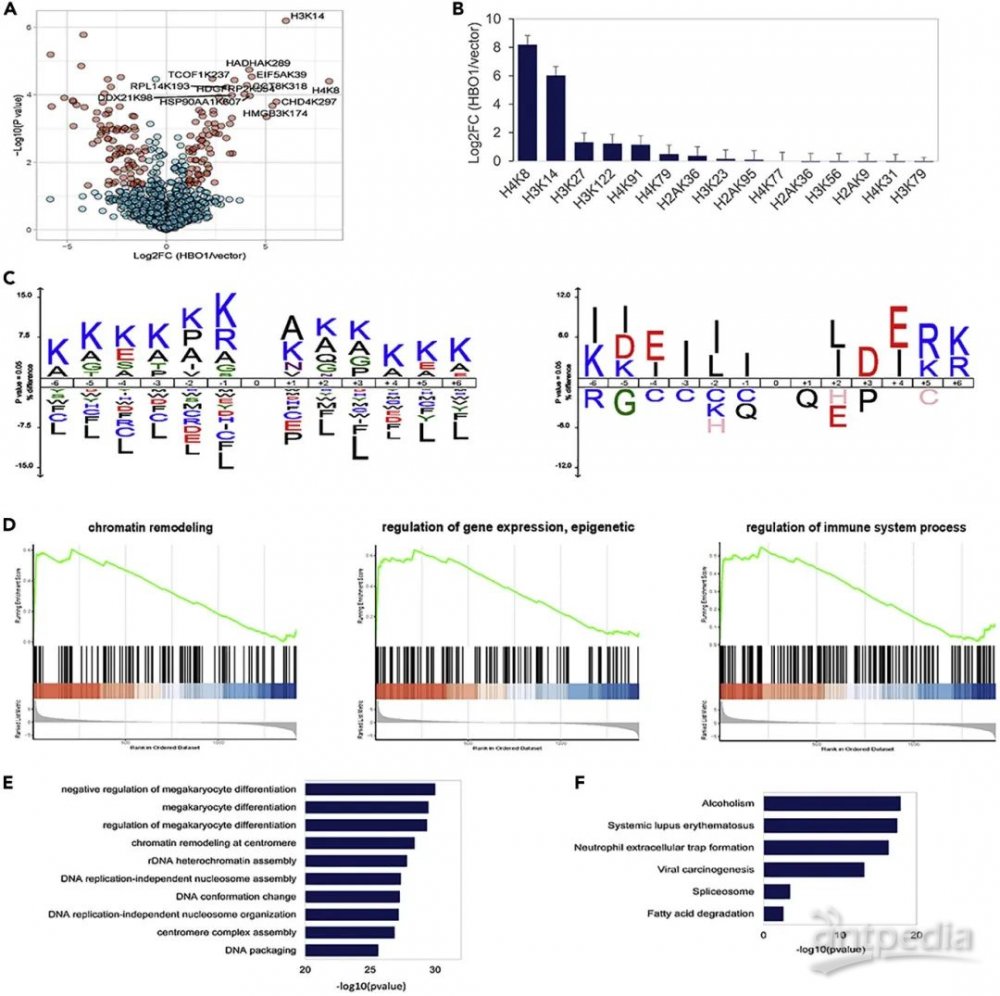 图4 HBO1介导的Kbz与多种细胞过程相关
图4 HBO1介导的Kbz与多种细胞过程相关
综上所述,赖氨酸苯甲酰化(Kbz)的调节酶和底物蛋白在很大程度上仍然未知,阻碍了进一步的功能研究。该研究鉴定并验证了HBO1是哺乳动物细胞中Kbz的“Writer”,并报道了哺乳动物细胞中的苯甲酰化修饰全景图(包括1747个Kbz位点)。生物信息学分析表明,HBO1靶向的Kbz修饰蛋白参与了染色质重塑、转录调控、代谢、免疫调控、肿瘤进展等多种细胞生理和病理过程。过量摄入苯甲酸钠会提高Kbz水平并增加某些疾病的风险,例如运动协调障碍和ADHD症状。鉴于HBO1在哺乳动物细胞中充当Kbz转移酶,研究结果为这些疾病的治疗提供了一些新的见解。
图5 本研究的工作模式图
往期精彩推荐
Nucleic Acids Res | 翁杰敏/丁建平等揭示HBO1是多种组蛋白酰化修饰“writer”
2021-09-27
Nat Comm重磅!陈勇/彭超组发现新型苯甲酰化修饰Writer,Reader和Eraser
2022-04-06
Sci Adv | 芝加哥大学赵英明教授团队揭示HDAC1-3是乳酸化去修饰酶
2022-01-20
I类HDACs是乳酸化修饰“eraser”
2021-05-18
蛋白质2-羟基异丁酰化修饰(Khib)再取得重大进展:Writers、Erasers和修饰底物的发现!
2017-12-20

参考文献:
1. He Huang, et al. 2018. Lysine benzoylation is a histone mark regulated by SIRT2, Nature Communications.
[2] Xiangle Ren, et al. 2020. Histone benzoylation serves as an epigenetic mark for DPF and YEATS family proteins. Nucleic Acids Research.
[3] Duo Wang, et al. 2022.Global profiling of regulatory elements in the histone benzoylation pathway. Nature Communications.
[4] Doudou Tan,et al. 2022. HBO1 catalyzes lysine benzoylation in mammalian cells. iScience.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
06-13 labtech
仪器行业新机遇:全国推动大规模设备更新!06-13 Sielin
有奖 | 标乐面向全球征集微观结构美图06-13 标乐中国
连续流快速原子荧光技术的开创者06-13
浙江省生态环境厅关于所属2家事业单位公开招聘人员的公告06-12
CMA现场评审的12项主要内容06-12
HJ 503—2009 空白试验值应控制在多少比较合适?06-12 检测家
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-12
电导率方法转换的桥接试验:从使用台式仪和探头转换为使用自动化的Sievers M9 TOC分析仪06-11 Sievers分析仪
宠粉时刻 | 2024年5月微信活动获奖名单06-11 Sievers分析仪
2024年德国元素服务到家火热上线 | 第一站:郑州站!免费申请06-11
三轮通知 | 浙江省第十届分析测试学术报告会06-11
最美检测家 | 成功不是偶然,努力坚持必有果——北京检大师刘金秋06-11 阿宋
TA仪器618年中大促来了!06-11
会议邀请 | 2024广东省材料分析测试技术大会06-11 材料表征的领跑者
注意注意!你买的粽子可能含有重金属!06-10
食品中亚硝酸盐的检测 | 一目了然做实验06-09 阿宋
实验室这群戏精的「反差感」真的是太强了!06-08
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-08 检测家
ACHEMA 2024 倒计时3天!6月10日,兰格邀您相约德国法兰克福06-07