连载 | 激光粒度仪在药品GMP中的应用实践之二:合规性的测试方法目标设计、开发、验证、审核
2023-02-20 14:17:17, 产品经理 沈兴志 珠海欧美克仪器有限公司
沈兴志
珠海欧美克仪器有限公司产品经理,主要负责粒度检测技术产品的应用和技术支持工作。对于粒度粒形表征基础理论、测量原理和应用技术积累了丰富、深入的实战经验,能够从粉体质量和行业要求等多个维度来分析颗粒检测与表征,为客户提供科学、独到的解决方案。
分析方法生命周期可以使用一个三阶段的概念,与目前工艺验证技术保持一致:
第1阶段:方法设计和开发(知识收集、风险评估和控制、分析控制策略、知识管理、确认准备)
第2阶段:分析方法性能确认
第3阶段:持续方法性能确认(日常监测、分析方法变更)
评估方法合规性的关键是“决策规则”。结合所生产产品的质量特性,并结合做出错误决定的概率的可接受水平,设计相关质量评价指标。这些规则根据测量的数量值、其不确定度和规格限值决定是否接受或拒绝一个产品。
根据方法的预期用途,方法的要求包括性能标准精度、选择性、灵敏度、线性和耐用性,但也包括样品周转时间、通过能力、分析总成本和易操作性。一旦定义了分析目标概况(Analytical Target Profile, ATP),就需要根据分析人员的知识、生产产品的实际情况或参考药典选择最有可能提供符合ATP的分析数据的分析技术和评价指标。随后,可通过方法设计和风险评估继续分析方法的生命周期。
在激光粒度仪的质控中,常用精密度、中间精密度、耐用性、灵敏度等指标对测试方法的性能进行评价。

方法学澡盆曲线,Region A方法开发验证,Region B 方法稳健运行区,Region C方法的维护和优化
方法设计
分析方法生命周期管理与方法的设计有关。对于成功的方法开发,了解方法的基本原理是很重要的。需要对分析方法的关键变量以及它们如何影响分析方法有充分的了解。
此外,重要的是要在开发阶段考虑收集所有信息,包括样品制备和标准溶液制备,以确保最终方法适用性和耐用性。因此,方法设计不仅要考虑ATP,还要考虑分析实验室的能力和人员教育状况。

▲ 激光粒度仪粒度微分分布图及特征粒径D50,D90
当粒度分析结果用于颗粒产品质量判断时,普遍地选取D10、D50、D90这三个特征粒径,分别作为材料中粒径较小、中间和较大的颗粒的代表性粒径数值。通过设定D10、D50、D90的许可范围作为质控依据,可以使实际生产中的颗粒材料符合相对应的质量要求,在工业生产的来料、过程产品和终产品的质控中发挥着积极的作用。

然而,随着工业原材料和工业制品质量水平的不断提高,不少行业对颗粒产品的质量提出了更高的要求,例如对极少量离群组分的关注、对混合材料的混料比例及均匀性质控等等。
举例来说,通过在标准样品中添加不同粒径级配的粉体以改善粉体的填充性能、流动性或混匀性能等,如果要对混合物料的混料过程进行质控,需要准确地进行各组分配比的测量。当细颗粒添加量较少时,选用D10、D50、D90不一定能准确反应质控目的。此时,可以选用一定粒径以细的累积含量或粒径区间的含量作为质控指标。
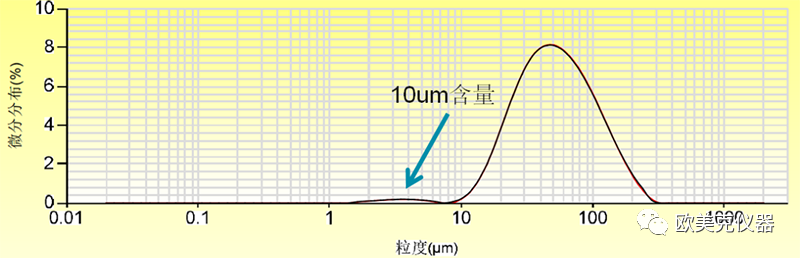
一个典型的含有一个少量组分的混合物料的粒径分布的例子如下图所示,可以选用10um以细含量作为小颗粒混匀情况的质控。更多的案例请参考本公众号历史文章:《粒径分布的表述与激光粒度仪的质控指标的设计》。
方法开发
方法开发的策略受到方法设计决策过程中选择的分析目的的影响。在激光粒度仪的实践中,样品的取样和制备方法的开发和分析方法开发同等重要,通常对整个方法的结果至关重要。当样品取样、分散方法不理想时,可能会影响到方法的精密度、耐用性、方法转移等。
通过合理的设计试验,利用分析结果的精密度、中间精密度和灵敏度的变化来找出质控中的薄弱环节,从而不断优化粒度测量的条件和方法,以达到提高质控水平的目的。激光粒度仪测试结果真实性水平与诸多因素有关,这些因素在最终结果上的影响互相叠加,导致仪器使用人员往往在优化质控体系时难以找到头绪。
举例来说,对于一些同时含有较大颗粒和较小颗粒的分布宽的且微溶于水的易碎样品,测试结果非常不稳定,如何提高其粒度测试的真实性呢?最佳的方法是设计一系列试验在样品、仪器、方法和参数上进行逐一的分析,弥补或规避薄弱环节,形成最优的质控解决方案。
1
根据实验室条件和样品特性选择合适的测试介质
理想的测试介质宜选用与颗粒亲润性好且不易导致被测颗粒发生溶解、膨胀、凝聚等变化的常用媒介,例如水,乙醇,矿物油,油酸甲酯,空气等。通过观察单次取样的重复性(精密度)、多次取样的重现性(中间精密度)来判断选用介质是否合适。
一般来说,在介质中具有一定溶解性的颗粒在循环检测中常表现出遮光率下降,小颗粒优先于大颗粒溶解的现象,伴随着测试结果的波动。由于原料药成份以有机物为多,部分颗粒可能无法找到完全不溶的介质,更适宜选择压缩空气分散的干法测试系统。
2
根据颗粒在介质中的分散特性选择相应的表面
活性剂和分散解聚剂
部分颗粒由于表面疏水特性,在水中加样时易发生漂浮或抱团的现象。对于此部分样品可以选取少量较低浓度的表面活性剂润湿颗粒后加样,观察加样后循环体系稳定性选择是否加入分散解聚剂或启用其他解聚手段以达到稳健测量的目的。部分易潮解结团的干法测试样品可以选择加配旋转钢珠辅助分散。
3
稳健测试方法的开发
颗粒相关的取样分散手段多种多样,测试方法开发的重点是让颗粒在不被破坏的前提下处于相对稳定的分散状态下被检测,此时测试结果相对稳定,受环境条件的细微变化的影响最小。
对常见的样品分散方法,例如搅拌速度,超声强度和时间,分散解聚剂的使用和用量,分散压力的大小,下料速度、加样量(遮光率相关)等的控制,通常采用在不断加强或减弱相对应分散方法的同时实时记录粒径结果和对相应参数变化制图进行分析。通常所得的图像包括若干快速变化的过程和一个平台期,类似酸碱滴定的曲线,所以通常被称作滴定法方法开发。

▲ 典型的激光粒度仪湿法分散过程
如上图所示,在样品加入进样器循环搅拌30秒后开启超声,每10秒测试一次记录测试结果。可以看到经过搅拌和超声分散1分钟以后特征粒径D50、D10和D90趋于稳定,我们最终选取分散1分30秒稳定状态的分散条件作为该标号产品的测试标准,可以明显减少结果的波动,从而提高了质控的稳健性。

▲ 典型的激光粒度仪干法分散压力滴定过程
比如,在干法测试中最重要的参数是分散气压。选择多大的分散气压,一方面需要保障较细颗粒的分散效果,另一方面要尽量避免高压力梯度气流对样品颗粒的破碎效果。评估此参数选择是否合适的方法,一是逐步增加、减少分散气压看测试结果随之的变化。一般伴随从低到高的分散压变化可以看到测试结果逐渐变小,到达一平台期后,又进一步减小。前段是随分散压提高颗粒逐步被分散彻底,团聚减少达到稳定;后段则可能是样品颗粒发生了碎裂。
一般来说,随着分散进行,代表大颗粒的D90将比小颗粒的D10更早稳定下来,如果发生了颗粒破碎,D90波动常常大于D10。如上图所示,该样品干法测试宜选用1.5bar左右的分散压力,可以获得最佳的中间精密度结果。对于一些非常脆弱的样品,则可能在未完全分散的情况下就发生了碎裂,此种情况就需要严格保证在一致的条件下分析样品,最好能结合其他方法学测试手段来确定最佳测试条件,例如采用显微图像法或以湿法测量等。部分仪器内置了分散压力和负压力传感器,在测试条件的一致性把控和结果追溯时都可以起到积极的作用。
类似的我们可以在其他条件不变的前提下,逐一找到各相关取样、分散、测量的最佳条件,并把这些方法及相关参数以SOP测量文件固定下来,用于未来同类样品的质控。需要说明的一点,科学的分散并不总是意味着将颗粒分散到最彻底,适宜的颗粒表征测量宜尽量模拟颗粒在工艺或应用中的状态进行,结果更具应用指导性。
4
分析仪器的选择
通过模拟质控目标,对仪器的测试性能,例如所关注指标的线性等进行考察,可以快速分析仪器质控能力。由于具体样品可能存在不稳定的因素,所以一般采用与待分析样品粒径分布接近的稳定的已知样品来考察仪器的质控性能。可根据质控要求设计相关测试,验证仪器是否具备诸如准确识别测试范围内各样品整体粒径分布,是否能准确识别样品各组份颗粒大小和含量,以及仪器灵敏识别样品或组份的细微差别等的能力等,结合产品质量评价要求进行选择。
例如,对于不稳定或易碎样品,宜用尽可能温和的分散条件,在分散稳定的状态下进行测试,这样对仪器分散压的监控和准确性提出了更高的要求。对于与光源有强吸收、反射或双折射特性的样品,典型的例如一些红色黑色着色添加剂,或二氧化硅、氢氧化铝粉等辅料,可以选择具有不同波长/颜色光源的粒度仪进行匹配测试提高测量结果的真实性。

● 测试范围:0.1-1000μm
● 重复性:优于1%(标样D50偏差)
● 对中方式:智能自动对中,对中精度0.5μm
▲ 欧美克LS-609 激光粒度分析仪
5
系统方法开发
与传统方法相比,一种更系统的方法是使用统计方法或软件辅助作为快速有效的测试工具。在过去的几年里,对系统方法开发策略进行了大量的研究,FDA的“21世纪药品当前良好生产规范(CGMPS)——基于风险的方法”倡议也推荐了一种系统方法。QbD概念可以扩展到分析方法开发,包括方法目标的定义、风险评估、设计空间的规范、实施控制策略和持续改进,以提高方法的耐用性。质量风险管理(QRM)过程在ICH Q9指南中有详细描述,包括风险评估、风险控制和风险评审(图4)。
在开发分析方法的各个阶段,可以使用“鱼骨”图或失效模式影响分析(FMEA)和优先级矩阵(PM)进行风险评估,以评估对方法性能影响最大的因素。
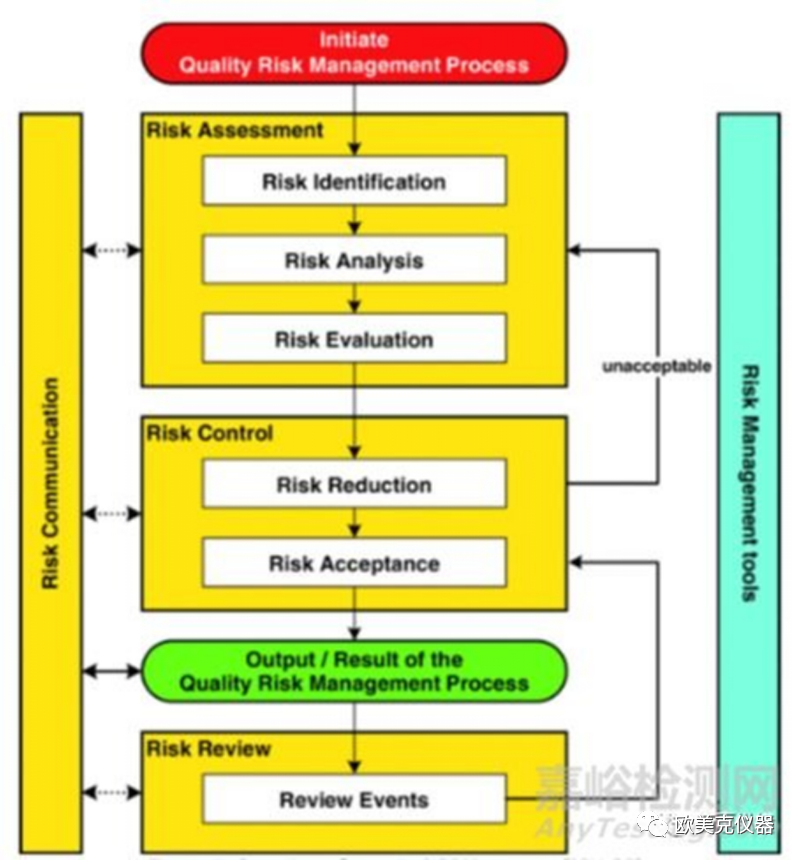
▲ QRM过程概要
方法验证
生命周期的第二阶段,当物理测试作为放行目的的时候,需要对分析方法进行性能的验证。方法性能验证的目的是确认该方法将按预期运行,并满足先前定义的ATP标准。SOP可以作为验证粒度分布方法的协议。方法验证中通常考虑的参数包括精密度、线性、准确度、灵敏度、耐用性等。它们的相关性很大程度上取决于ATP。
方法转移和连续方法性能验证
在大多数产品生命周期的某个阶段,从开发、扩大、制造、生产和投产到批准后阶段,都会将工艺转移到另一个地点。对于分析方法的转移,也有类似的程序。目前的方法转移包括比较测试、方法联合验证、方法验证或再验证或转移豁免作为替代策略。方法转移过程中,应当进行严谨的风险评估,来确定需要进行对比的参数,使得在新的环境下依然能保持分析方法对质量目标进行有效的评价。
方法开发和验证完成后,根据方法生命周期可用的风险评估和数据建立方法控制策略,然后将该方法用于常规用途,其中建立对方法性能随时间变化的连续监测,并可在需要时进行改进。技术进步与监管要求的变化都有可能导致分析方法的变更。作为分析方法生命周期的一个重要方面,性能验证用于检查方法在日常使用中的运行方式,以及结果数据是否适合其预期用途。USP<1010>“分析数据-解释和处理”,提到了对分析性能数据进行常规监测的连续程序,可通过跟踪实际样品或标准结果、系统适用性数据趋势分析、稳定性研究的精度评估或参考批次的分析来实现。
方法失效
作为方法生命周期的最后阶段,其终止也应遵循质量管理原则。一方面,需要考虑数据存储,特别是在规范环境中使用该方法时。然而,越来越多的研究机构否认原始数据存储也值得关注。为了能够在原始分析方法终止后的几年内重新评估数据,还需要考虑相关软件的存储。由于实验室范围的变化,一种方法可能被完全终止,或者一种新的方法可能基于结论,以满足新定义的ATP要求。如果一个新方法是基于失效的方法,则可以使用早期生命周期的某些部分来启动新方法。
连载说明
OMEC
《激光粒度仪在药品生产质量管理规范(GMP)中的应用实践》系列连载文章之《实践之三:合规性的计算机化系统要求和审核》等将在“欧美克仪器”微信公众号持续更新,敬请关注!
参考文献:
1.《粒径分布的表述与激光粒度仪的质控指标的设计》,欧美克仪器微信公众号
2. 《稳健的粉体、剂型激光粒度仪颗粒粒径质控评价》,世界农药第42 卷第7 期 41-51, 2020 年7 月
往期精选

连载|药物一致性评价与粒度分析

连载|稳健的粉体、剂型激光粒度仪颗粒粒径指控评价
【直播课回放】《粒度测试在制药行业应用中的几个关键问题》
更多仪器内容咨询
方式1:
拨打售前热线:400-902-5338、18675639766
方式2:
05-24
实战演练,技能精进——连华科技助力郑州市生态环境执法大队技能培训05-24
5月18-28日,快检系列双重优惠火热进行中!05-24
【海能实验室】膳食纤维测定仪测定可溶性、不可溶性及总膳食纤维含量05-24
陕西、北京、天津、湖北……渠道商交流会再更新!05-24
佳绩频传,宸安生物5月再获三项殊荣!05-24 市场战略中心
Opentrons Flex:让文库制备流程更便捷!05-24 Opentrons
2024半导体先进技术创新发展和机遇大会圆满闭幕05-24 优尼康
展会预告丨2024中国平坦化技术大会05-24 优尼康
【展会预告】钢研纳克邀您参加CISILE 第21届科仪展05-24
「钢研纳克」即将在 WCNDT 2024世界无损检测大会闪亮登场05-24
闪耀制造之巅|钢研纳克获颁制造业单项冠军企业证书05-24
HPLC-ELSD分离检测鲸蜡硬脂醇聚醚-2505-24 Unimicro
胤煌YinHuang与您相约武汉丨2024药品质量控制与检验技术大会05-23
上海交大/上硅所黄富强课题组设计新型超快充钠离子电池负极材料 | 用户成果速递05-23 HORIBA
【设备更新仪器推荐】高速高分辨显微共焦拉曼光谱仪——LabRAM Odyssey05-23 HORIBA
2024 ASMS,快来看看有哪些亮点?05-23 沃特世
半导体行业解决方案之共聚物分析05-23 沃特世
[inform]2024沃特世信息学全球用户大会圆满落幕!05-23 沃特世
UPLC,20岁生日快乐!05-23 沃特世