验证于品,服务于心 | 你想知道的SU验证,全在这里了(上篇)
2023-02-13 10:27:29 Merck工艺解决方案
上期我们给大家介绍了除菌过滤工艺验证中的细菌截留验证。本期和下期的重点则会放到近两年法规机构申报和审计越来越关注的重点:一次性系统(SU)的验证和相关可提取物、浸出物以及安全性评估的内容。
01
SU法规及行业规范
一次性系统是由多个可替换的直接使用的不同组件组装而成,例如:过滤器,2D和3D储液袋,储液桶,多种类的连接器,取样系统,终端制剂的定制装配,混合系统,生物反应器,澄清系统,纯化系统,TFF超滤浓缩系统和除病毒系统等,应用于整个生物药品的生产过程中(见图一)。
与传统不锈钢系统相比,SU在应用上有着很多优点,例如:厂房设计与建造迅速、不需清洁验证、占地小(配套洁净设施数量降低)、低造价成本、全封闭流程,即用即抛、高机动灵活性。
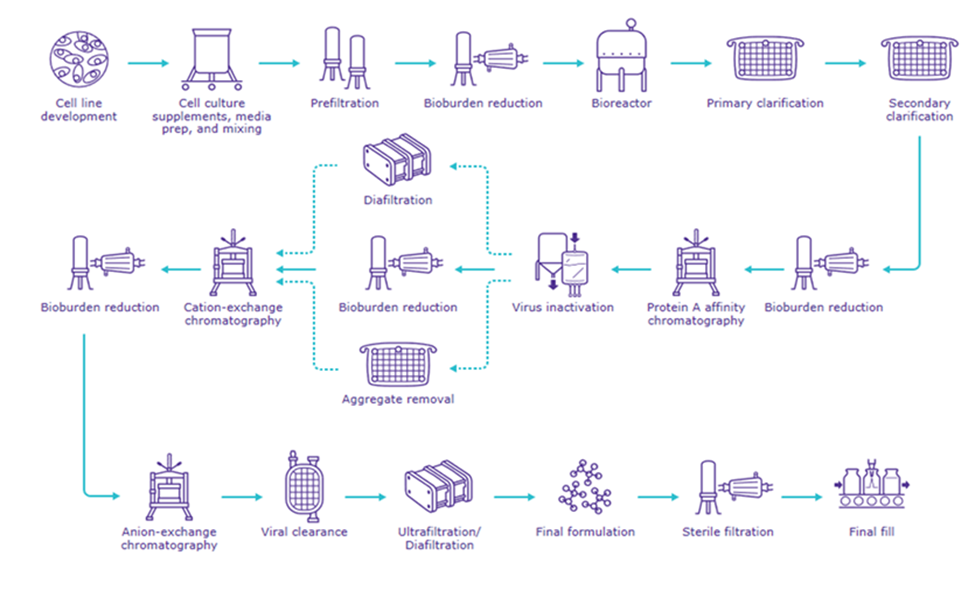
▲图1:典型单抗生产工艺流程
面对一次性工艺的日益普及,监管部门和业界都在努力寻求建立相关标准,聚焦生物药品一次性生产工艺。一次性系统的质量属性和应用风险等在行业规范和标准机构中已经有相应的内容:
可提取物和浸出物:几乎所有组织都有相应的章节讨论,比如美国药典、BPOG等:
• USP <661>: Plastic Packaging Systems and TheirMaterials of Construction
• USP draft <665>: Polymeric Components and SystemsUsed in the Manufacturing of Pharmaceutical and Biopharmaceutical DrugProducts.
• USP draft <1663>: Assessment of extractablesassociated with pharmaceutical packaging/delivery system. Pharmacop. Forum39(5) 2013.
• USP draft <1664>: Assessment of drug productleachables associated with pharmaceutical packaging/delivery systems.Pharmacop. Forum 39(5) 2013.
• BPOG: Standardized Extractables Testing Protocol forSignlt-Use Systems in Biomanufacturing, November 2014.
• BPOG:Extractables Testing of Polymeric Single-Use ComponentsUsed in Biopharmaceutical Manufacturing, April 2020.
• BPOG: Leachables Risk from Polymeric Single-Use SystemsUsed in Biopharmaceutical Manufacturing, April 2020.
颗粒物
• BPSA: 2014 Particulates Guide.
变更控制:在BPSA、ASTM、ISPE和BPOG出版物中有相关内容:
• Kline S, et al. Change Notifications for Single-UseComponents: Criteria from an End-User Perspective. Pharma. Eng. 34(3) 2014.
• Whitle, T. and Ott, K. Management, Notification, and Documentation of Single-Use Systems ChangeOrders: Challenges and Opportunities. Bioprocess International. October 2015.
• Single-use change control standard.
-Change Notifications for Single Use Components.
- Criteria from an End User Perspective (Paper publishedMay 2014).
-Draft PowerPoint shared via ASTM E55 members on November4, 2013.
此外,关于SU的设计确认、生物相容性、系统完整性、供应管理等都成为当前业内的工作重点。
SU中的终端制剂灌装系统与料液直接接触,涉及的关键组件包括一次性袋子,管路,连接器,过滤器等(见图二),因其处在工艺末端,有较高的风险,因此是验证的重点。
目前国内外法规及行业规范中没有单独讨论SU验证的章节,因此主要参考美国FDA和欧盟GMP的通用指南进行的。两份GMP指南中都相同地提到用于药品生产的设备不应该与产品发生反应、添加物质或吸附作用从而影响药品质量。

▲图2:一次性系统示意图
02
《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》
2020年6月2日,国家药监局药品评审中心发布了《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》,阐述一种基于科学和风险的研究思路来开展注射剂生产过程中使用的塑料组件系统的相容性研究。其中提出制剂申请人/药品生产企业需要对组件系统类型、液体特点、生产工艺等可能引入终产品浸出物的多个维度进行科学评估,基于风险评估结果开展相应的相容性研究工作。对于可提取物,可根据风险级别确定相应的研究工作。同时,申请人也需关注组件系统可能对药液产生吸附并进行研究。
国家所发布的征求意见稿中也借鉴参考了国外历年修订出版的各个行业组织机构以及相关的国外指南。其中具有代表性的相关规范包括:USP,BPOG,BPSA等。
03
United States Pharmacopeia (USP) <665> Draft
USP<665>由之前的USP<661.3>章节更新而来,在2017和2019年分别更新了两版草稿,草稿中对塑料组件和系统的验证内容加以规定,并阐述了一次性系统对于验证过程的流程以及具体要求。
首先,一次性系统组件需要根据下图确认是否需要评估。

▲图3:一次性系统或组件评估流程图
其次,不同材料和组件需要用不同的测试方法。若一次性系统可整体被验证,则相关材料无需分别进行验证。验证需进行风险分级,分级方法可参考如下表格,级别不同的组件对应下表中不同的测试方法。

▲表1:USP<665> Draft基于风险选择相应的测试方法
其中溶液C1为pH=3的酸性提取液,溶液C2为pH=10的碱性提取液,C3为体积比1:1的乙醇水溶液。高风险的部分组件在下表中进一步被要求40℃长时间的提取环境,而塑料组件和系统的整个提取过程被限定为动态模拟的振荡或再循环。对于USP<665>Draft中关于可提取物的方案,总结如下图:

▲图4:USP<665>draft 中可提取物方法总结
04
BioPhorum Operation Group (BPOG)
BPOG是药企主导与部分供应商参与的国际性联盟组织。其在2014年出版了一份标准化的可提取协议,业内广泛的称为“BPOG协议“,它成为了BioPhorum组织一次性 5 年计划的重要元素之一,去寻求加速行业内对一次性系统的了解和应用。
BPOG出版的文章“Extractables Testing of Polymeric Single-Use Components Used in Biopharmaceutical Manufacturing”详细介绍了相关提取溶剂,仪器分析方法,相关模拟条件,接触时间和温度等。标准运用大量表格对于一次性组件和系统具体的测试条件都有相应的规范要求,本文不进行具体赘述。
仅对2020年推出的新版规定与2014年版本的更新进行比较。2020版本删除了5M NaCl和1%吐温80模拟溶剂,剔除0间隔时间区间(elimination of the time point zero interval), 剔除 50%乙醇提取物的元素分析。2014版(上)与2020版(下)对比如下图所示。


▲图5:BPOGStandard 2014&2020 可提取物方法总结
05
BioProcess Systems Alliance (BPSA)
BPSA生物工艺系统联盟全称BioProcess Systems Alliance,成立于2005年,是一个以工业为主导的国际工业协会,致力于鼓励加速生物制药和疫苗生产中使用一次性制造技术。
BPSA出版的“Recommendations for Extractables and Leachables Testing,they recommended program for addressing extractables and Leachables”报告中指出:第一,所有材料和产品有接触的,都需要去考量其可提取和浸出物,如果一些材料只是短时间的和产品相接触,对于这些相关的材料是可以忽略的。第二,要根据关键风险要素去对材料的兼容性,相关组件距终端产品的位置,产品成分,组件表面积,接触时间和接触温度进行可提取和浸出物相关的风险评估。
在进行可提取和浸出物研究过程中,需要选择合适的提取条件,选择至少两种溶剂,水和低分子量醇(比如乙醇或者正丙醇)并适当添加其他有机溶剂进行模拟。有了合适的模拟溶剂后,提取实验要在最差的提取温度和提取时间下进行。
推荐的仪器分析方法有HPLC和GC-MS,LC-MS,ICP 和ICP-MS,额外方法包括TOC,NVR及FTIR。总结如下图:

▲图6:BPSA 中可提取物方法总结
综上,我们本期介绍了一次性系统当前的法规和行业动态,并重点介绍了USP, BPOG以及BPSA的可提取物及浸出物内容。
下 期 预 告
下期我们将着重介绍安全性评估的内容。当我们获得SU的可提取物和浸出物数据后,又将如何评价这些数据对药品质量和病人安全的影响呢?
欢迎您继续关注我们本期 “验证于品,服务于心”系列之下期内容:你想知道的SU验证,全在这里了(下篇)
往期回顾
验证于品,服务于心 | 细菌截留知多少验证于品,服务于心 | 走进默克验证服务之物理测试验证于品,服务于心 | 何时验证及再验证,你知道吗?验证于品,服务于心 | 验证法规你需要知道的事全新体验,更快服务 | 新版在线默克BioReliance® 验证需求表上线啦!

默克中国BioReliance®验证服务实验室推荐您通过以下方式在线填写验证报价需求表,带给您全新的体验,更快为您服务!
1
或复制网站链接
进行登陆
提交报价需求
https://www.merckmillipore.com/CN/zh/20200129_130103
2
使用手机扫码
在线填写

温馨提示:扫码进入网站默认是英文,您可在页面上方切换中英文,便于阅读!

关于默克工艺解决方案
默克工艺解决方案是默克生命科学三大事业部之一,致力于为生物制药、化学制药企业提供产品开发、商业化生产所需全系列工具,已成为预过滤、无菌过滤、除病毒过滤、超滤、层析纯化、一次性生产、培养基、生物反应器、缓冲液、药用原辅料、工程技术及验证领域的全球领导者。默克工艺解决方案的成功源于对高质量产品、先进监管技术的不懈追求以及致力于帮助客户实现其需求的精神。
如需了解更多关于默克工艺解决方案,
默克工艺解决方案领英官方账号已上线,
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家