质量小讲堂|关于医疗器械“身份证”的国内登记——UDI,你知道多少?
2023-02-02 17:06:10, Calibra 杭州凯莱谱精准医疗检测技术有限公司

UDI是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。UDI是医疗器械在其整个生命周期赋予的身份标识。UDI系统分为三部分,UDI编码,UDI数据载体,UDI数据库。
采用统一的、标准的唯一器械标识(Unique Device Identification,UDI)有助于提高医疗器械的监管效率和透明度,有利于实现信息共享与交换,完成对医疗器械从厂商到供应链再到用户各个环节全生命周期的管理。同时UDI的实施,有利于不良事件的监控和问题产品召回,提高医疗服务质量和响应。
UDI编码
国内认可的发码机构必须为中国境内的法人机构,具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合国家数据安全有关要求。我国有三家认可的UDI发码机构,分别是中国物品编码中心(GS1)、中关村工信二维码技术研究院、阿里健康科技(中国)有限公司,其中GS1是全球使用范围最广、接受度最高的发码机构。
UDI编码在国内分为DI码(静态编码/器械标识),PI码(动态编码/生产标识),编码的规则如下:
举个UDI编码的例子
UDI数据载体
UDI数据载体UDI的数据库有三种模式,一维码、二维码和射频标签。采用一维码时,可将产品标识和生产标识串联,也可多行并联;采用射频标签时,应当同时具备一维码或者二维码。
注册人或者备案人对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体,并确保在医疗器械经营使用期间唯一标识数据载体牢固、清晰、可读。
UDI数据库
目前UDI数据库是UDI的DI所代表的信息,仅包含产品标识部分,不包含生产标识信息。
UDI码的三个重要特点:
(1)唯一性是首要原则
(2)稳定性
(3)可扩展性
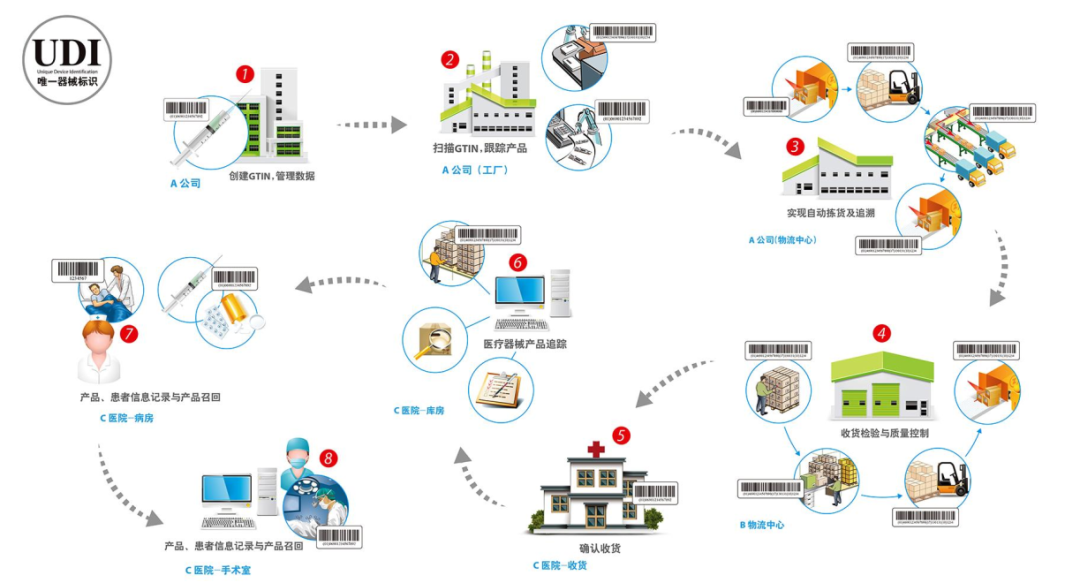
注册人/备案人实施唯一标识的流程是什么?

UDI可以实现产品全生命周期的管理,实现产品从注册人/备案人→生产厂家→各级物流→客户端和用户端的识别和追溯
参考文献
[1]. 《医疗器械唯一标识系统规则》国家药监局2019年 第66号
[2]. YY/T 1630-2018 《医疗器械唯一标识基本要求》
[3]. YY/T 1681-2019 《医疗器械唯一标识系统基础术语》
[4]. GB/T 33993-2017 《商品二维码》
[5]. GB/T 16986-2018 《商品条码 应用标识符》
06-06 Unimicro
Nature 发文! 如果有一天,线粒体也能被移植……06-06 小 M
实验操作 | 小白第一课!基础细胞培养方法及步骤06-06 小 M
科研助攻 | Nature Review:癌症治疗抗体药物最新综述06-06 小 M
端午礼遇 | 玩游戏,选周边,宠粉福利,只 "粽" 意 你~06-06 小 M
发货通知 | MCE 中国祝大家端午安康06-06 小 M
“岛津森林”项目06-05 医疗中心
浙江以检测赋能新质生产力06-05
2025版《中国药典》收官在即,变化要点有哪些?要注意哪些方面?06-05
吸附管采集固定污染源废气中的VOCs时的采样流量要求?06-05 检测家
内卷加剧,检测机构如何破局应对?06-05
【人民日报国际】在收获与播种交织的芒种中国时刻,张轶昊谈创新。06-05
德国元素耗材之星 | 固体压样器/液体封样器06-05
夏日焕新 谱写新章 | 德米特第四届“互动日”惊喜而至06-05
祝贺嫦娥六号月背采样成功 | 盘点标乐助力月球样品分析06-05
2024年德国元素巡检活动 | 第一站:成都站!免费申请06-04
会议通知|第一届小动物活体成像技术前沿与应用网络研讨会06-04
蛋白质组学从发现组学跃入临床怀抱的跨越之旅06-04
内毒素检测的思考 - 采用药典方法同时减少鲎试剂的使用06-04 Sievers分析仪
检测家十周年特惠 | 赛默飞、岛津、沃特世 系列产品租六送一!06-04