Cell | 结合蛋白质组与外显子组技术构建转录因子互作图谱,揭示先心病的遗传决定因素
2022-11-09 08:55:47, 小迈 武汉迈特维尔生物科技有限公司
GATA4和TBX5是两个重要的心脏相关转录因子,也是在家族性先天性心脏病(CHD)中最早确定的单基因,在整个基因组中协同作用于DNA以调节心脏发育。研究团队通过整合蛋白质组学和人类遗传学方法,解析人类心脏祖细胞内源性GATA4和TBX5的蛋白质相互作用体,以识别和优先检测潜在的心脏疾病基因、CHD相关变异体,揭示了心脏基因调控的各方面功能。

1. 识别心脏祖细胞中的GATA4和TBX5蛋白互动体
为了确定人类诱导多能干细胞衍生的心脏祖细胞(CPs)中的GATA4和TBX5蛋白相互作用(GT-PPI),使用针对每个内源性cTF的抗体进行亲和纯化和质谱分析(AP-MS)(图1A)。使用CRISPR-Cas9-gRNA核糖核酸蛋白,产生了克隆TBX5或GATA4同源基因敲除(KO)hiPSC系作为阴性对照。这些对照系被分化到CP和心肌细胞(CM)阶段,并确认没有各自的cTF表达。与以前的报告一致,尽管跳动延迟,分化效率降低,GATA4和TBX5KO 细胞能够分化成心肌细胞。
GATA4或TBX5质谱数据来自于用RNase和DNase处理的野生型(WT)或KO样品的第6天细胞核富集的CPs的三个重复,以关注核酸无关的相互作用(图1A)。通过使用已建立的蛋白质-蛋白质相互作用算法SAINTq对WTAP-MS 实验中确定的蛋白质与相应的KO对照进行评分,得到 WTCPs 中GT相互作用者的初始列表。进一步根据核定位和与诱饵蛋白在同一细胞中的共同表达,对SAINTq确定的高分相互作用物进行了额外过滤。排除那些在KO细胞中与WT细胞相比mRNA下调的蛋白质。这种方法总共产生了272个蛋白质,其中包括几个以前报道的GATA4和TBX5相互作用物,以及新的相互作用物。这些相互作用物中的几个突变先前与人类或小鼠心脏畸形有关,突出了本方法在疾病基因发现方面的潜力(图1B、1C)。
与GATA4和TBX5在心脏发育过程中的相互依赖性相一致,它们的网络显示出一些重叠,但大部分检测到的相互作用物对每个cTF都是独特的(图S2C)。两个网络都富集了参与类似生物过程的蛋白质(图1B-1D)。代表最多的两个过程是转录调控和染色质修饰(图1D),这是由于cTFs在基因调控方面的功能已经得到证实(如ZFPM1、ZNF787、SALL3、ZNF219和MAB21L2),表明了AP-MS方法的敏感性(图1B、1C)。染色质修饰剂(分别占GATA4或TBX5相互作用物的25%或15%)主要属于ATP依赖性复合物,在 GATA4-PPI中发现了几个修饰酶(图1B、1C)。一些RNA处理和剪接蛋白以及核孔复合体的成员也被确认(图1B、1C)。GTPPIs主要包括普遍表达的蛋白质,还有少量组织富集和细胞类型富集的相互作用物(图1E)。

■ ■ ■ ■ ■
图1. 人iPSC源性心脏祖细胞中GATA4和TBX5蛋白间子体的生成
2. GATA4:TBX5相互作用组在CHD中富含携带新的变体的蛋白质
为了确定在人类CPs中发现的GT相互作用因子是否有助于预测CHD的遗传风险因素,评估了它们与PCGC中发现的CHD疑似患者的新发变体(DNV)和非常罕见的(小等位基因频率[MAF]<105)遗传性功能丧失(LoF)变体的交叉。除了以前发表的父母-后代CHD三人组和对照组的队列外,还包括了另外419个CHD受试者及其父母的变异数据,总共有3000多个三人组。使用基于排列组合的统计学测试来分析与对照组相比,在CHDprobands 中GT-interactingproteins 的变异频率。简而言之,在一个相互作用基因中发现DNV的观察几率(OR)被一个校正同义突变频率的因素所调整(调整后的OR),然后与数据集的病例/对照状态被打乱的几率分布(打乱的OR)进行比较(图2A)。分析表明,相对于对照组,改变蛋白质的DNVs在CHD队列的GT相互作用体中明显更容易被发现。相比之下,非常罕见的遗传性LoF变异发生在GT-PPI蛋白中,在对照组和CHD组中频率相同(图2B)。
为了确定这种富集是否主要是由以前已知的参与心脏发育的基因驱动的,从数据集中删除了一个已发表的参与人类或小鼠心脏畸形的基因列表,并重复了基于排列组合的分析。仍然发现,在GATA4和TBX5相互作用组中,CHD受试者携带改变蛋白质的DNVs的蛋白质富集(图2B)。在144个已发表的人类CHD基因的小名单中也观察到类似的趋势。
尽管AP-MS分析是在人类CP细胞中对内源性TBX5和GATA4进行的,但大多数PPI都是在生物相关性较低的细胞中和过表达后被鉴定出来的。为了评估生物背景的重要性,在过表达人GATA4或TBX5的肾脏细胞(HEK293)中产生了GT-PPI,并对它们进行了与CHD和对照组相同的排列组合分析。携带CHD相关蛋白改变的DNVs的蛋白质没有明显的富集(图2B)。细胞类型之间的GT-PPI重叠较小,只有20个GATA4和13个TBX5-interactors共享,突出了内源性组织特异性蛋白-蛋白相互作用在阐明人类疾病的遗传基础中的重要性。
在一个补充性的分析中,为了测试GTPPI中的基因是否富含改变CHD患者蛋白质的DNVs,对相互作用者的名单进行了置换,并统计了每个基因组中发现的变异数。这能够比较在其他可比较的非GTPPI基因中发现的变异数的无效分布与我们在交互组基因中观察到的情况。对于GT-PPI中的每个基因,确定了具有可比性的从头变异得分的其他基因。根据WTCP 细胞中表达水平的相似性,进一步缩小了匹配名单。与具有相似突变性和表达量的非交互组基因的混合选择相比,GT-PPI基因中观察到的改变蛋白质的DNVs数量明显较高。相反,在GT-PPI基因中,非同义或罕见的遗传性LoF变体没有富集。
在证明了GT-PPI富含在CHD患者中发现的改变蛋白质的变体后,旨在评估GT-PPI变体对疾病有贡献的可能性。使用联合注释依赖性耗损(CADD)评分,发现在CHD病例中发现的GT-PPI蛋白改变变体比GT交互组以外的CHD病例中的其他蛋白改变DNVs更可能被预测为有害的(图2C)。

■ ■ ■ ■ ■
图2. GATA4和TBX5相互作用蛋白中CHD的富集
3. GATA4:TBX5与改变蛋白质的DNVs相互作用者揭示了具有疾病基因特征的CHD候选基因
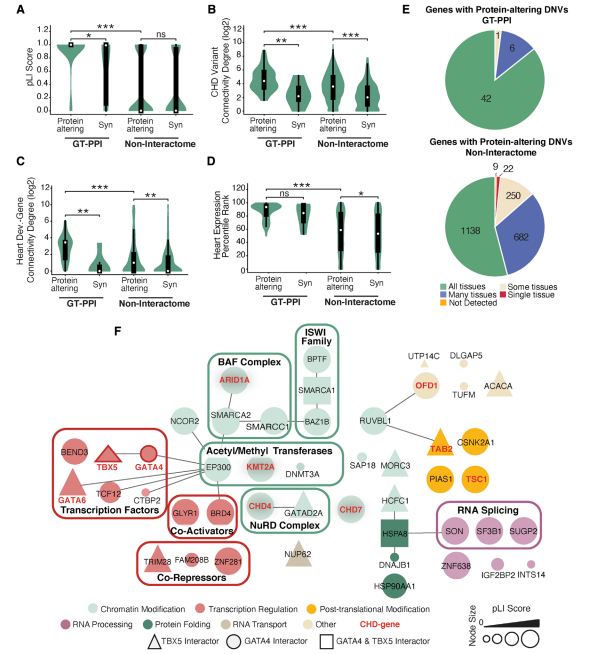
接下来问,与其余在CHD疑似患者中发生突变的非交互组基因相比,GT-PPI中确定的候选CHD基因是否表现出可增加其致病可能性的特征。值得注意的是,PPI中的大多数候选CHD基因对LoF变异极为不耐受(对LoF不耐受的概率[pLI]>0.9),并表现出明显高于交互组以外的具有改变蛋白的DNVs的pLI和haplo-insufficiency得分(图3A)。疾病基因的另一个特点是,当它们的突变导致类似的表型时,其产物相互作用的趋势增加。根据iRefIndex数据库的信息,候选基因所编码的蛋白质与CHD队列中发现的其他蛋白质以及与参与小鼠/人类心脏畸形的蛋白质的整理列表的连接程度要高于具有改变蛋白质DNVs的交互组以外的蛋白质(图3B和3C)。
在CHD患者中,具有改变蛋白质的DNV的GT互作体在发育中的心脏中的表达量高于GT-PPI以外的具有改变蛋白质的DNV的基因(图3D),但它们一般在大多数细胞类型中显示出广泛的表达模式(图3E),并且主要涉及与染色质生物学有关的蛋白质(图3F)。其他在CHD中具有未被探索的作用的生物过程也受到影响,如RNA剪接和蛋白质折叠(图3F)。此外,尽管在患有CHD并伴有心外畸形和/或神经发育缺陷的受试者中检测到许多GT相互作用物的DNVs,但在"孤立的"CHD病例中也发现了相当数量的DNVs。
接下来调查了与GT-PPI中的蛋白质相对应的改变蛋白质的CHD变异的具体类型。在GT-PPI中的272个蛋白质中,发现CHD病例中存在20个LoFDNVs 和53个错义DNVs。与对照组相比,无论是LoF(adjust.OR4.96)还是错义DNV(adjust.OR:3.76),在CHD患者中,DNV发生在GTPPI基因中的几率都大大增加。LoFDNVs 优先影响涉及人类和小鼠心脏畸形的基因,而大部分具有CHD缺失DNVs的GT-PPI基因以前没有与心脏发育或CHD有关。由于在病例和对照组的交互组基因中,新的剪接变体的数量较少,因此无法确定其贡献。
■ ■ ■ ■ ■
图3. GATA4和TBX5互作体中的新变体表现出疾病基因的典型特征
4. 一种综合的变体评分方法确定了特定的GT相互作用者作为CHD的候选基因
GT-PPI框架与三重测序相结合,使能够将单个基因组中的候选变体数量大幅减少到20个LoF和53个错义DNVs,这些基因编码cTFs的蛋白伙伴,可能有助于CHD。然而,即使在这个重要的过滤步骤之后,错义变体的解释仍然是一个挑战,需要有方法来优先考虑那些可能对人类表型有实质性影响的变体。
迄今为止,已经描述了许多变异体的优先排序方法,大多数整合了广泛接受的变异体和基因特征,根据变异体对蛋白质功能的预测有害影响的综合证据、怀有基因的累积突变损伤及其与已知CHD致病基因的生物相关性,对潜在的候选变异体进行排序。然而,制定一个普遍适用的分数在理论上是困难的,许多遗传学研究的一个共同发现是,为了正确评估,需要有特定基因组的致病性规则。此外,这些方法大多是为单体测序研究而设计的,未能纳入原告的血统信息,而这些信息可以帮助确定个体内具有潜在更大影响的变体的优先次序。因此,开发了一个为CHDtrio 全外显子测序数据集定制的综合办法,以计算映射到GT-PPI上的53个错义DNV的变异优先级得分。这种评分方法有两个步骤。(1)根据广泛使用的基因和变体指标组合的注释来评估变体的缺失性,以及基因在数据集中的突变频率来确定变体的优先次序(图S3K),以及(2)根据在已知功能残基/域上的出现和同一亲属中其他潜在的因果变体的存在来重新加权(图4A和S4A)。具体来说,在基因水平上,较高的分数表明(1)基因对LoF变异的容忍度低,(2)与大量参与心脏畸形的蛋白质和基于公开的PPI信息的PCGCCHD 亲属变体收容蛋白质相连接,(3)与其他组织相比,心脏表达高,以及(4)相对于CDS长度,基因内PCGC变体的数量高。在残基层面,较高的分数表明(5)变体对蛋白质功能有害的可能性增加(CADD分数)和(6)发生在一个功能性残基或蛋白质域。在亲属层面,通过应用加权校正因子,较高的分数表明(7)该个体的背景遗传变异不包括DNV或已知涉及心脏畸形的基因中非常罕见的遗传性LoF变异,也不包括其他GT-PPI基因中的变异。各个特征通过等级总和进行组合,并在适用时进行加权(见STAR方法:变异评分)(图4A)。所得分数与该基因在发育中的心脏(E14.5)中的表达百分位数有关,这一特征以前被PCGC证明对CHD的变异过滤是有效的。
将这种评分方法应用于先前确定的牵涉到CHD的变体,并发现该方法对这些参考单基因变体的排名比被证明部分有助于CHD和引起寡源性疾病的少数突变更高(图4B),即使这些突变影响的是同一个基因。此外,在得分最高的相互作用组变体中,有几个是已知导致心脏畸形的蛋白质,这与该分数对于识别有可能导致疾病的基因变体的相关性相一致(图4B)。
为了检验较高的变体优先级分数是否确实转化为变体的更大功能影响,在荧光素酶报告实验中评估了多个变体对辅助因子活性的影响,该荧光素酶报告者含有PPARGC1a启动子,该启动子被GATA4强烈激活。选择了NKX2-5,一个有一个高分和一个低分变异的参考基因;CHD7,一个编码GATA4相互作用的CHD基因,有四个已确认的错义DNVs;以及BRD4和SMARCC1,CHD候选基因和GATA4相互作用者,每个都有两个已确认的CHD患者的错义DNVs。对于GATA4的相互作用者-CHD7、SMARCC1和BRD4,在有GATA4的情况下测试了每个变体对转录活性的影响。发现优先级较高的变体对编码蛋白的转录活性有较大影响(图4C)。
接下来,旨在评估GATA4和TBX5PPI 纳入的好处,作为识别CHD候选基因的过滤策略。为了测试这一点,将变体优先化评分应用于所有来自相互作用组和非相互作用组基因中发现的探查者的新错义变体。发现与GT-PPI网络以外的基因中的变体或所有未经过滤的错义DNV相比,GT-PPI错义DNV的变体优先级评分的75th百分点分别高出23或22分(评分范围0-99)。此外,41.5%的交互组错义DNVs在所有DNV优先级评分中排名前四分之一,在发展中的心脏表达百分位中排名前四分之一,而未经过滤的错义DNVs只有12.4%。此外,在最高四分位数的错义DNV中,GT-PPI变体的平均优先级得分明显高于未经过滤的错义DNV。一致的是,在已知的CHD致病基因中,属于GT-PPI网络的错义DNVs的比例(30%的GT-PPI错义DNVs)比在CHD受试者中观察到的所有错义DNVs的相应比例(所有错义DNVs的3%)高一个数量级。为了最直接地测试用GT-PPI过滤DNV的价值,进行了精确-召回分析,提供了一个性能指标,即曲线下面积(AUC),估算了有无纳入GT-PPI信息的变体优先排序评分。这种方法表明,纳入GT-PPI变体过滤策略提高了变体优先排序评分预测已知CHD致病变体的能力(使用VPS的GT-PPI过滤变体,AUC= 0.61,而随机分类器AUC= 0.3;使用VPS的所有变体,AUC= 0.18 与随机分类器相比,AUC=0.05);此外,这一结果不是由变体优先级评分(VPS)重新加权步骤中包含的GT-PPI依赖性参数的混杂影响所驱动的,因为排除这一特征的修正评分表现相似。
在CHD候选错义DNVs中,大多数影响了在发育中的心脏中高度表达的相互作用组蛋白,只有25%发生在表达量最高的四分之一以外的GT相互作用组中(图4B)。除了与心脏横纹肌瘤有关的结节性硬化症基因TSC1外,心脏表达较低的基因一般也表现出较低的变异优先级分数(图4B)。另一方面,在发育中的心脏中高度表达的GT交互体中的错义DNVs表现出广泛的优先排序分数,其中一个潜在的高致病性变异群的排名接近已公布的对CHD有强烈贡献的参考变异,而一个更分散的变异群的得分与已知对CHD有部分贡献的少数参考变异相似。在得分最高的错义DNVs中,假设它们是更重要的贡献者,其中有4个变体是以前描述的对人类心脏缺陷有单基因贡献的GT互动体(TBX5、GATA6、CHD4和CHD7),还有6个变体是在人类先天性心脏畸形中功能尚未描述的蛋白质(BRD4x2、SMARCC1、GLYR1、CSNK2A1和SAP18)(图4B)。
BRD4、GLYR1和SMARCC1是染色质修饰剂,与观察到的CHD相关DNVs在参与这一过程的基因中的富集一致。这些CHD候选基因被检测为GATA4的相互作用者,这通过共同免疫沉淀得到验证。虽然以前不知道GLYR1和SMARCC1与GATA4的相互作用,但最近报道了BRD4-GATA4蛋白模块在调节心脏软骨细胞平衡中的作用,并表明在胚胎发育过程中删除BRD4(Tnnt2-Cre;Brd4flox/flox)会导致胚胎死亡并出现心脏功能障碍。虽然SMARCC1对CHD的具体贡献还不确定,但其编码的蛋白BAF155是BAF复合物的一个组成部分,它协调心脏发育的许多方面。GLYR1的DNV发生在一个有房间隔缺损、左心室流出道梗阻和肺动脉狭窄的病人身上,这是在有GATA4突变的人类中观察到的心脏畸形谱。然而,GLYR1在包括心脏在内的大多数组织中的作用仍未被探明。
因此,调查了新的GLYR1变体携带者的遗传情况,发现有3个LoF和62个错义变体从他们无症状的父母那里遗传过来,而在这个亲属身上没有发现其他DNV。有趣的是,这些遗传的错义变体之一发生在GATA6,编码一个GATA因子,在心脏发育中与GATA4有遗传上的互动,并且部分是冗余的。尽管这些遗传性LoF和错义变体存在于无症状的父母中,因此不太可能足以导致心脏畸形,但未来的研究可能会评估是否有变体与GLYR1一起导致该患者的心脏畸形。

■ ■ ■ ■ ■
图4. 对冠心病相关变异体进行排名的综合变异体优先排序评分
5. GLYR1的CHD变体影响结构动力学并破坏其与GATA4的物理互动的稳定性
GLYR1,也被称为NDF、NPAC或NP60,是一种染色质读取器,参与染色质修饰和通过核糖体去甲基化调节基因表达。我们检测到的GLYR1错义CHDDNV 涉及在β-羟酸脱氢酶(β-HAD)结构域内的氨基酸(aa)496处用亮氨酸取代高度保守的脯氨酸,该结构域被描述为介导GLYR1单体之间的互动。由于脯氨酸496位于一个富含芳香族残基的刚性环路内,连接着两个四聚体结构域(图5A-5C),我们假设它被亮氨酸取代会影响GLYR1β-HAD 结构域的结构动态,从而影响其获得某些功能状态的能力。
分子动力学(MD)计算模拟预测,突变体(GLYR1P496L)β-HAD将探索比WT更窄的结构构象集,正如轨迹中访问的框架与参考结构的均方根偏差(RMSD)随时间变化所显示的。这一结果被模拟过程中每一对状态的RMSD分布所证实(图5D)。此外,通过模拟中原子位置的标准偏差(RMSF)测量的GLYR1局部结构动力学表明,与WT蛋白相比,GLYR1P496L的整体灵活性较低,这在Rossman-fold结构域(262-437aa)很明显(图5E)。这些数据表明,GLYR1中的P496L变体在全局和局部水平上诱发了β-HAD结构域的明显差异,预示着 GLYR1中该区域的结构刚性普遍增加。
β-HAD结构域内刚性的增加可能会影响GLYR1通过构象选择适应相互作用的伙伴蛋白的能力。共同免疫沉淀试验表明,GLYR1P496LDNV 破坏了其与GATA4的物理相互作用(图5F),但与先前描述的GLYR1相互作用者LSD2、CDK9或CyclinT1没有关系。由于以前的研究表明GLYR1在转录调控中的作用,探究了GLYR1是否与GATA4共同调控基因表达,并发现GATA4和GLYR1共同转染使Nppa-荧光素酶报告仪的活性提高了约15倍,而单独使用GATA4的激活率为8倍。同样观察到GLYR1和GATA4对Ccnd2荧光素酶报告者的协同转导作用,在这两种情况下,GLYR1的P496L突变削弱了这种作用(图5G)。

■ ■ ■ ■ ■
图5. GLYR1中一种高评分CHD变体的功能
6. .GATA4和GLYR1共同结合一组确定的心脏发育基因并共同调控其表达
GLYR1定位于活跃转录基因体上富含组蛋白H3三甲基化(H3K36me3)的染色质区域内,以调节转录延伸。然而,关于GLYR1如何被招募到特定的位点或其在平衡和疾病中的功能的知识是有限的。通过染色质免疫沉淀测序(ChIP-seq)在hiPSCs和CPs中分析基因表达和GLYR1的全基因组占有率,发现GLYR1在hiPSCs向CPs分化过程中的动态重定位,两个阶段有7400个不同的结合基因(FDR<0.1)(图6A)。
根据三个测量变量--GLYR1ChIP-seq、H3K36me3ChIP-seq 和RNA表达--对被GLYR1不同结合的基因进行K-均值聚类,突出显示在hiPSCs分化为CPs时,GLYR1被招募到4246个基因体(聚类2和3)。GO分析显示,与心脏发育相关的基因程序富集在集群2中,该集群显示了CPs中GLYR1ChIP 信号的最高水平,而集群3则富集了参与一般细胞过程的基因。另一方面,群集1包含了3155个在hiPSCs中与GLYR1结合的基因,这些基因在CPs中丢失,主要与细胞周期和核糖体生物生成有关(图6A)。总的来说,GLYR1优先与活跃基因的转录区结合,并与H3K36me3共同定位(图6A)。有趣的是,GLYR1占据了CPs中50%的上调基因,并以H3K36me3标记,这表明GLYR1在CM分化过程中被招募到一大批心脏基因上。
在CPs中,正如在其他类型的细胞中所描述的那样,GLYR1广泛地占据了基因体,平均从第一个内含子到转录末端位点(TES)。另一方面,GATA4优先占据远端调控元件,尽管在基因体内部的内含子处发现了一些峰值,与GLYR1相似。为了研究GATA4-GLYR1在CP中的基因组共占情况,将GLYR1在CP中被招募的基因(GLYR1CP:集群2和3,FDR<0.1和Log2FC>0.5)与GATA4在GLYR1通常结合的基因体窗口中结合的基因重叠。该分析发现GLYR1CP和GATA4结合的基因体之间有显著的统计学重叠,确定了GATA4和GLYR1结合的基因子集,大部分在CPs与hiPSCs中上调(FDR<0。05),并且与仅GLYR1和仅GATA4占据的基因体相比,在心脏发育GO术语中具有更大的富集性(图6B、6C)。
为了直接评估GATA4和GLYR1是否调节它们共同占据的基因的转录,通过批量RNA-seq分析了沉默GATA4或GLYR1对CPs中基因表达的影响。与对照siRNA相比,GLYR1沉默导致800多个与胚胎发育和心脏发育相关的基因表达减少,这表明GLYR1在中枢神经分化过程的转录调控中具有功能相关性。与那些没有共同结合的基因相比,GATA4和GLYR1共同结合的基因被GATA4和GLYR1独立敲除后明显下调的可能性约为7倍。几个共同占据和共同调控的基因座(GATA4、GATA6、TBX5、LRP2、TEMN4、CC2C2A、TTN和ENDRA)涉及人类或小鼠心脏畸形(图6D)。观察到GATA4主要占据GATA4:GLYR1结合的基因体的内含子区域,使我们研究了这些区域内活跃或压抑的基因调控元件的特征。在 GATA4:GLYR1结合的基因体中,GATA4与高水平的与活性调控元件相关的标记(H3K27ac、H3K4me3、H3K4me1和MED1)以及TFsTBX5、MEIS1、ISL1和NKX2-5共同定位,但与检测不到的压制性标记H3K27me3(图6E)。同样,GATA4在纯GATA4基因中占据了多TF内含区,但平均来说,与活性调控元件相关的标记水平较低,而压制性标记H3K27me3的水平较高,这与GATA4在大约一半的纯GATA4结合的神经基因中充当压制者相一致(图6C)。在 GATA4:GLYR1共同结合的基因中,GATA4与多个TFs的共同定位引起了GLYR1与其他cTFs相互作用的可能性。然而,在CPs中进行的GLYR1共免疫沉淀试验表明,虽然GLYR1与GATA4相互作用,但它没有与其他被测试的cTFs相互作用,包括 NKX2-5、TBX5、ISL1和MEIS1,其中每一个都在GATA4占据的区域有图案富集。
为了测试GATA4和GLYR1是否相互作用以正向调节基因表达,将具有上述特征的几个内含子区域克隆到最小启动子控制下的荧光素酶报告载体中,并测试GLYR1和GATA4的转导能力。单独转染GATA4导致所有三个报告者的激活,而单独转染GLYR1诱导三个测试报告者中的两个的荧光素酶活性,表明这些内含子位置可以作为反应元件发挥作用(图6F)。重要的是,GATA4和GLYR1的共同转染增加了每个报告者的活性,与功能上的共同调控一致。在GLYR1P496L 突变的情况下,由GLYR1WT 诱导的协同/附加激活作用被强烈削弱(图6F)。

■ ■ ■ ■ ■
图6. GLYR1在心肌细胞分化期间转录调节中与GATA4相关的作用
7. GLYR1的P496L变体影响心肌细胞的分化
为了更好地表征P496L错义变体对GLYR1蛋白功能和中枢神经系统分化过程中基因调控的影响,通过CRISPR-Cas9同源定向修复技术创建了一个错义变体P496L(GLYR1P496L)同源的hiPSC系。同时产生了一个GLYR1KO的hiPSC系,并验证了RNA表达的减少和没有可检测到的蛋白质。
在小鼠胚胎干细胞(mESCs)中,GLYR1对多能性至关重要,而耗尽GLYR1会导致分化、细胞周期停止和细胞凋亡。与mESCs类似,hiPSCs中GLYR1的缺乏导致转录图谱的巨大变化,其特点是与GLYR1WT相比,多能性和细胞周期基因表达减少,肿瘤抑制因子和凋亡基因上调。然而,在GLYR1P496LhiPSCs中没有观察到这些变化,它们在转录上与GLYR1WT细胞更为相似。这些结果表明,GLYR1对维持hiPSCs的多能性是必不可少的,而且P496L变体不会导致蛋白质功能的完全丧失。
然后让GLYR1WT和GLYR1P496L系进行CM分化,并通过scRNA-seq研究它们在CP(第6天)和CM阶段(第18天)的转录景观。在分化的第6天,观察到由GLYR1WT和GLYR1P496L细胞组成的三个不同的亚群聚集在一起,表达与CP(群0)、内胚层(群1)和血管/内皮细胞(群4)相关的标记基因,以及主要由GLYR1P496L细胞组成的神经祖细胞群(群2)(图7A、7B)。所有集群都检测到GLYR1的表达,而GATA4只在CP(集群0)、内胚层(集群1)和血管/内皮(集群4)-样集群中检测到。在GLYR1WT分化第6天,scRNA-seq分析与GLYR1和GATA4ChIP-seq 的交集显示,CP类群富含GATA4和GLYR1共同结合的基因。GLYR1P496L和GLYR1WTCP亚群(聚类0)之间的差异表达分析(FDR<0.05,LogFC>0.125)确定了1,458个下调的基因,涉及心脏发育、细胞骨架组织、细胞周期、对缺氧的反应和ATP代谢过程;1,025个基因上调,与非心肌细胞发育过程有关(图7C)。值得注意的是,超过35%的GATA4:GLYR1共同结合的基因在GLYR1P496L和GLYR1WTCPs 之间有差异表达,而只有GATA4和GLYR1结合的基因只有不到15%有差异表达(图7D)。ChIP-seq显示,在GATA4:GLYR1共同结合的基因中,GLYR1在GLYR1P496LCP-like 集群中的占用率降低,而在那些表达量上调或没有变化的基因上则没有降低(图7E、7F)。重要的是,GLYR1全基因组的结合没有受到P496L变体的影响。这些数据表明,P496L变体影响了GLYR1的占用和由GATA4共同结合的一组离散的靶基因的转录调控,其中几个靶基因参与了人类心脏畸形和心肌病的内胚层(簇1)和血管/内皮层(簇4)。在GLYR1WT的分化第6天,scRNA-seq分析与GLYR1和GATA4ChIP-seq 的交集显示,CP类群富含GATA4和GLYR1共同结合的基因。GLYR1P496L和GLYR1WTCP 亚群(聚类0)之间的差异表达分析(FDR<0.05,LogFC>0.125)确定了1,458个下调的基因,涉及心脏发育、细胞骨架组织、细胞周期、对缺氧的反应和ATP代谢过程;1,025个基因上调,与非心肌细胞发育过程有关(图7C)。值得注意的是,超过35%的GATA4:GLYR1共同结合的基因在GLYR1P496L和GLYR1WTCPs 之间有差异表达,而只有GATA4和GLYR1结合的基因只有不到15%有差异表达(图7D)。ChIP-seq显示,在GATA4:GLYR1共同结合的基因中,GLYR1在GLYR1P496LCP-like 集群中的占用率降低,而在那些表达量上调或没有变化的基因上则没有降低(图7E、7F)。重要的是,GLYR1全基因组的结合没有受到P496L变体的影响。这些数据表明,P496L变体影响了GLYR1的占用和由GATA4共同结合的一组离散的靶基因的转录调控,其中几个靶基因已经参与了人类心脏畸形和心肌病的治疗。
在分化的第18天,观察到一组异质的细胞亚群,GLYR1P496L和GLYR1WT细胞的贡献明显不平衡。GLYR1P496L细胞主要贡献于神经样(群2、3、5和9)和肝细胞样(群7)亚群,而不利于CM样群0和6(图7G、7H)。GLYR1P496L系的CM类分化受损,也表现在FAC和免疫染色检测到的cTNT水平下降(图7I、7J)。在CM-like集群中,GLYR1P496L与GLYR1WT细胞呈均匀分布,根据成熟度标记,没有观察到基因型之间的分离。然而,差异表达分析发现GLYR1P496L细胞中有544个下调的基因(GLYR1P496L相对于GLYR1WT),主要与前体代谢物和能量生成有关,特别是ATP代谢过程。此外,803个基因在GLYR1P496L中被上调(GLYR1P496L与GLYR1WT相比),涉及细胞粘附和迁移、蛋白磷酸化和细胞收缩。此外,GLYR1P496L心肌细胞表现出跳动动力学的改变,其特点是物理收缩和放松的时间明显延长,与对照组心肌细胞相比,伴随着跳动速率的下降。总的来说,这些数据证明了GLYR1P496L变体对中枢神经系统分化的不利影响,与GLYR1基因组占有率的改变和与GATA4共同结合的一组离散的基因调节有关。
8. GLYR1突变破坏了小鼠的心脏发育
为了评估GLYR1P496L 变体在体内的生物学重要性,利用CRISPR-Cas9介导的基因组编辑,产生了一个携带GLYR1中P495L单核苷酸变体的小鼠品系(Glyr1P495L/+),与人类P496L同源。在回交四代到C57BL6/J背景后,与Glyr1P495L/+小鼠杂交,并收集了92只幼崽进行基因分型和出生后第1天(P1)的心脏组织学。尽管所有的基因型都是以预期的孟德尔比率出生的,但54%的Glyr1P495L/P495L和15.5%的杂合子(Glyr1P495L/+)小鼠在出生后第0天和第1天之间显示出死亡,而WT的同胎仔只有4.4%。超声心动图和组织学分析显示15%的Glyr1P495L/P495L小鼠有室间隔缺损(VSDs)。因此,这个模型为GLYR1在心脏发育中的生物学重要性提供了证据,并证明了P495L变体在体内的有害影响。
为了评估小鼠中是否存在GATA4-GLYR1基因的相互作用,我们将Glyr1P495L/+小鼠与GATA4突变小鼠杂交。正如预期的那样,Gata4+/-小鼠表现出部分穿透性的心脏缺陷,VSD的发生率为22%,50%在第0天和第1天之间死亡,这与以前C57BL6/J背景下Gata4缺失的报告一致(图7K)。Glyr1P495L/+小鼠表现出预期的低渗透率的心脏改变,最常见的是持续的房间沟通(卵圆孔),而在分析的23个WT同胞心脏中没有发现缺陷(图7K和S7I)。在出生的88只幼崽中,我们只发现了8只复合杂合子(Glyr1P495L/+:Gata4+/-)动物(观察到的占 9.1%,预期的占25%,c2=0.0086),其中5只在出生后的24小时内死亡(图S7I)。全身组织学和超声心动图分析表明,所有复合Glyr1P495L/+:Gata4+/-的心脏都是畸形的,心脏间隔缺陷完全穿透,包括约80%的心室间隔缺陷(AVSDs)(图7K)。这些数据为GLYR1P495L 变体的生物相关性及其与GATA4在人类疾病中的相互作用提供了体内证据。

■ ■ ■ ■ ■
图7. GLYR1P496L错义变体对人iPS源性心脏细胞和小鼠心脏发生的影响

该研究将CHD相关TFs的蛋白互作网络分析与人类全外显子测序数据相结合,揭示了CHD的遗传基础;通过对两个重要的cTF——GATA4和TBX5进行无偏倚PPI重建,研究确定了对心脏发育至关重要的相互作用因子,并提供了一个可能导致CHD的候选疾病变异的列表,揭示了与心脏病相关的基因及其生物学特征。同时,该研究也表明,使用组织和疾病特异性PPIs可以克服CHD的部分遗传异质性,有助于优先考虑疾病中新生错义变异的潜在影响。

11-08 Chromai
展会有约 | 生物医药行业菁英齐聚上海浦江,共话通用细胞药物未来发展11-08
在转变为实时检测时保持数据可靠性11-08 Sievers分析仪
宠粉时刻 | 2022年10月微信活动获奖名单11-08
热点应用丨为“食品安全”保驾护航—全自动水分灰分分析仪prepASH11-08 天美
贴息贷款丨科研级模块化显微共聚焦拉曼光谱仪RMS100011-08
贴息贷款丨一体化稳态瞬态荧光光谱仪FS511-08
贴息贷款丨激光闪光光解/瞬态吸收光谱仪LP98011-08
贴息贷款丨全功能模块化稳态瞬态荧光光谱仪FLS100011-08
贴息贷款丨一体化全自动显微共聚焦拉曼光谱仪 RM511-08
双11直播预告 | 迪马“柱”你愿望11实现11-08 DIKMA
地方撷英 | 山东省枣庄生态环境监测中心党旗猎猎映初心 战“疫”一线勇担当11-08
生态环境部生态环境监测司负责人就《生态环境卫星中长期发展规划(2021—2035年)》答记者问11-08
校园招聘第三弹| 职场专访11-08 帝肯生命科学
直击进博|帝肯新品MagicPrep NGS系统亮相第五届进博会11-08 帝肯生命科学
MIG-2021型红外气体分析仪在“碳达峰、碳中和”的应用案例11-08 作者:明尼克
【应用分享】中药辛夷的33种农残测定分析11-08 纳谱分析
地方撷英 | 打造专业团队 统筹监测保障 科学防控地下水——天津市深入推动国家地下水环境质量监测及点位运维保障工作11-08
地方撷英 | 厉兵秣马 “竞”无止境——广西壮族自治区玉林生态环境监测中心开展全区监测技能大比武筹备活动11-08
德国耶拿TOC选型直播,助力贴息贷项目申报11-08 德国耶拿