Onco丨徕卡STED:CD36介导肿瘤微囊泡释放在肿瘤转移中的作用
2021-09-30 15:10:12, 刘继红 徕卡显微系统(上海)贸易有限公司

随着肿瘤研究的不断深入,为了更深入的研究肿瘤细胞,肿瘤微环境和肿瘤转移的微观程,纳米分辨率显微镜越来越多的应用于肿瘤研究领域。下面给大家分享的这边文章,CD36-triggered cell invasion and persistent tissue colonization by tumor icrovesicles during metastasis 就使用了LEICA STED 3X研究了肿瘤微囊泡在肿瘤转移中的作用。
研究背景
肿瘤的转移是一个多步骤的复杂过程,它的机制尚在研究中,那么究竟原发肿瘤是通过什么途径转移到第二脏器的呢?传统的推断是通过血液循环或是淋巴循环,如果这个推断成立的话,是肿瘤细胞本身还是肿瘤细胞所产生的某些物质通过循环到达第二脏器,并在那里形成了原发肿瘤的转移灶呢?迄今为止,还没有确定的答案。
不过已经有研究证实在肿瘤转移患者的循环系统中存在肿瘤细胞产生的微囊泡,这篇文章就研究了肿瘤细胞产生的微囊泡和肿瘤转移之间的关系。
肿瘤微囊泡属于外泌体的一种,它的直径在100-500nm之间,在肿瘤发生转移的病人血液循环中可以稳定的检测到,但是研究者对肿瘤微囊泡和它发生反应的免疫细胞及其进入和穿过血管到达组织间隙的机制知之甚少。
CD36是一种脂肪受体,本研究证实它在体外实验中是巨噬细胞内吞肿瘤微囊泡的重要媒介分子。使用纳米分辨率显微镜(STED)成像揭示了微囊泡的内吞过程,在活体动物实验中,小鼠肝微循环中的肿瘤微囊泡以CD36依赖途径穿出血管外,并定位与肝血管旁的Ly6c-巨噬细胞中。
在这篇文章中,作者使用了纳米分辨率显微镜(STED)来观察微囊泡,可以清晰分别观察到微囊泡的膜和内容物在内吞过程中所发生的不同变化,并研究了二者和溶酶体之间的相互作用。
研究过程
首先,作者研究了血细胞的微囊泡被巨噬细胞内化的过程。研究了血小板产生的微囊泡和从循环血中提取的循环微囊泡被THP-1巨噬细胞内化的过程,如图1 AB所示。其中DCF(绿色)标记为微囊泡,DiD标记巨噬细胞。使用STED超高分辨率成像可以清晰的将微囊泡的膜和其内容物区分开来,如图1C。抑制微丝形成的劲松剂D可以减少微囊泡的内化,但是氯丙嗪(网格蛋白途径抑制剂)没有作用。
图1D超高分辨率图像显示了巨噬细胞膜和微囊泡膜共染,提示微囊泡是通过内吞途径进入巨噬细胞内。作者还研究了微囊泡内容物进入细胞后的定位,发现微囊泡内容物和Lamp-1阳性的溶酶体共定位。(如图2E)

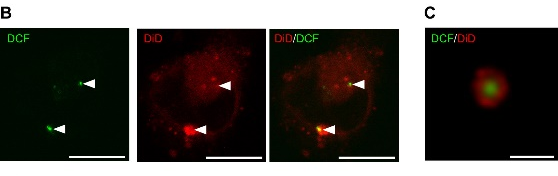
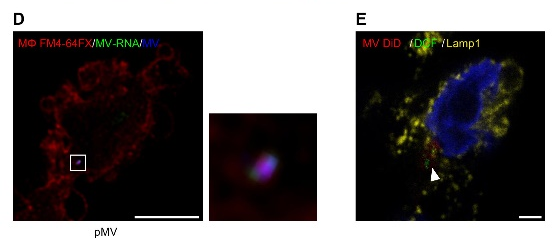
图1.血细胞微囊泡内化的超高分辨率图像
A) DCF-标记的血小板微囊泡(pMV)和循环微囊泡(cMV)与Vybrant DiD (DiD)-标记的人巨噬细胞 (30 min).
B)DCF-标记的循环微囊泡 (arrows) 被 DiD.标记的巨噬细胞内化(Sixty-minute)
C)单个微囊泡的纳米分辨率图像。膜标记 DiD 内容物标记:DCF。Scale bars, 0.5 mm.
D) 血小板微囊泡的纳米分辨率图像 膜(DiL; pseudo-colored, blue) 囊泡内RNA (RNASelect; green) 结合的巨噬细胞 (lFM4-64FX, red). 60min E) 血小板微囊泡在巨噬细胞中和 Lamp1阳性的溶酶体共定位. 60min
随后作者研究了清道夫受体CD36对微囊泡内化的影响。结果表明使用CD36的抗体减少微囊泡的内化,降低巨噬细胞对微囊泡的摄取,经过CD36 siRNA处理的巨噬细胞CD36表达降低,使之降低了微囊泡的摄取。

图2. 肝巨噬细胞(orange)在体内化 DiD-标记的循环微囊泡 (red) SEC, green. CD36抗体降低了巨噬细胞对微囊泡的内吞
下一步又进行了活体小鼠在体研究,尾静脉注射DiD标记的循环微囊泡一小时后,对照组的动物微囊泡显著聚集在血管旁的肝巨噬细胞中。这种作用在使用了CD36抗体的小鼠中被明显的抑制了。(图2)
接下来,研究了人胰腺癌细胞系L3.6pl微囊泡体外和巨噬细胞之间的相互作用,使用STED纳米分辨率显微镜观察,可以清晰的区分微囊泡膜和内容物,被巨噬细胞内化后,囊泡膜荧光信号定位于巨噬细胞膜周围而微囊泡内部的RNA聚集定位于细胞浆,但不和Lamp-1阳性的溶酶体共定位(图3)。作者还研究了小鼠胰腺癌细胞系KPC细胞产生的微囊泡,STED观察的结果和人胰腺癌细胞L3.6pl的微囊泡结果类似图3E。


图3 内化的肿瘤微囊泡分成囊泡膜和内容物。
B) CFP-TF+标记的非肿瘤(CHO cells) 与肿瘤微囊泡(L3.6pl, both blue)在与巨噬细胞的 (DiD,red)作用的2 个时间点的不同定位。C) 单个肿瘤微囊泡的STED图像囊泡膜 (DiD)内容物(RNASelect, DCF)
D) 肿瘤微囊泡 (L3.6pl)与巨噬细胞共孵育60min后被巨噬细胞内化的STED 图像囊泡膜(DiD,pseudo-colored, green) 内容物(RNASelect,pseudo-colored, blue) 巨噬细胞膜(FM4-64FX, red).
E) 肿瘤微囊泡 (KPC)与巨噬细胞共孵育60min后被巨噬细胞内化的STED 图像囊泡膜(DiD,pseudo-colored, green) 内容物(RNASelect,pseudo-colored, blue) 巨噬细胞膜(FM4-64FX, red).
随后,作者还进行了肿瘤微囊泡的在体研究。尾静脉输入L3.6pl微囊泡24小时后,尾静脉输入L3.6pl胰腺癌细胞,CD36抗体隔天输入一次。8天后,在肝微血管旁的组织中检测到L3.6pl的微囊泡。在0-4天可以检测到微囊泡从血管内到血管外。4-14天都可以检测到吞噬了微囊泡的巨噬细胞。巨噬细胞的表型主要为Ly6c- F4/80+。输入CD36抗体几乎完全抑制了微囊泡到达血管外(图4E)。


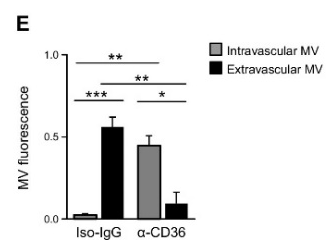
图4. 在肝微血管旁的巨噬细胞中长期存在肿瘤微囊泡的内容物
A) 8d肿瘤微囊泡 (L3.6pl, CMTPX) 出现于肝微血管旁。SEC(肝血窦上皮细胞, green..
B)0-4天肝血管内外 微囊泡定量结果
C)8d 肝组织巨噬细胞摄取肿瘤微囊泡。
D) 4-14d 吞噬了微囊泡的巨噬细胞的亚型。Left:Ly6C (green), F4/80 (orange), DiD (red). Right: quantitative determinations.
E) 14d CD36 对于血管内外L3.6pl微囊泡的抑制作用。
将L3.6pl胰腺癌注射入裸鼠的胰腺,7天后从尾静脉输入L3.6pl细胞产生的微囊泡。输入了微囊泡的裸鼠在肝微血管外的组织中,Ki67阳性率高。且肝转移灶的形成大大高于对照组(没有输入微囊泡组)。ki67是一种增殖细胞的相关抗原,其功能与有丝分裂密切相关,该标记阳性率高表明肿瘤生长越快,组织分化能力越差。
结论
肿瘤微囊泡促进了肝血管外肿瘤细胞的生存,增加了肝转移灶的形成,并且使巨噬细胞转变为Ly6c-免疫抑制的巨噬细胞。
徕卡STED系统对于本研究的贡献
肿瘤微囊泡和外泌体在肿瘤转移过程中有非常重要的作用,但是因为它们非常微小100nm-500nm,所以常规的显微镜下观察比较困难。
Leica STED纳米分辨率显微镜具有以下特性,
达到纳米分辨率:它的分辨率可以达到XY 50nm, Z轴分辨率130nm。
可以覆盖可见光全光谱的染料,可进行多达四色以及Z轴三维纳米分辨率成像。
时间序列观测活细胞内纳米分辨率成像。
在这项研究中,在常规制备的情况下,清晰的将微囊泡膜和内容物分开,并且观察到了微囊泡膜及内容物和巨噬细胞膜之间的位置关系(多色三种荧光标记),内吞后囊泡膜和细胞质膜融合而内容物聚集于细胞浆(时间序列活细胞纳米分辨率成像)。通过STED纳米分辨率显微镜,观测到了之前没有观测到结构和现象,揭示了微囊泡在肿瘤转移中的分子机制。
相关产品

STELLARIS STED
参考文献:
1 CD36-triggered cell invasion and persistent tissue colonization by tumor microvesicles during metastasis Susanne Pfeiler et al. FASEB JOURNAL September 13, 2018. doi: 10.1096/fj.201800985R







04-03 宏集科技
ICP-MS法在茶叶非金属元素分析中的应用04-03 管理员
奶茶中茶多酚含量测定方法的优化04-03 管理员
【设备更新仪器推荐】高性能全自动拉曼光谱仪——XploRA PLUS04-02 HORIBA
钙钛矿、发光材料、光电器件、电学器件、污染物去除【学术简讯24年05期】04-02 HORIBA
邀请函丨共襄2024北京国际环保展览会(CIEPEC),携手共创绿色未来04-02
赴塞上江南,启卓越之程丨2024连华科技春季技能培训大会圆满落幕04-02
智能管理 · 智慧生活 | 宏集SCADA技术线下研讨会,诚邀您参与!04-02 宏集科技
启用新一代测序化学、推出高通量流动槽,升级后的NextSeq 2000/2000-CN需要重新审视04-02 lizimo
发了Nature又发Science!全新一代10 nm空间分辨超快光谱和成像系统助力突破前沿科学04-02 Dr. Lu
JACS重要成果!超精准可调节温度控制助力钙钛矿相变的光致发光成像!04-02
使⽤Luminata提升稳定性研究效率04-02 ACD/Labs
展会预告 | 盛瀚邀您共聚青岛市分析测试学会年会系列学术报告会暨科学仪器展!04-02 SHINE
叮~基泰生物清明节放假通知,请查收!04-02 基泰生物
【内附详细日程】因科技 · 纳万物 | 2024进化发育学术论坛04-01
如何在环境监测的背景下,全面掌握三维荧光光谱?【4月16日 | 在线讲座】04-01 HORIBA
大昌华嘉开展鲁道夫(Rudolph) Autopol系列旋光仪质量服务月04-01 大昌华嘉
邀请函 | 2024中国油气开发技术年会暨油气开发新成果及新技术展示会04-01 大昌华嘉
邀请函 | IBQC第三届国际生物药质量大会04-01 大昌华嘉
邀请函 | 2024青岛市分析测试学会04-01 大昌华嘉