关注很火的PROTAC技术
2021-08-06 00:20:00, 基泰生物 上海基泰生物科技有限公司
关注很火的PROTAC技术
01
什么是PROTAC技术?
PROTAC的全称是蛋白质降解靶向嵌合体( proteolysis targeting chimeras,PROTACs) ,PROTACs 是一类双靶点嵌合体分子,由 3 个部分组成: 靶向结合目标蛋白的配体、招募 E3 泛素连接酶的配体以及两者之间的连接链。它能将目标蛋白与 E3 泛素连接酶的距离拉近,利用细胞内固有的泛素-蛋白酶体系统选择性诱导目标蛋白降解。
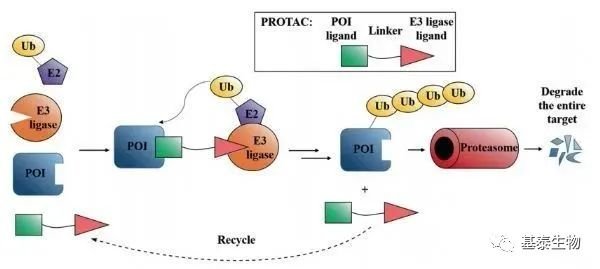
PROTAC作用原理是什么?
2004年诺贝尔化学奖颁发给了以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose,表彰其共同发现了细胞是如何清理异常蛋白质的,即泛素(Ubiquitin, Ub)调节的蛋白质降解过程。简单来说,这个过程就像是细胞将不用的文件(异常蛋白质)交给秘书(E3酶)盖上作废章(泛素化),扔到碎纸机里(蛋白酶体)。
利用泛素介导蛋白降解机制,是否可以人为降解一些蛋白?Raymond. Deshaies(美国两院院士)和Craig. Crews等人在2001年最早提出了PROTAC这个概念,并成功地设计和合成了第一批PROTAC双功能分子用于降解甲硫氨酰氨肽酶2(MetAP-2)。
PROTAC技术可以在体内可以将靶蛋白和E3酶拉近,使靶蛋白被打上泛素标签,然后通过泛素—蛋白酶体途径降解。这是一种全新的药物设计策略,通过设计这样的三联体小分子药物,理论上可以将任何过表达和突变的致病蛋白清除,从而治疗疾病。
02
PROTAC的优势在哪里?
使靶点从“不可成药性”(undruggable)变成“可成药性”。
大多数传统小分子药物的原理是结合酶或受体的活性位点来发挥作用,然而PROTACs可以通过任何角落位置抓住靶蛋白,不仅可以有效地抑制目标蛋白,还可以快速降解清除 。
不依赖“占位驱动”
小分子抑制剂需占据靶蛋白的活性位点以阻断功能,属于“占位驱动 ,分子PROTAC不依靠目标占据来破坏靶蛋白功能,超越了小分子可能实现的效果。
用量小,催化剂量即可
小分子抑制剂作用于靶蛋白后抑制靶蛋白的活性,并不能使其降解掉;而PROTAC分子可直接催化降解靶蛋白,只需催化量的即可。
克服耐药性
小分子抑制剂作用靶蛋白后,可能会造成靶蛋白突变或者靶蛋白过表达,进而引起耐药性,从而使小分子抑制剂失去的对靶蛋白的抑制功能;而PROTAC分子通过蛋白酶体途径将靶蛋白降解掉,克服了耐药性
高选择性
Nathanael S. Gray课题组对此做过相关研究,通过从一个可以作用于CDK家族多个蛋白的小分子抑制剂出发,通过PROTAC分子的设计,可以选择性降解CDK9,而对其他靶点没有降解效果,这说明由于靶蛋白与E3泛素连接酶之间的协同作用,PROTAC分子可以在小分子抑制剂的基础上提高其选择性。
低毒性
由于PROTAC降解蛋白只需催化的剂量即可,给药浓度较低,较低的药物浓度又降低了脱靶效应产生的可能性,减少毒副作用。
在已被解析的疾病相关蛋白中,有高达80%的蛋白无法用现有药物去靶向,因为它们大都位于细胞内或核内——大分子抗体进不去,并且表面相对平滑,没有明显“口袋”——小分子抓不牢。利用PROTAC技术,理论上只要靶蛋白上有裂缝、缺口等可以短暂“着力”的地方就行。
03
PROTAC技术的难点在哪里?
1.三联体成药性
由于是三部分组成的类似哑铃形分子,其水溶性、口服生物利用度、代谢稳定性、透膜性、合成难度和成本、PK/PD等等,依然是需要逐一克服的难题。
2.如何有效形成三元复合物,并有效激活降解系统
PROTAC发挥药效必须与靶蛋白和E3酶形成有效的三元复合物,而此过程对PROTAC来说,如何控制浓度以避免药物分子与靶蛋白和E3酶分别形成二元复合物(钩子效应,hook effect),以及充分考虑靶蛋白与E3酶接触区域的电荷排斥和立体结构排斥,显得非常重要。
3.脱靶毒性及其检测,尤其长毒和生殖毒
日本学者揭示度胺类药物(沙利度胺、来那度胺、泊马度胺)能靶向E3酶CRBN,对于推动PROTAC的发展功不可没——人们可以直接用度胺类的骨架作为PROTAC的一部分。然而沙利度胺作为五六十年代最“臭名昭著”的药物之一,尽管后来完成了“自我救赎”,但其引起“海豹儿”的生殖毒性一直让人们心有余悸,所以对PROTAC的毒性评价将会更加全面。
04
当前PROTAC的国内外玩家有哪些?
海外:
Arvinas:
公司由PROTAC鼻祖Crews教授在2013年创建,是目前进展最快的公司。公司当前市值13.93亿美元,2019年营业收入为4297.65万美元,同比增长200.03%。
PROTAC技术平台目前已经设计可口服给药、跨越血脑屏障的PROTAC分子,未来目标的是靶向“难成药”靶点、拓展E3连接酶、提高成功率(现有成功率95%)和选择性。
研发管线由抗肿瘤药物和神经疾病药物两大部分组成。
用于治疗前列腺癌的雄激素受体降解剂ARV-110、用于治疗乳腺癌的靶向雌激素受体的ARV471已经进入了Ⅰ期临床试验,目前Ⅰ期临床安全性和药代动力学数据已公布,在体内具有良好的耐受性。
Kymera:
Kymera成立于2016年,致力于发展蛋白降解治疗技术,建立了独特的Pegasus平台。
研发管线由炎症和肿瘤两部分组成,主要针对IRAK4蛋白,IRAK4在先天免疫中起重要作用。
公司设计的PROTAC可以有效降低皮肤和脾的IRAK4的水平,并可以减少皮肤变厚,循环Th1和Th17细胞因子达到局部激素治疗的水平,口服给药具有良好的耐受性。
针对STAT3开发了PROTAC分子,KYM-003在细胞实验、动物试验均表现出较好的效果。
目前所有产品均在临床前研究阶段,还未进行临床试验。
C4 Therapeutics:
企业成立于2015年,专注于技术平台Degronimid。该平台开发的小分子一方面可以与靶标蛋白结合,另一方面可以与细胞内的泛素蛋白酶体系统(UPS)中的蛋白相结合,促使UPS系统为靶标蛋白加上泛素的标签。
团队发现来那多胺等邻苯二甲酰亚胺类抗肿瘤药物,可以特异性结合E3连接酶CRBN,通过PROTAC技术,可以选择性降解目标蛋白比如BRD4,活性达到皮摩尔级,并有很好的成药性。
Nurix Therapeutics:
企业成立于2014年,由泛素蛋白酶体系统(UPS)领域的国际公认专家创立。
研发管线专注开发用于免疫介导的疾病和血液癌症的药物,包括免疫肿瘤疗法。
前沿的产品线包括用于B细胞恶性肿瘤的口服BTK嵌合靶向分子(CTM)、口服的CBL-B连接酶抑制剂,两种候选产品均来自Nurix的DELigase™靶向蛋白质调节平台,目前均处于临床前研究阶段。
国内:
药明康德:
公司在2014年开始建立了全球领先的PROTAC药物发现和测试平台,赋能众多全球“长尾客户”。
2019年,公司 PROTAC平台来自于生物技术公司客户的收入已经达到 4.74 亿元,同比增长约90%。
针对PROTAC分子建设了较完善的统一化赋能平台,集发现、合成、分析纯化和测试等能力于一体。
分迪科技:
公司成立于2014年,由国内第一个生物分子模拟方向论坛(BioMS.org)的创始人及其精英创办。
目前已建立了一个独特的早期PROTAC新药发现平台,利用该平台已完成5类蛋白降解PROTAC的筛选与设计,并且已有多个案例证实了其针对降解靶点筛选苗头化合物的能力。
目前与多家制药企业和医院建立合作,但还没有临床申报的PROTAC药物,正处于早期筛选阶段。
凌科药业:
成立于2017年,聚焦肿瘤、免疫、炎症等疾病领域。
公司的资深创始人有着技术优势:万昭奎有过建立靶向蛋白降解平台的经验;汪俊多年前就研 究过Ras;Michael Vazquez和万昭奎在药物设计上有非常丰富的经验。
目前公司PROTAC研发管线仍处于药物发现阶段,暂未申报。
开拓药业:
2009年创立,以雄激素受体相关疾病为核心,覆盖全球高发病率癌症及其它未满足临床需求的疾病领域,包括前列腺癌、乳腺癌、肝癌和脱发等。产品管线包含小分子创新药、生物创新药及联合疗法。
公司正大力发展PROTAC技术平台。2019年9月,公司完成4500万美元融资主要用于三个方面:继续推进和完成创新药物,特别是普克鲁胺和福瑞他恩在中美两国的后期临床开发;加速新型蛋白降解药物(PROTAC)和成药困难的c-Myc抑制剂的研发;以及完成在苏州的创新药产业化基地的建设。
五元生物:
成立于2015年。其主要研发方向有抗肿瘤新药研发、人工智能类器官大数据样本库的建立运营、精准医疗和仿生医学、生物医药产业的知识产权交易和资本运作。
五元生物与战略合作伙伴共同拥有4条高价值的自主研发产品管线。
目前构建了具有自主知识产权的PROTAC平台,主要应用于新一代抗非小细胞肺癌新药研发,并用类器官技术为PROTAC分子的提供有效性和安全性评估。
目前,NWY001产品正在临床Ⅰ/Ⅱ期阶段。

07-05
秒懂有机锡:你的食品安全我们共同守护!07-04 普立泰科
多肽山海路一程,南粤相聚,共赴顶峰!07-02
材料未来,因你而动——来自材料大会2024的邀请函请查收!07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注