项目文章 | Advanced Science发表空军军医大学最新肥胖和胰岛素抵抗研究成果
2021-05-19 17:42:24, 小迈 武汉迈特维尔生物科技有限公司
向下滑动查看完整内容
随着生活水平的不断提高,肥胖及相关代谢疾病(如糖尿病等)已成为严重影响全球居民健康的主要慢性疾病,且其患病率呈逐年上升趋势,造成沉重的社会经济负担。研究能量代谢失衡是导致肥胖发生的主要原因,一旦摄入的能量过剩,超出白色脂肪细胞储存能力,过多的脂类则进入血液循环,导致肝脏、肌肉、胰腺等组织的脂肪异位沉积,最终导致代谢性疾病的发生。
当前肥胖的治疗策略主要是限制能量摄入、减重手术、药物治疗。然而,生活方式干预长期疗效不理想,主要原因在于大部分患者难以常年遵守减肥饮食和运动。而减重手术由于需要平衡手术带来的风险因素,目前仅针对的重度肥胖症患者。减肥药物也因其不良反应严重制约了临床应用和推广。
棕色脂肪组织(brown adipose tissue, BAT)由于存在解偶联机制可将机体中的能量以热能形式释放以维持体温,其产热量与减少的肥胖、2型糖尿病等代谢性疾病发病风险密切相关。近年来,成年人体内存在具有产热活性的BAT这一发现更使得促进能量消耗成为肥胖相关代谢疾病治疗的新靶点。据报道,化学解偶联剂2,4-二硝基苯酚(DNP)会导致体重迅速下降。然而,由于明显的不良反应,DNP已被美国食品和药物管理局(FDA)禁止。此外,过去几十年中发现的许多产热调节剂,例如靶向G蛋白偶联受体、瞬时受体电位通道和核受体,都不是肥胖的理想药物。因此,需要进一步研究以鉴定关键的BAT产热的分子调节剂,从而为肥胖症开发安全有效的治疗手段。
A激酶锚定蛋白(AKAPs)是一组结构多样,可结合蛋白激酶(PKA)至特定位置实现相应功能的蛋白。其中,AKAP1可锚定PKA及其他蛋白质或mRNA到线粒体外膜(OMM),在OMM局部形成信号微区,调控线粒体功能。有报道指出,肥胖人群皮下脂肪组织中AKAP1表达低于正常人群。其他研究也表明敲除PKA调节亚基可导致小鼠变瘦。这些研究暗示AKAP1在脂肪代谢中的潜在作用。
2021年2月1日,空军军医大学(原第四军医大学)基础医学院邢金良、黄启超团队在Advanced Science杂志上在线发表了题为“AKAP1 Deficiency Attenuates Diet-Induced Obesity and Insulin Resistance by Promoting Fatty Acid Oxidation and Thermogenesis in Brown Adipocytes”的研究论文。研究首次报道了敲除AKAP1可促进棕色脂肪细胞脂肪酸β氧化,增加BAT产热,进而抵抗饮食诱导的肥胖和胰岛素抵抗。迈维代谢提供棕榈酰肉碱靶向检测。
1
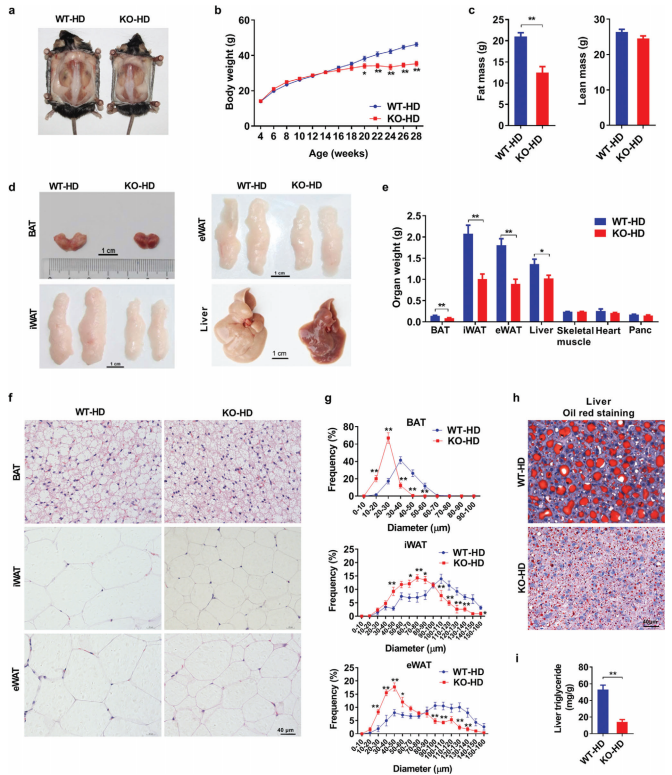
AKAP1基因敲除小鼠对高脂饮食诱导的肥胖有抵抗作用
使用Cas9方法得到AKAP1敲除(AKAP1-/-)小鼠。正常饮食下(ND),28周时,野生型(WT)与基因敲除小鼠的大小、体重、脂肪含量没有差异。同时BAT、腹股沟和附睾白色脂肪组织(iWAT和eWAT)、肝脏等组织也没有观察到明显异常。
而24周高脂饮食(HFD)实验中,敲基因小鼠体重和体脂都低于WT组(图1a-c)。敲基因小鼠,BAT、iWAT和eWAT和肝脏在内的主要脂肪存贮组织的重量抑制下降(图1d、e)。组织学分析敲基因小鼠BAT、iWAT和eWAT脂肪细胞显著减少(图f、g)。敲基因小鼠脂滴减少和肝甘油三酯含量降低。以上结果说明AKAP1基因敲除明显减轻了HFD诱导的肥胖。
2
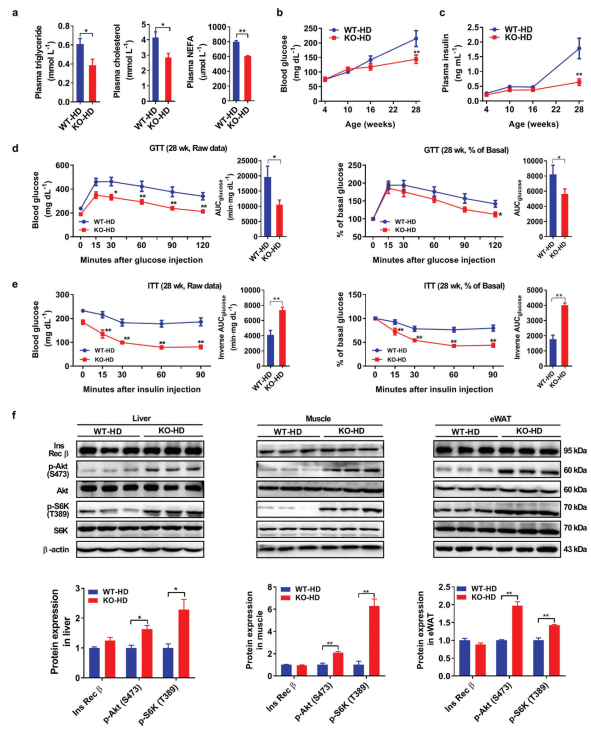
敲基因小鼠在HFD条件下代谢有改善
为了研究脂质储存减少是否对敲基因小鼠的全身能量稳态产生有益影响,进行代谢谱检测。24周HFD实验后,相对WT组,敲基因小鼠的空腹血浆甘油三酯、胆固醇和非酯化脂肪酸的浓度显著降低,同时空腹血糖和血浆胰岛素降低(图2a-c)。GTT和ITT的AUC结果显示,敲基因小鼠具备更有效的血浆葡萄糖清除率(图2d、e)。通过胰岛素受体后信号转导的蛋白质印迹分析,评估三种不同的组织中胰岛素的反应敏感性,结果显示敲基因小鼠的葡萄糖和胰岛素耐受性改善(图2f)。以上结果说明AKAP1基因敲除不仅减少了脂质储存,而且改善了HFD诱导肥胖的代谢特征,表明AKAP1基因敲除小鼠具有更高的脂肪利用率(即脂肪燃烧)。
3
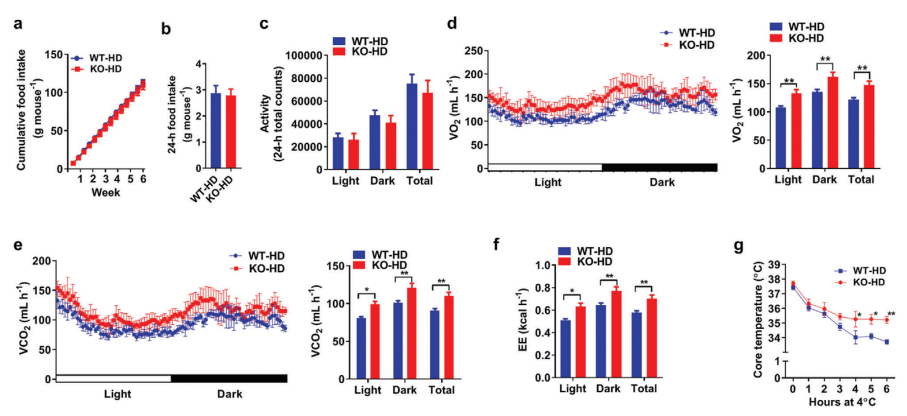
AKAP1-/-/HFD小鼠能量消耗和BAT线粒体产热增强
使用代谢笼测定ND和HFD条件下的每日食物摄入量、体力活动和能量消耗,发现WT组与敲基因组在食物摄入和体力活动上未观察到差异(图3a-c)。而AKAP1-/-HFD小鼠在黑暗和光照期的氧气消耗和二氧化碳产生显著增加(图3d、e)。AKAP1-/-HFD小鼠中营养物氧化过程中氧气消耗和二氧化碳产生量也显著增加(图3f)。相比正常饮食下,两组之间氧气消耗、二氧化碳产生和能量消耗未观察到显著变化。以上数据表明,AKAP1-/-HFD小鼠的能量消耗,与食物摄入或体力活动没有显著关联。
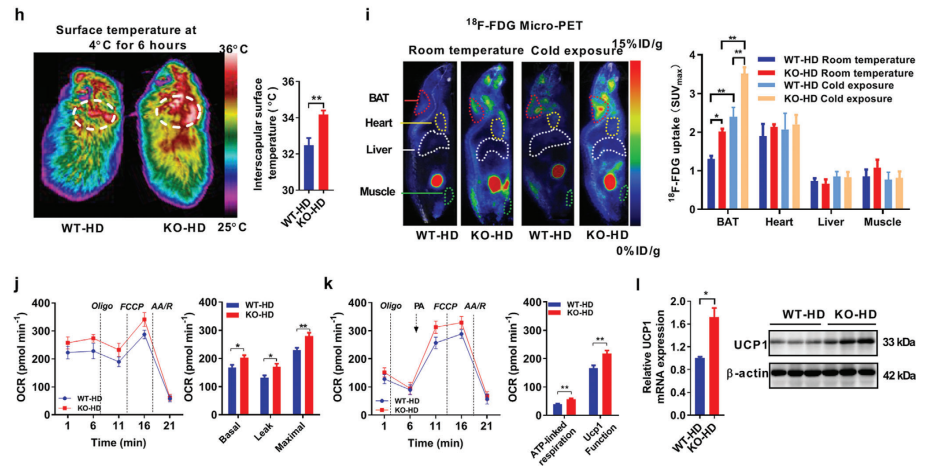
鉴于能量消耗增加的证据,接着研究冷诱导产热。保持室温条件下,WT/HFD组和AKAP1-/-HFD组之间没有观察到核心体温的显著差异。当置于4℃时,WT/HFD组和AKAP1-/-HFD组的体温逐渐下降,但WT/HFD组的下降幅度更大。在4℃下保持8小时,AKAP1-/-HFD组的核心体温仍然显著高于WT/HFD组(图3g)。红外热成像分析显示,AKAP1-/-HFD在4℃下6小时的身体温度明显高于WT/HFD组,尤其是在肩胛骨间BAT区域(图3h)。使用微正电子发射断层扫描进一步确定了18F-FDG的摄取,在室温或冷暴露期间,与WT/HFD组相比,AKAP1-/-HFD组的头部间BAT区域的FDG摄取量更高,而两种基因型之间的肌肉、肝脏或心脏区域没有差异(图3i)。有趣的是,正常饮食下,在冷暴露而不是室温下,敲基因小鼠的核心体温和表面温度也比WT小鼠高,这表明在高脂肪喂养或冷刺激下,AKAP1的敲除显著增强了BAT产热。此外,与WT/HFD组相比,AKAP1-/-HFD组分离的BAT线粒体的基础和最大耗氧率(OCRs)显著增加(图3j)。同时,UCP1(线粒体产热指标)的功能和表达在敲基因小鼠的BAT中显著上调(图3k,l)。相比正常饮食下,两组小鼠的OCR、UCP1功能和BAT线粒体表达没有显著差异。这些结果表明,在正常条件下,AKAP1基因敲除可能对BAT产热没有显著影响。然而,在应激条件下,如冷暴露或高脂肪喂养,AKAP1敲除显著增加小鼠的BAT产热和能量消耗。
4
恢复BAT中的AKAP1表达可逆转AKAP1-/-HFD小鼠的有益作用
为了进一步说明AKAP1对肥胖和胰岛素抵抗的影响,通过直接注射表达AKAP1的腺相关病毒(AA VDJ)载体来恢复AKAP1在AKAP1-/-HFD小鼠的肩胛骨BAT中的表达。在BAT内注射AAVDJ-AKP1后,AKAP1-/-HFD小鼠BAT中的AKAP1表达显著恢复。相比之下,其在其他器官中几乎没有检测到(图4a)。虽然累积食物摄入量没有显著差异(图4b),但在BAT中恢复AKAP1后,AKAP1-/-HFD小鼠的体重和脂肪量显著增加至WT/HFD小鼠的水平(图4c,d)。在AKAP1恢复后,AKAP1-/-HFD小鼠的BAT、iWAT和eWAT的大小持续显著增加,与WT/HFD小鼠非常相似(图4e)。此外,在BAT中注射AA VDJ-AKAP1还逆转了由AKAP1敲除诱导的代谢改善,这由空腹血糖升高和葡萄糖及胰岛素耐受性受损证明(图4f-h) 。结果进一步证明了BAT AKAP1在HFD诱导的肥胖和胰岛素抵抗中的关键作用。

5
AKAP1通过抑制长链脂肪酸CoA连接酶1(ACSL1)活性来降低脂肪酸氧化
考虑到脂肪酸是BAT生热的主要燃料,因此需要确定AKAP1是否通过调节脂肪酸代谢来抑制BAT生热。AKAP1敲除显着增加了HFD小鼠BAT中的棕榈酰肉碱(脂肪酸氧化的底物)水平(图5a)。棕榈酰肉碱水平升高可能与FAO升高或FFA利用率降低有关。为了解释这一变化,进一步评估在存在外源棕榈酸酯的情况下,使用Seahorse分析仪进一步评估了棕色脂肪细胞中的脂肪酸氧化(图5b)。数据显示,AKAP1敲除显着增强了棕色脂肪细胞的基础耗氧量和最大耗氧量。为了阐明AKAP1减少脂肪酸氧化的分子机制,通过IP-MS技术鉴定了与AKAP1物理相互作用的蛋白质。在由抗AKAP1抗体免疫共沉淀的产物中观察到约80kDa的明显条带(图5C)。被鉴定出在与AKAP1相互作用最强的蛋白质中,ACSL1位于线粒体外膜上,可将脂肪酸导入线粒体进行氧化。AKAP1和ACSL1之间的物理相互作用和线粒体共定位在棕榈酸酯处理24h的小鼠棕色脂肪细胞中通过co-IP和免疫荧光分析得到了进一步证实(图5d,e)。进一步调查AKAP1是否影响ACSL1的生物学功能。值得注意的是,敲除AKAP1对ACSL1的表达水平和亚细胞位置没有影响(图5f)。但是,线粒体ACS的酶活性在AKAP1-/-HFD小鼠的BAT中显着增加(如前所述,其中90%由脂肪细胞中的ACSL1活性组成)(图5g)。鉴于AKAP1的功能是将PKA结合在线粒体上,令人好奇地推测AKAP1 / PKA可能使线粒体ACSL1磷酸化,从而调节其活性。来自AKAP1-/-HFD小鼠的BAT中线粒体PKA的酶活性显着降低。相比之下,野生型和AKAP1-/-HFD小鼠之间的BAT总PKA活性没有显着差异(图5h)。接下来试图证明ACSL1确实是PKA的磷酸化靶标。由于缺少有关ACSL1中磷酸化位点的数据,ACSL1从线粒体中进行了免疫沉淀,并通过抗磷酸化(Ser / Thr)PKA底物抗体的免疫印迹分析了其磷酸化水平。一致地,BAT中来自AKAP1-/-的线粒体ACSL1磷酸化水平(p-ACSL1)降低与来自WT对照的HFD小鼠相比(图5i)。外,小鼠BAT中的线粒体p-ACSL1分别通过PKA激活毛喉素(FSK)和抑制剂H89强烈增加和减少(图5j)。以上研究表明AKAP1通过抑制BAT中的线粒体ACSL1活性而起到脂肪酸氧化的制动作用。
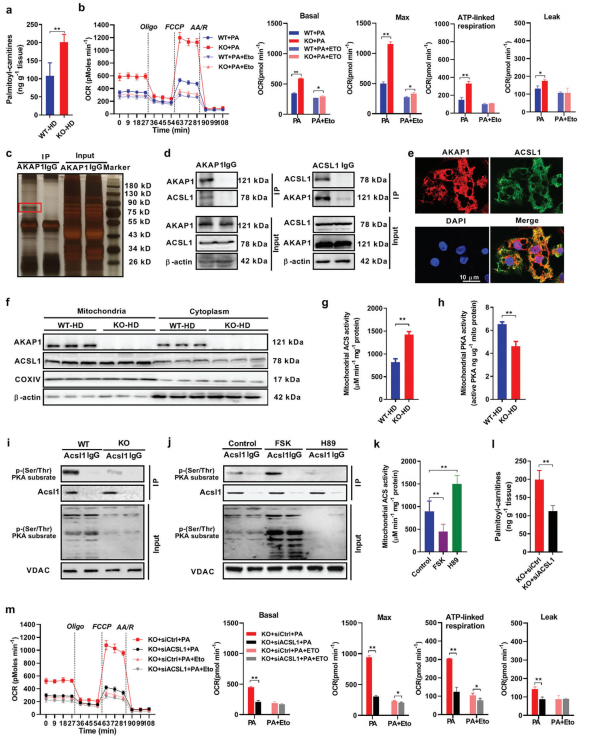
6
AKAP1基因敲除通过增强脂肪酸氧化增加棕色脂肪细胞线粒体的热生成
进一步验证AKAP1介导的脂肪酸氧化在棕色脂肪细胞线粒体生热中的关键作用。从AKAP1-/-小鼠的BAT中分离初级原代脂肪细胞并进行分化,然后在500 µM棕榈酸酯培养24 h后,在不同处理下评估耗氧率和UCP1表达。与野生型相比,AKAP1-/-棕色脂肪细胞中去甲肾上腺素(NE)依赖性和氧消耗率显着增加(图6a)。此外,AKAP1-/-棕色脂肪细胞中的UCP1 mRNA和蛋白质水平也显着上调(图6b)。这些数据证明了棕色脂肪细胞中AKAP1敲除增加了线粒体的生热作用。ACSL1敲低和依托莫昔处理可显着降低AKAP1-/-棕色脂肪细胞中的耗氧率和UCP1表达,表明脂肪酸氧化在线粒体生热中的关键作用(图6c-f)。以上数据表明,AKAP1敲除增强了脂肪酸的氧化作用,从而增加了棕色脂肪细胞中线粒体的生热作用。
7
在肥胖条件下,AKAP1的反馈下调
进一步研究AKAP1表达与人类和小鼠肥胖状况的关系。首先,使用GEO中的公共转录组数据评估肥胖和瘦人受试者脂肪组织AKAP的mRNA表达水平(图7a)。有趣的是,在双胞胎中高体重相对于低体重组,皮下脂肪组织(SATs)AKAP1 mRNA水平显着降低。此外,与健康对照组相比,肥胖患者的SAT中AKAP1 mRNA水平显著下调,减肥手术可有效逆转这种情况。此外,在低热量饮食诱导超重和肥胖人群体重减轻后,AKAP1表达上调。然而,在不同的代谢条件下,其他代谢相关组织包括肝脏和肌肉中的AKAP1表达没有明显变化(图7b)。其次,在肥胖条件下,测量小鼠不同组织的AKAP1的mRNA和蛋白的表达量。与对照组相比,ob/ob和db/db小鼠的BAT、eWAT、iWAT等脂肪组织中AKAP1 mRNA和蛋白表达均显著下调(图7c、d)。相比之下,对照组与ob/ob或db/db小鼠的肝脏和肌肉中AKAP1表达无显著差异(图7e、f)。如图7g,h, AKAP1在BAT, eWAT, iWAT中表达显著下调,且呈时间依赖性。最后,通过500或1000 μM棕榈酸盐进一步证实HFD诱导的小鼠初级棕色脂肪细胞和人白色脂肪细胞AKAP1的下调(图7i、j)。综上所述,这些研究结果表明,在肥胖状态下,AKAP1的表达逐渐下调,这表明通过调控AKAP1的表达来对抗其促进肥胖的作用。
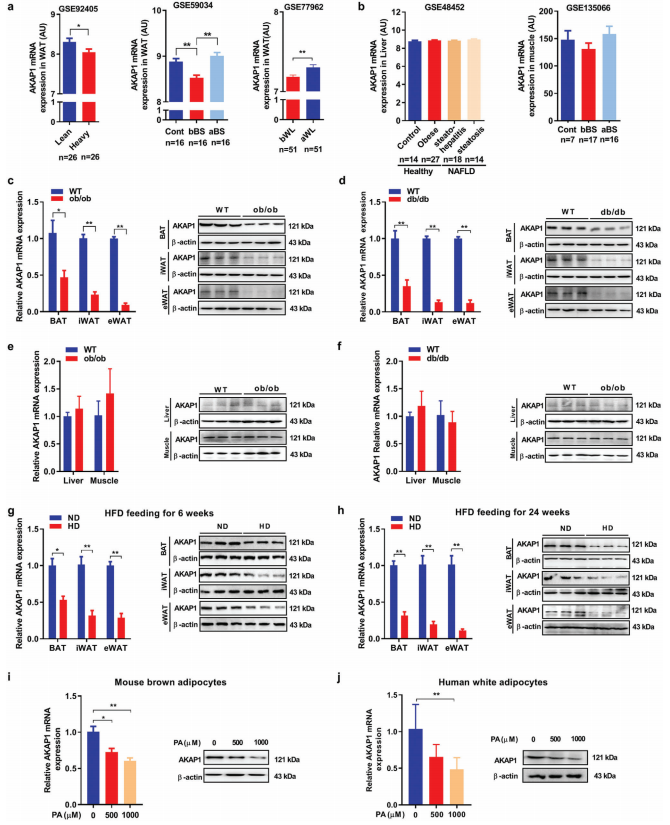
8
AKAP1抑制剂减轻HFD诱导的肥胖和胰岛素抵抗
为了测试AKAP1是否有潜力作为肥胖治疗的目标,作者依据AKAP1线粒体定信号合成了全长(30aa)或核心区域(21aa)的两个肽,其分别命名为AP-30和AP-21,用以竞争性阻断AKAP1在线粒体外模上的定位。首先通过短期治疗初步研究了两种肽对HFD诱导的肥胖的影响 (每日向肩胛间BAT区皮下注射7天)。数据显示,对照组和不同浓度AP -30处理小鼠的体重没有显著差异。相比之下,AP -21处理的小鼠表现出剂量依赖性的体重下降趋势。之后,失去靶向线粒体能力的突变体AP-21被合成作为对照肽。正如预期的那样,AP-21肽明显抑制了AKAP1线粒体的定位。相比之下,突变肽对AKAP1线粒体定位没有显著影响。因此,本研究采用2 mg/kg剂量进一步研究AP-21在HFD诱导的肥胖早期和晚期较长治疗时间(4周)的抗肥胖作用。
图8a,b所示,与突变体AP-21或生理盐水处理相比,AP-21长期治疗(4周)在肥胖早期和晚期(HFD分别饲喂6周和20周)均显著降低了HFD小鼠的体重和脂肪质量。组织学分析显示,AP-21治疗后,BAT、iWAT和eWAT小鼠的脂肪细胞直径显著降低,肝脏脂肪变性明显减少(图8c)。此外,AP-21治疗也显示出代谢方面的益处,如降低空腹血浆甘油三酯(图8f)。此外,AP -21处理的小鼠有改善糖耐量和胰岛素耐量的趋势(图8d,e)。如图8g所示,三组累积摄食量无显著差异,而AP-21处理显著提高了HFD小鼠的能量消耗(图8h)。此外,还评估了AP-21对其他器官的副作用。AP-21治疗后肾、心脏和肌肉组织形态学无明显变化。肾、肝、心功能需要更进一步的测定。AP-21治疗后血尿素氮(BUN)、血清肌酐(Cre)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)水平无明显变化。同样,超声心动图分析也显示AP-21对小鼠心脏功能没有明显的不利影响。综上所述,我们的研究结果表明,AKAP1抑制剂(2 mg/kg/每天)能显著降低HFD所致的肥胖和胰岛素抵抗,对其他器官功能无明显不良影响。

作者制备AKAP1敲除鼠并进行高脂喂养发现:
AKAP1敲除(AKAP1-/-)小鼠能抵抗饮食诱导的肥胖及代谢异常
AKAP1敲除显著提高小鼠BAT产热;恢复AKAP1-/-小鼠BAT中AKAP1的表达明显逆转了抗肥胖作用;
AKAP1可通过PKA磷酸化长链脂酰辅酶A合成酶ACSL1并抑制其活性,进而减少脂肪酸β氧化和BAT产热;
AKAP1多肽抑制剂可有效缓解饮食诱导的肥胖。
上述证据提示AKAP1可以作为肥胖潜在的治疗靶点。
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家