STTT | 孙涛/周红刚/刘艳荣等首次报道3-羟基丁酰化促进肝癌干细胞增殖新机制
2021-04-15 13:10:47, 景杰学术 杭州景杰生物科技股份有限公司

景杰学术|报道
肿瘤转移相关蛋白(metastasis-associated proteins, MTAs) 是核小体重塑/组蛋白去乙酰酶复合物 (nucleosome remodeling and histone deacetylase, NuRD) 的重要组成部分,家族成员主要包括MAT1、2、3,它们通过转录因子NuRD改变染色质状态以影响下游靶基因的转录过程,进而参与多种肿瘤的侵袭、转移等过程。然而,独立于NuRD,MATs是否能直接发挥转录调控作用尚不清楚。
脂解产生的乙酰辅酶A除了进入三羧酸循环氧化之外,还可以在肝脏中合成酮体(ketone body)。酮体包括三个不同的小分子:丙酮、乙酰乙酸(AcAc)和β-羟基丁酸酯(β-HB)。β-羟基丁酸脱氢酶(BDH1)作为酮体代谢过程中的主要限速酶,控制着乙酰乙酸(AcAc)与β-羟丁酸(βHB)的转化。而AcAc和βHB的代谢物是乙酰化(Kac)和3-羟基丁酰化(Kbhb)的前体。β-羟基丁酰化修饰(又称3-羟基丁酰化修饰)于2016年芝加哥大学赵英明教授课题组首次报道发现,近年来多项研究报道,该修饰可能在能量代谢、肿瘤代谢、DNA损伤修复等过程中都发挥重要作用。
2021年4月2日,南开大学药学院孙涛教授、周红刚教授,济宁医学院附属医院病理科刘艳荣教授等在国际专业学术期刊Signal Transduction and Targeted Therapy(IF=13.493)以Letter形式发表了题为MTA2 triggered R-loop trans-regulates BDH1-mediated β-hydroxybutyrylation and potentiates propagation of hepatocellular carcinoma stem cells的研究成果。首次发现,MTA2可以通过R环结构反式调节BDH1介导的组蛋白3-羟基丁酰化修饰,并促进肝癌干细胞增殖。景杰生物为该研究提供了高特异性的3-羟基丁酰化修饰、乙酰化修饰抗体及免疫组化抗体。

01
MTA2促进肝癌干细胞增殖
人类蛋白质图谱 (The Human Protein Atlas, HPA) 免疫组化数据显示,MTA2主要定位于细胞核并且在肝细胞癌 (HCC) 中高表达,此外,癌症基因组图谱 (The Cancer Genome Atlas, TCGA) 数据也显示,MTA2 mRNA表达量也在HCC中明显上调 (图1a)。重要的是,MTA2表达高的HCC患者预后较差 (图1b),意味着MTA2与肝癌细胞恶性程度高度相关。为了进一步探讨MTA2在肝癌中的生物学功能,研究人员根据MTA2的表达水平(以50%为临界值),将TCGA中的病例分为两组进行基因集富集分析(GSEA)。结果表明,MTA2上调HCC干性(图1c),并且MTA2表达水平与多种肿瘤干细胞标记物CD44、PROM1 (CD133)、POU5F1 (Oct4) 以及SOX9呈正相关。在HCC中,过表达MTA2增强了HCC干性并可以促进肿瘤细胞增殖;敲除MAT2则得到相反结果 (图1d)。以上结果共同表明,MTA2可以通过促进HCC干细胞的增殖,增强HCC恶性程度。
图1、MTA2对HCC恶性程度及增殖速率的影响
02
MTA2-HDAC2-CHD4复合体调控R环形成
随后,在CD133+ HCC细胞中,研究人员鉴定到一个由部分NuRD参与组成的分子复合物MTA2-HDAC2-CHD4,而NuRD复合物的组成蛋白质则在CD133- HCC中有所区别,提示MTA2-HDAC2-CHD4功能可能与HCC干性密切相关。结合ChIP分析及生化实验,研究人员发现CD133+ HCC细胞的R环累积较多,并且HCC中过表达MTA2也可以增加R环含量(图2f)。值得注意的是,MTA2诱导的R环形成并未受过表达MTA2ΔZnF、HDAC2或CHD4影响,HDAC抑制剂也并没有促进R环形成 (图2g)。结合这些证据,研究人员认为MTA2可以与HDAC2/CHD4形成新的复合体调控R环形成。
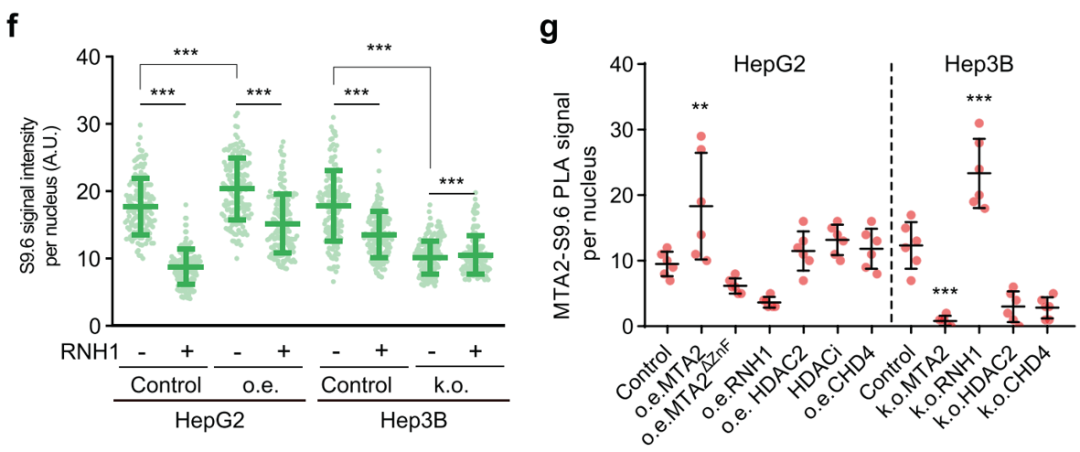
图2、MTA2-HDAC2-CHD4复合体对R环的影响
03
MTA2触发的R环调控的靶基因
BDH1是与MTA2和CD133共同表达的唯一基因,对肝癌的总生存率有显著影响。研究发现BDH1的表达与MTA2和CD133呈负相关。研究人员应用高特异性的3-羟基丁酰化修饰、乙酰化修饰抗体及免疫组化抗体(景杰生物,Kac, Kbhb, H3K9bhb),进一步探讨了BDH1对Kac和Kbhb的影响。结果显示BDH1可上调Kac水平,下调Kbhb水平(图3j)。H3K9bhb在活性基因的TSSs处最富集,H3K9bhb水平与BDH1呈负相关(图3k)。此外,TCGA数据集还证实了导致肝癌预后不良的5个靶基因,即JMJD6、GREB3、GTPBP4、NPM1和TIMM23。五个基因的mRNA水平与BDH1呈负相关(图3l),这些基因可能受MTA2-Rloop-BDH1-Kbhb轴调控,并进一步验证了MTA2-Rloop-BDH1-Kbhb轴对HCC干细胞的影响。

图3、BDH1对Kac和Kbhb的影响
总之,该研究发现了一个由NuRD复合物的一部分组成的复合物,即MTA2-HDAC2-CHD4,揭示了MTA2可以与HDAC2/CHD4相互作用,并通过R-环转录抑制BDH1,导致βHB的积累,以及H3K9bhb的增加,从而产生促进HCC形成和进展的连环效应。研究首次揭示了3-羟基丁酰化修饰在肝癌发生发展中的调控机制,为我们揭示了这一新型酰化修饰的新的生物学功能。也再度印证了机体的异常代谢和微环境也是肿瘤形成和发展的重要条件,启示我们翻译后修饰,尤其是与代谢密切相关的3-羟基丁酰化、乳酸化、巴豆酰化等新型酰化修饰在肿瘤代谢中的重要研究价值。
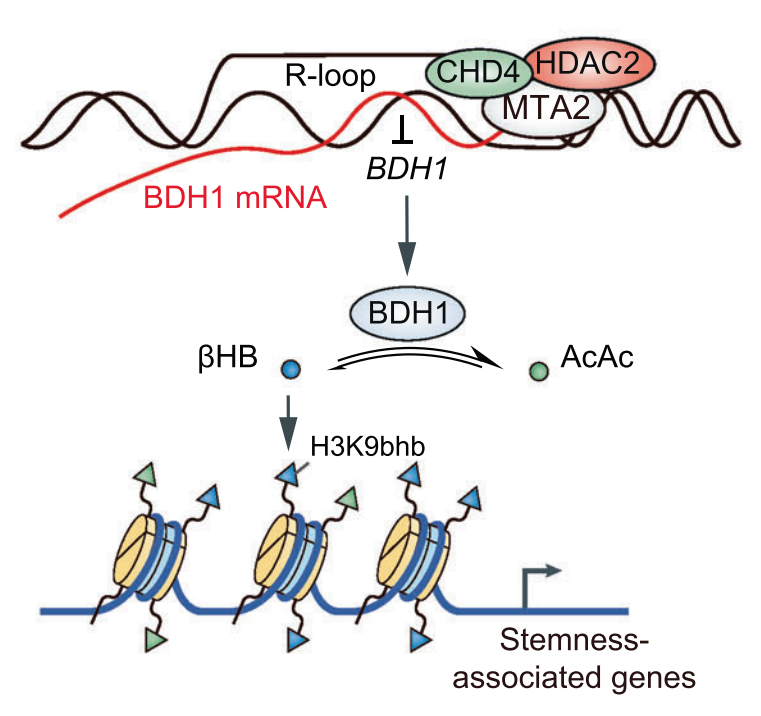
图4、肝癌组织中MTA2-Rloop-BDH1-Kbhb轴的调控模型
往期推荐
专家点评 | Science Advances:全新解析三羟基丁酰化修饰调控酶和蛋白底物
2021-02-25

“清洁燃料”酮体——β-羟丁酸,将断癌细胞”粮草“?
2021-02-03
4D修饰首秀-四川大学华西医院李涛教授团队揭示酮体β-羟基丁酸靶向调控线粒体-炎症环路减轻HFpEF
2020-12-02

北大医学院赵文会组首次发现P53 β-羟基丁酰化修饰减弱其肿瘤抑制功能
2019-03-22
大咖专访 | Andrew Webb教授:全新一代4D-修饰蛋白质组学与临床医学研究
2020-06-15
参考文献
Heng Zhang, et al., 2021, MTA2 triggered R-loop trans-regulates BDH1-mediated β-hydroxybutyrylation and potentiates propagation of hepatocellular carcinoma stem cells. Signal Transduction and Targeted Therapy.
本文由景杰学术团队报道,欢迎转发到朋友圈。如您需要搜索更多往期精彩内容,可
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
07-01 英斯特朗
连载 | 药物一致性评价与粒度分析(三)07-01 欧美克仪器
【仪器百科】LS-909丨干湿二合一激光粒度分析仪07-01 欧美克仪器
标准物质解决方案 | PFASs(全氟及多氟化合物)06-29
第九期阿尔塔有约 | 环境专题【新污染物:PFAS】技术研讨会精彩回顾及提问解答06-29
“绿色技术范式”,分析化学未来发展方向——访中国分析测试协会副理事长、辽宁省分析科学研究院原院长刘成雁教授06-29 转载仪器信息网
华西医院-标准型数显脑立体定位仪、双通道体温维持仪、体式显微镜安装完成06-29 迈越生物
科鉴检测助力2家仪器企业获得首批产品可靠性认证证书06-28 科鉴检测
德国耶拿:锂电池生命周期分析解决方案06-28 德国耶拿
AI已来!生命科学本科教学如何紧跟技术浪潮06-28 Opentrons
盛瀚售后,五星级服务的秘诀是什么?06-28 SHINE
专为汽车制造商打造的柔性解决方案——实现制程控制06-28
西北工业大学-脑立体定位仪安装完成06-28 迈越生物
会议邀请 | 第九届海上检验医师论坛06-28
卓立要闻 | 创新发展ing…6月卓立“大事小情”速览06-28 光电行业都会关注
打造信任合作伙伴!2024年度卓立汉光客户满意度调查开启06-28 光电行业都会关注
如何挑选适用于三阶光学非线性的测量系统?Z扫描测量系统来助力!06-28 光电行业都会关注
招聘启事—中国科学院沈阳自动化研究所微纳光学测量表征技术课题组06-28 光电行业都会关注
谱育科技作为主要完成方 荣获2023年度国家科学技术进步一等奖和二等奖06-28 点击关注→
仪器原理丨顶空仪与吹扫捕集仪科普小知识06-28 天美色谱