终于安排上了!手把手教你工具病毒的注射方法(中)
2021-02-22 11:19:58, Dr.shan 上海吉凯基因医学科技股份有限公司

上一期工具病毒常用注射方法介绍中总结了神经系统病毒感染的常用注射方法,本期将重点介绍工具病毒感染呼吸系统常用注射方法。

呼吸系统主要由鼻、咽、喉、气管、支气管、肺组成,通常将鼻、咽、喉称为上呼吸道,气管以下的气体通道(包括肺内各级支气管)部分称为下呼吸道。工具病毒感染呼吸系统常用注射方法主要有滴鼻、气管内注射、气管注射、尾静脉注射等。具体操作如下:

滴鼻注射


图1. 小鼠滴鼻注射操作示意图
1
实验前准备
a. 病毒准备:实验前将病毒从-80℃冰箱取出,置于冰上融化;
b. 麻醉:小鼠称重后腹腔注射1%的戊巴比妥(剂量为80mg/kg体重),置于饲养笼内,约5~10min;
2
病毒注射
a. 小鼠抓取:取完全麻醉(确保呼吸稳定)的小鼠,用优势手捏住小鼠背部皮肤,并用拇指和食指夹住头颈部皮肤来固定头部,翻转手腕使小鼠腹部对向操作人员,保持身体舒展,头部向上,身体与水平面呈45°倾角,再用非优势手拇指捂住小鼠嘴巴,食指弯曲压在小鼠鼻骨上方(见图2);
b. 病毒注射:另一操作人员用移液器吸取适量的融化好的病毒液,将移液器尖端置于小鼠鼻孔处并与之呈90°夹角,而后均匀缓慢的将病毒逐滴滴注在小鼠鼻孔中(保证滴注过程小鼠不打喷嚏),一侧鼻孔滴注一半体积的病毒后换另一鼻孔;

图2. 滴鼻注射中小鼠抓取固定示意图
3
动物恢复
滴鼻结束后将小鼠放回饲养笼内,旁边放置电暖器等适当的取暖装置,待其苏醒。
4
注意事项
a. 麻醉要保证小鼠肌肉完全放松,但呼吸要平稳,如麻醉后小鼠呼吸急促不稳等不得滴注病毒;
b. 传统滴鼻多单人操作,无法捂住小鼠口部,病毒滴注后有可能经口腔呼出等,病毒损失较大,该方法双人操作,可以减少病毒损失,感染效果更好;
c. 滴鼻注射时病毒体积不宜太小,一般在50~80ul,若病毒滴度过高可用无菌的PBS或生理盐水稀释;
d. 滴鼻注射时小鼠鼻子周围不可有湿润,否则病毒溶液会流走而损失。

气管插管注射

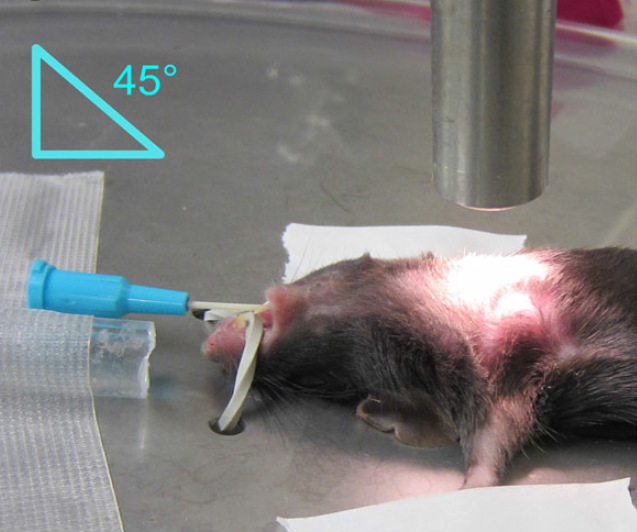
图3. 气管插管法注射示意图
1
实验前准备
a.病毒准备:实验前将病毒从-80℃冰箱取出,置于冰上融化;
b.麻醉:将小鼠放入气体麻醉腔中,通入氧气及2.5%的异氟烷,2~3分钟后使小鼠处于完全无意识状态;
2
气管插管
a. 将麻醉好的小鼠取出仰卧放置在手术板上,用医用胶布固定小鼠四肢并用皮筋穿过门齿固定在手术板上,使其嘴端朝向操作者并呈45°夹角,在小鼠鼻孔上方放置连通气体麻醉系统的软管,确保整个实验过程中小鼠处于稳定麻醉状态;
b. 在小鼠颈部上方放置一强光源(如fiber - lite®高强度光纤柔性光源,Dolan-Jenner Industries, MA United States),使得气管、食管等组织可视化;
c. 用不锈钢的弯头钳轻轻地将小鼠的舌头拉出至嘴的一侧并保持,以便直接看到会厌和喉头;
d. 将钝头的90°弯曲的不锈钢镊子深入到舌下,将舌头小心提起以便可以清楚的看到并进入气管,微调至会厌清晰可见(如光线不足可调整颈部上方光源位置);
e. 用惯用手将套管针置于食指和中指之间,用拇指稳定套管,引导套管经口和喉头进入气管,至气管分叉处立即停止前进,迅速移除金属导丝,在套管的末端连接气体麻醉系统导管,确保持续通氧气及异氟烷;
3
病毒注射
a. 吸取适量病毒,待小鼠稳定时,短暂移去麻醉系统导管,使用移液器将病毒注入套管使小鼠吸入;
b. 再将气体麻醉系统导管与套管相连,维持5~10min;
4
动物恢复
a. 待病毒完全吸入后撤掉气管插管,关闭气体麻醉系统;
b. 将小鼠从手术板上取下,放回饲养笼中,旁边放置电暖器等适当的取暖装置,待其苏醒。
5
注意事项
a. 异氟烷麻醉起效迅速但恢复也快,在暂时中断异氟烷的操作过程中要动作迅速,另外注意氟烷浓度不宜太高,过高小鼠易死亡;
b. 经气管插管注射病毒时损失较大,一般注射100ul,实际只有约80ul吸入,因此在注射时要适当增加体积;
c. 病毒注射后要保持小鼠仰卧状态5min以上,以便病毒能更好的感染到下呼吸道。

气管内注射


图4. 气管内注射操作示意图
1
实验前准备
a. 病毒准备:实验前将病毒从-80℃冰箱取出,置于冰上融化;
b. 麻醉:将小鼠放入气体麻醉室中,通入氧气及2.5%的异氟烷,2~3分钟后使小鼠处于完全无意识状态;
2
气管暴露
a. 将麻醉好的小鼠取出仰卧放置在手术板上,将连通麻醉系统的鼻锥放在鼻子上保持麻醉;
b. 用医用胶布固定小鼠四肢使其呈伸展状态并用皮筋穿过门齿固定在手术板上;
c. 剃除小鼠颈部正中位置的毛发,并依次用酒精和碘伏对剃毛处进行清洁及无菌处理;
d. 轻掐小鼠后脚趾确认其处于无意识状态后,用镊子夹起两前肢中间的颈部皮肤,使用外壳手术刀做一个约5~7mm的切口,暴露出气管(图5);

图5. 颈部切口暴露气管
3
病毒注射
a. 用注射器吸取适量病毒,置于冰上备用;
b. 调整小鼠位置使其头部朝向操作者,用非优势手持弯头镊轻轻地固定住气管;
c. 用优势手持注射器,针头尖端斜面向上并与气管呈45°角,沿该方向将针头插入气管几毫米后缓慢注入病毒,注射完毕停顿约5s后再慢慢抽出针头;
4
动物复苏
a.移走镊子,用缝合线将颈部皮肤切口缝合;
b.关于麻醉系统,将小鼠从手术板上取下,放回饲养笼中,旁边放置电暖器等适当的取暖装置,待其苏醒。
5
注意事项
a. 异氟烷麻醉起效迅速但恢复也快,在暂时中断异氟烷的操作过程中要动作迅速,另外注意氟烷浓度不宜太高,过高小鼠易死亡;
b. 针头插入气管后要轻轻地从小鼠身上向外移动,观察确认其是否插入到气管中。

尾静脉注射

尾静脉注射方法已在上一期软文《手把手教你工具病毒的注射方法(上)》中详细介绍,本期不再赘述。
最后,对以上注射方法特性总结如下表:
注射方法 | 适用情况 | 优 势 | 不 足 |
滴鼻注射 | 上呼吸道感染,如鼻腔上皮细胞、气管上皮细胞、肺叶的近端等 | 操作简单、快速,对小鼠无损伤,变量少,效果稳定 | 需两人操作,对肺叶末端感染效果较差 |
气管插管注射 | 上呼吸道及下呼吸道感染,如鼻腔上皮细胞、气管上皮细胞、肺叶的近中及末端等 | 病毒用量少,单人操作方便,可感染到肺叶末端 | 操作麻烦,技术要求高,费时,病毒损失严重,对动物损伤较大 |
气管内注射 | 下呼吸道,肺叶近端、中段及末端 | 病毒用量少,下呼吸道感染效果好,且肺部特异性好 | 操作麻烦,手术技能要求高,侵入式对动物损伤较大,影响因素多 |
尾静脉注射 | 下呼吸道感染,肺部的内皮细胞等 | 操作简单,损伤小 | 病毒用量大,全身感染无特异性 |
上述为呼吸系统病毒感染常用注射方法,下期我们将整理心血管系统及肾脏的病毒注射方法,敬请关注~
超级双12 · 直播
工具载体和科研服务,精选全年最受关注的技术问题进行线上交流和解答!
还有吉凯2021年重磅新品预热,iPhone12等众多好礼免费抽!
赶紧扫码入群抢座位吧~
如想关注最新科研进展,请关注我们↓↓↓

04-08 Ekspla
哈希旗舰店店庆盛典|特价回馈 感恩有你04-08
哈希高品质供水水质分析与检测技术论坛04-08
应用专家服务周丨福建站04-08
相约厦门丨2024年度华东地区(电子)显微学学术交流会04-08
限时优惠 | 警惕"两虫"危害!守护饮用水安全04-07
喜讯 | 广电计量成为亚马逊SPN服务商 助力跨境企业出海!04-07
走进实验室 | 3分钟,带您了解测绘计量!04-07
走进实验室 | 天津广电计量服务能力介绍,看完就知道!04-07
聚焦新材料,新材料(磁性材料)分析测试解决方案技术研讨会暨“全国分析测试技术联盟”成立会议圆满落幕04-07
新锐产品 │ 海光原子吸收E50荣获“仪器设备新锐产品”殊荣04-07
2024青岛分析测试学会盛会即将开幕04-07
致力创新 │ 海光荣获“北京市企业技术中心”称号04-07
海光邀您参加第二十五届全国光谱仪器学术研讨会04-07
原子荧光光度计培训班欢迎您参加!04-07
德国斯派克常州用户交流会期待您的莅临04-07 市场部
会议回放|screenIT™ - 以 CRYSTAL POWDERDOSE 简化催化筛选04-06 力扬 NIKYANG
千里莺啼绿映红,巢湖观鸟公益行04-04 WAYEAL皖仪
科技驱动 中国智造 | 皖仪科技即将远航,亮相慕尼黑Analytica 2024国际舞台04-04 WAYEAL皖仪
清明 | 护净水清泉,润世间万物04-04
