Nature Communications | 谷氨酰胺氮代谢转变有助于癌症恶性进展
2020-08-14 02:06:02, 麦特绘谱 麦特绘谱生物科技(上海)有限公司
葡萄糖和谷氨酰胺是维持细胞内能量生成和生物合成的两大营养物质。葡萄糖是碳的主要来源,而谷氨酰胺不仅提供碳,还提供氮,是合成各种生物化合物如嘌呤和嘧啶核苷酸、6-磷酸葡萄糖胺和非必需氨基酸所必需的原料。谷氨酰胺通过谷氨酸转化为α-酮戊二酸 (α-KG),α-KG作为谷氨酰胺衍生碳进入TCA循环途径。谷氨酰胺酶(GLS)将谷氨酰胺的γ-氮清除生成谷氨酸和游离氨,是谷氨酰胺回补的限速步骤。GLS1在癌症中经常出现失调,其表达被c-Myc正向调控,提高c-Myc水平会在核苷酸生物合成途径中诱导磷酸核糖焦磷酸酰胺转移酶(PPAT)的表达,它将谷氨酰胺的γ-氮转移到5-磷酸核糖焦磷酸(PRPP),而这是嘌呤生物合成的关键限速反应。虽然谷氨酰胺分别受到GLS1分解代谢和PPAT合成代谢的直接影响,但谷氨酰胺与肿瘤恶性程度的关系仍有待阐明。日本九州大学Keiichi I. Nakayama团队利用靶向蛋白质组学(iMPAQT)与代谢组学分析结合稳定同位素标记谷氨酰胺检测小细胞肺癌(SCLC)等癌症代谢全貌,相关成果发表于《Nature Communications》。
蛋白质组和代谢组变化全貌
本研究首先通过将hTERT、SV40早期区域和c-Myc (TSM)导入正常人源二倍体成纤维细胞系TIG-3中建立转化细胞(TSM),将在三维(3-D)培养基中生长的TSM克隆在2-D培养基中扩增以获得AIG(锚定非依赖性生长)-1、AIG-2和AIG-3细胞,TSM到AIG-3的恶性进展与c-Myc表达增加有关(图1e-f)。

对TSM及AIG-1、AIG-2和AIG-3细胞进行iMPAQT分析,共检测到342种代谢酶。与TSM细胞相比,AIG-3细胞中某些糖酵解酶如己糖激酶2(HK2)、烯醇酶1(ENO1)和乳酸脱氢酶A(LDHA)的丰度增加,且葡萄糖摄取也增加(图2a),表明Warburg效应在AIG-3细胞中更为明显。GO富集分析显示,AIG-3细胞中受影响最大的生物学过程是核酸生物合成途径(图2b),核苷酸从头和回补途径涉及的大多数酶的数量(如PPAT)都是协同增加的,但谷氨酰胺回补通路限速酶GLS1被下调(图2c-d),而丙酮酸脱氢酶E1α亚基(PDHA1)(氧化丙酮酸从而导致TCA回补)则被上调(图2c-d)。为了验证蛋白质组水平观察到的葡萄糖代谢变化,本研究采用[13C6]葡萄糖进行同位素分析(图2e),结果显示,与TSM细胞相比,AIG-3细胞柠檬酸、天冬氨酸、谷氨酸的13C标记效率和代谢物池大小显著增加(图2f–h),尤其是柠檬酸、天冬氨酸和谷氨酸的M+2增加与AIG-3细胞中PDHA1介导的丙酮酸的碳源增加是一致的。在癌症恶性进展过程中,依赖谷氨酰胺作为关键底物的核苷酸从头生物合成途径中的PPAT水平和进入TCA循环的谷氨酰胺回补途径中的GLS1水平在恶性进展中以相互作用方式进行调节。在AIG-3细胞中PPAT表达基因受c-Myc调控而表达上调(图1e),相反GLS1 mRNA表达下调。
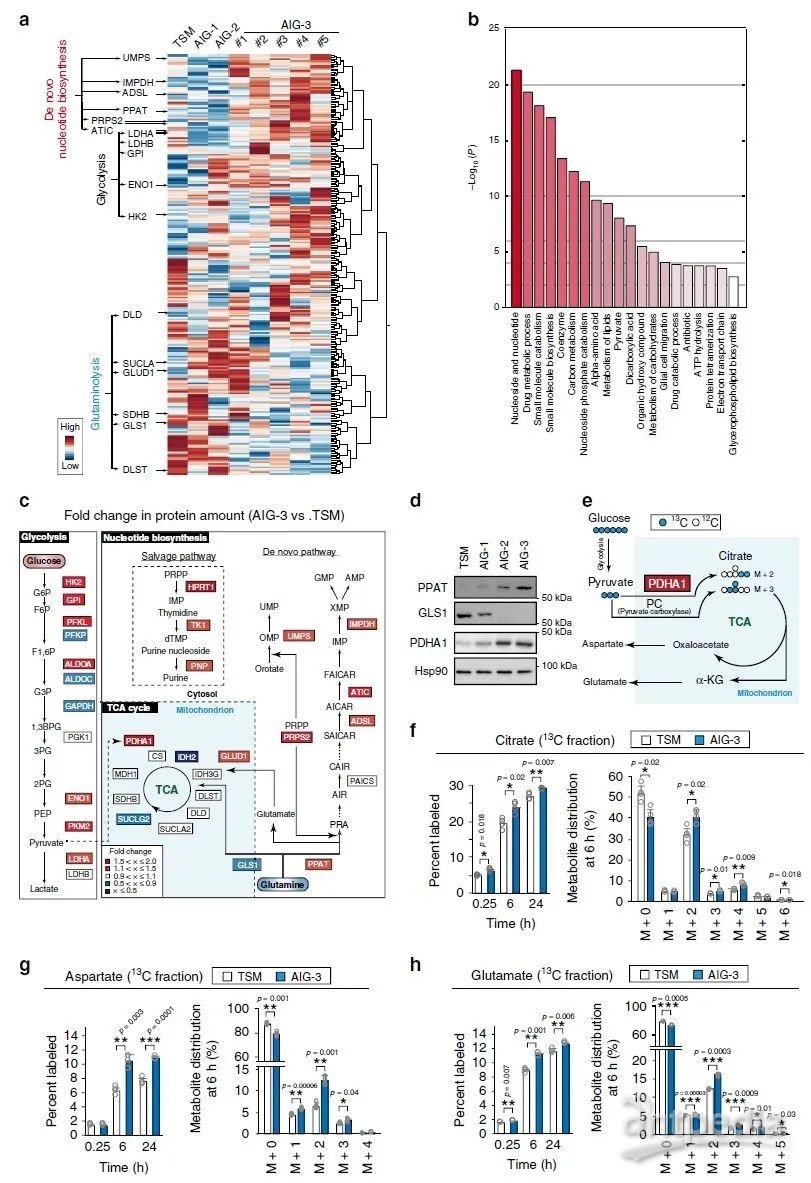
为了证实蛋白质组水平观察到的谷氨酰胺代谢的变化,在TSM和AIG-3细胞中对[13C5/15N2]谷氨酰胺进行同位素分析(图3a)。TSM和AIG-S在2D培养物中的细胞生长(图3b)或[13C5/15N2]谷氨酰胺掺入以及15N和13C标记的谷氨酸和天冬氨酸产物(图3c e)都没有显著差异。稳态下的标记效率可以反映许多代谢反应的活性却很难评估对单个反应的影响,因此,作者评估了标记后早期(0.25h)和晚期(6h和24h)对每个反应的标记效率。在TSM或AIG-3细胞中均未检测到13C标记的IMP、AMP、GMP或UMP,而相比TSM细胞,在标记后6h和24h,AIG-3细胞核苷酸从头生物合成途径中15N标记的IMP(图3f)、AMP(图3g)、GMP(图3h)和UMP(图3i)显著增加。在AIG-3细胞中,IMP氮标记效率不仅在M+1和M+2组分中增加,而且在M+3中也增加(图3f),表明源于[15N]谷氨酰胺的[15N]天冬氨酸也有助于此标记(图3e)。与TSM细胞相比,AIG-3细胞中15N核苷酸(IMP、AMP、GMP和UMP)标记效率提高(图3f-i)与其池的减小有关。考虑到AIG-3细胞中核酸合成酶的显著上调和核苷酸标记效率的显著提高,这些细胞中核苷酸代谢物池的减小可能是由核苷酸合成速率的增加所致。
在含有人体血浆生理浓度氨基酸的培养基中培养5天后,用0.6 mM [13C5/15N2]谷氨酰胺标记TSM和AIG-3细胞,AIG-3细胞对AMP和GMP的15N标记效率显著高于TSM细胞。在标记后0.25h基本上未检测到15N核酸代谢物,这表明在早期由GLS1介导的谷氨酰胺回补反应主要负责α-KG和富马酸的产生。标记6h或24h后两种细胞中α-KG和富马酸盐的13C标记效率没有差异(图3j-k),表明在该时间点这些代谢物反映了源自GLS1和PPAT依赖途径的总和。与TSM细胞相比,AIG-3细胞在0.25h时α-KG和富马酸标记效率显著降低(图3j-k),表明AIG-3细胞中GLS1活性降低。综上,蛋白质组学和代谢组学数据一致表明,在实验癌细胞模型恶性转化过程中,谷氨酰胺的命运基本上从TCA循环转移到核苷酸从头生物合成途径。
PPAT-GLS1平衡决定着谷氨酰胺命运
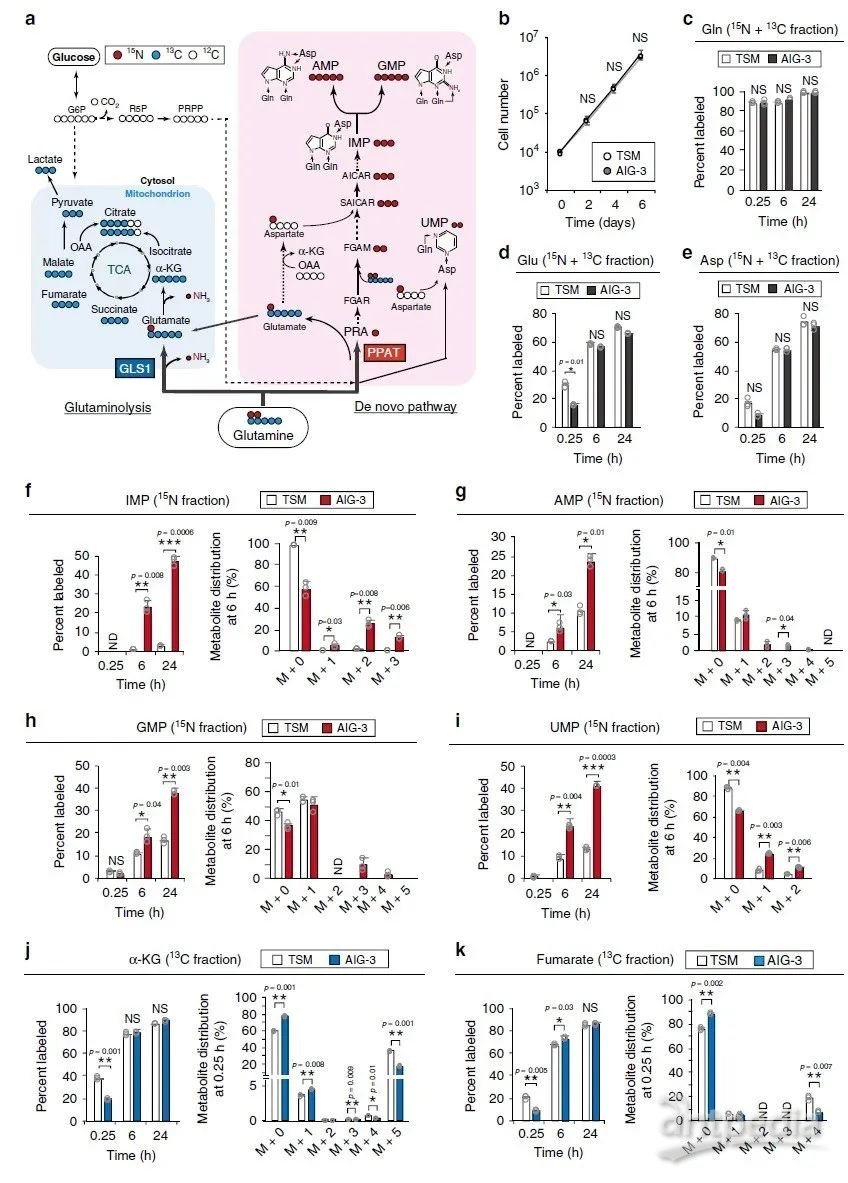
在恶性转化过程中,PPAT表达的增加和GLS1表达的减少导致PPAT/GLS1比值增加。为了研究这两种酶之间的平衡是否对细胞增殖具有决定性作用,作者检测了AIG-3细胞中GLS1过表达的影响(图4a)。在[13C5/15N2]谷氨酰胺代谢组学分析中以酶促失活的GLS1突变体(S286A)作为对照,强制表达GLS1导致α-KG标记率增加,而IMP(图4b)、AMP、GMP、谷氨酸和天冬氨酸标记率降低。AIG-3细胞在2-D(图4c)或3-D(图4d)培养基中的增殖速率也由于GLS1过表达而显著降低。且用GLS1抑制剂CB-839处理可逆转GLS1过表达并抑制AIG-3细胞增殖(图4c)。总的来说,GLS1的过度活化会抑制肿瘤生长。
作者分析了短发夹RNA(shRNA)介导的RNA干扰对AIG-3细胞PPAT耗竭的影响(图4g)。PPAT的消耗显著抑制 [13C5/15N2]谷氨酰胺中15N标记的IMP、AMP和GMP(图4h),却增加了13C 标记的α-KG(图4h)。在对照和PPAT缺失的AIG-3细胞中谷氨酰胺、谷氨酸和天冬氨酸的标记效率、池大小和同位素分布无显著差异。PPAT的消耗也降低了AIG-3细胞在2-D(图4i)或3-D(图4j)培养基中增殖速率。此外,与对照细胞相比,PPAT缺失的细胞在裸鼠中形成的肿瘤更小(图4k)。由此表明PPAT活性降低会抑制肿瘤生长,GLS1和PPAT之间的平衡控制着谷氨酰胺衍生的碳和氮代谢从而调控细胞增殖和肿瘤生长。
PPAT-GLS1平衡可作为潜在的治疗靶点
PPAT和GLS1之间的平衡对人类癌细胞系增殖具有决定性作用。当GLS1或PPAT分别过表达时,A549和HeLa两种细胞体内外均可被抑制或促进,而A549和HeLa细胞中GLS1缺失则不影响其在2-D培养基中的增殖,也不影响裸鼠肿瘤形成,相反,两种细胞系中PPAT缺失抑制了其在2-D和3-D培养基中的增殖,并抑制裸鼠肿瘤的形成。不同类型肿瘤细胞对谷氨酰胺代谢的依赖性会有所不同,作者对118个来自不同人体组织的癌细胞系的包括GLS1和PPAT在内的代谢酶丰度进行检测分析,发现PPAT/GLS1比值在这些细胞类型之间均存在显著差异(图5a)。PPAT/GLS1比值高的细胞如BT-549乳腺癌细胞(图5b),TGW神经母细胞瘤细胞(图5c)和U-251 MG胶质母细胞瘤细胞(图5d),对PPAT缺失或GLS1过表达敏感;相反,GLS1耗竭或PPAT过表达并不能持续增加这些细胞的AIG。相反,PPAT/GLS1比值低的细胞如HCT116结直肠癌细胞(图5e)和HSC-60胃癌细胞(图5f),PPAT耗竭或GLS1过表达对AIG具有促进作用(HCT116)或没有影响(HSC-60),而GLS1耗竭或PPAT过表达显著抑制了两种细胞系的生长。接下来,检测在生理培养基中培养的这些癌细胞系是否对CB-839敏感,结果显示在生理条件下CB-839只有对HCT116大肠癌细胞(图5m)和HSC-60胃癌细胞(图5n)生长具有显著抑制作用,表明胃肠来源的癌细胞基本上依赖于谷氨酰胺的回补。总体而言,谷氨酰胺的调节可能对多种癌症具有治疗价值,其潜在的抗肿瘤作用可能通过内源性GLS1和PPAT的表达水平来预测。
PPAT与癌症预后密切相关
PPAT-GLS1平衡影响细胞和小鼠的癌症恶性程度,同时作者检测了肺、脑或神经内分泌癌症患者单组群PPAT和GLS1基因表达与总生存率的关系。在每个队列中,PPAT高表达的个体预后明显差于PPAT低表达的个体,而GLS1低表达的个体往往较GLS1高表达的个体预后差,这些差异在神经内分泌癌症患者中最为显著。随后,作者对1.1万名癌症患者队列的所有代谢酶进行综合荟萃分析,在这些合并的癌症队列中,发现嘌呤从头生物合成途径的许多酶在其基因表达水平和总体存活率方面具有较高的危害比(HR)(图6a)。而在随机效应模型和固定效应模型中,PPAT的HR在组织特异性队列中都非常高,如肺癌、乳腺癌、脑癌、造血癌、神经内分泌癌、肝癌或胰腺癌队列(图6b),而除结直肠癌外,GLS1的表达与其他癌症的预后均无显著相关性。但在神经内分泌癌中,PPAT和GLS1的表达分别与预后不良(HR = 5.21)或预后好(HR = 0.38)显著相关(图6b)。PPAT/GLS1比值的影响略小于单独使用PPAT的影响,这表明PPAT的正面作用和GLS1对HR的负面作用并非一一对应。在细胞、小鼠、人类队列研究的观察结果表明,PPAT-GLS1平衡调节细胞增殖和恶性肿瘤,而PPAT的表达水平是许多癌症预后的有力指标。
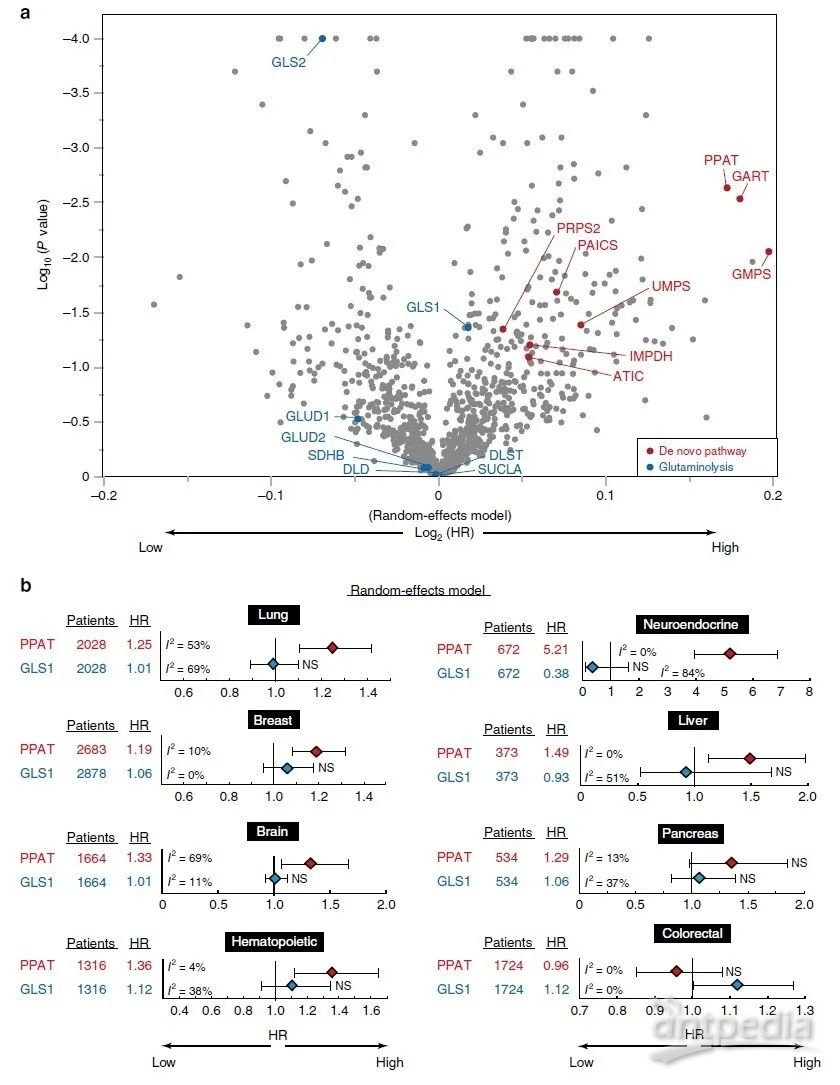
Fig.3 Regulation of lipid metabolism by PI3K–mTOR signalling.
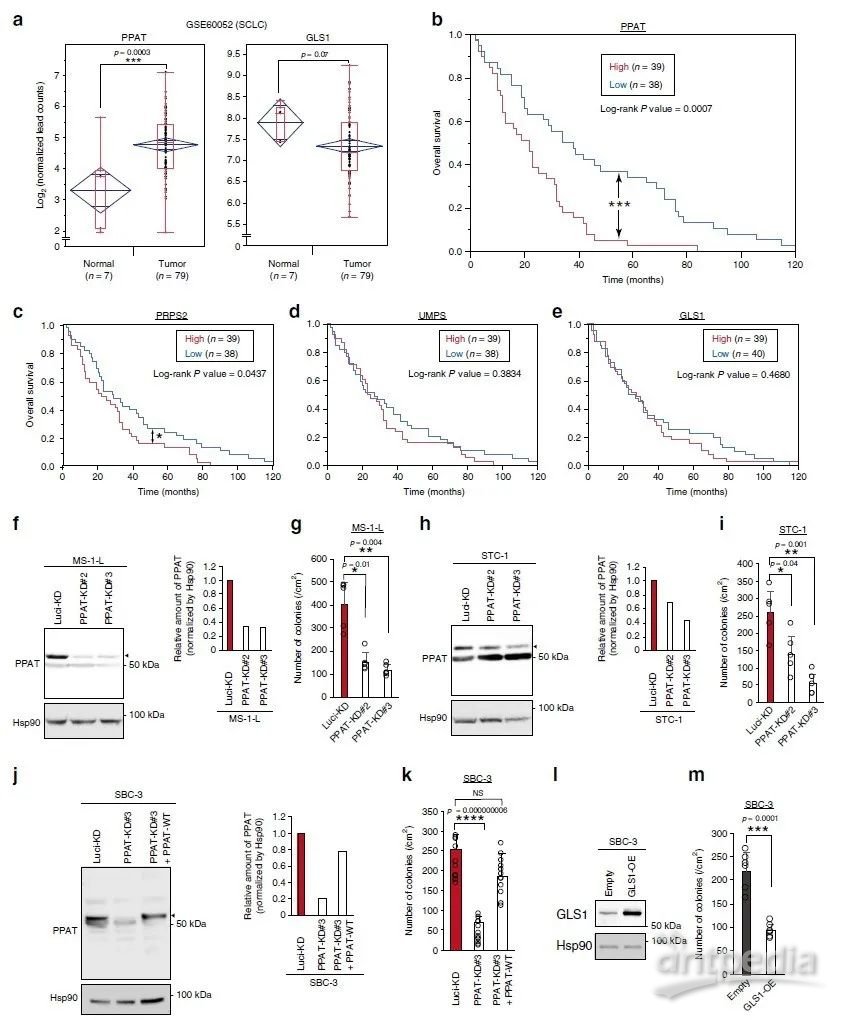
PPAT作为新的SCLC治疗靶点
PPAT表达与神经内分泌癌的不良预后显著相关引起研究人员对SCLC(小细胞肺癌)的关注,SCLC患者RNA测序结果显示肿瘤中PPAT的表达高于正常组织,而GLS1的表达低于正常组织(图7a)。Kaplan-Meier分析显示肿瘤组织中PPAT高表达个体的预后明显差于其低表达个体的预后(图7b)。核苷酸从头合成途径中的限速酶磷酸核糖焦磷酸合成酶2(PRPS2)的表达也存在类似模式,其表达受c-Myc调节(图7c)。相反,UMP合成酶(UMPS)(图7d)、嘧啶合成限速酶和GLS1(图7e)的表达均与SCLC患者预后无关。接下来作者用特定的shRNA将三种SCLC细胞系(MS-1-L、STC-1和SBC-3)PPAT耗竭,并研究其对3-D培养基中细胞生长的影响。结果显示,PPAT的耗竭抑制了三种细胞系的AIG(图7f-k),以抵抗其shRNA介导的敲除方式强制表达PPAT来逆转SBC-3细胞的这种作用(图7j, k)。GLS1的过表达也抑制了SBC-3细胞的AIG(图7l-m)。综上,PPAT表达与SCLC患者预后不良以及PPAT耗竭抑制SCLC细胞系非依赖锚定生长的强相关性表明PPAT可能是SCLC新的治疗靶点。
讨论
糖代谢在癌症中被重塑,除Warburg效应的碳转移外,氮转移在癌症恶性进展中也起着关键作用。谷氨酰胺的氮从回补途径转移到TCA循环再到核苷酸生物合成,这种转移由GLS1和PPAT控制,降低PPAT/GLS1比值可以抑制多种癌症的肿瘤生长。PPAT和GLS1都是控制来自谷氨酰胺的氮利用的决定性因素,它影响着体内外的恶性转化效率。本研究关于细胞和小鼠及来自人类队列的综合荟萃分析结果表明,谷氨酰胺向核苷酸生物合成的代谢趋同可能是人类癌症恶性进展中几乎普遍存在的过程(图8)。荟萃分析显示PPAT在所有代谢酶中与恶性肿瘤相关性最强,是决定性的预后标志物,尤其在包括小细胞肺癌(SCLC)在内的神经内分泌癌中,PPAT缺失抑制SCLC生长。因此,谷氨酰胺转运可能是恶性肿瘤进展所必需的,而调节氮代谢是SCLC治疗的潜在途径。总之,本研究作者明确了控制谷氨酰胺代谢命运的关键因素及不同器官肿瘤对这些因素的依赖,为探索不同的癌症治疗方法奠定了基础。

参考文献
Manabu Kodama, Masaki Matsumoto&Keiichi I. Nakayama, et al. A shift in glutamine nitrogen metabolism ontributes to the malignant progression of cancer. NATURE COMMUNICATIONS, (2020) 11:1320. https://doi.org/10.1038/s41467-020-15136-9.
06-18 TESCAN中国
解决临床创新“卡脖子”难题,丹纳赫重磅推出医院创新转化解决方案!06-18
徕卡精准空间生物学解决方案 第三弹06-18 郑晓业、童昕
618 嗨购一起“徕” | 网上商城活动来袭!06-18 徕卡显微系统
【培训活动】显微镜成像高阶培训系列(一) 共聚焦多维度成像技术解决方案06-18 徕卡显微系统
【展会】第十五届中国医师协会骨科医师年会06-18 徕卡显微系统
【直播预告】第十届电子显微学网络会议06-18 徕卡显微系统
【案例研究】双视野光片显微镜,适用于类器官及胚胎06-18 徕卡显微系统
议程确定|第四届锂离子电池热测试主题研讨会06-18
文献解读|安徽理工大学马衍坤教授团队《煤炭学报》:震动载荷多次作用下烟煤孔裂隙结构演化特征试验研究06-18 纽迈分析
中国的新质生产力正在服务全球市场!GE医疗北京基地CT交付量达3.5万台/套06-17
兰格ACHEMA 2024展会回顾:探寻精密流体传输市场新机遇06-17
宝英科技推出VOCs治理设施精细化管理实施方案,助力重点行业企业绿色升级06-17 宝英科技
赛默飞X先锋“肽”势:多肽药物研发与创新研讨会06-17
一省检验检测行业营收突破160亿元!06-17
仪器租赁 | 沃特世 液质联用,月租金52000元起06-17
不同行业实验室“以旧换新”,涉及哪些仪器设备?06-17
目标!检验机构总营收超100亿!06-16
一张“A4纸”售价高达万元,这家第三方检测公司是怎么做到的?06-15
GLMY创想仪器丨参加东北地区铸造年会06-15 国产精密仪器厂家