文献分享|基于血小板多组学的生物标志物开发
2024-06-25 09:30:13, Untangled

背景介绍
血小板是一种主要在骨髓中由巨核细胞不断产生的血细胞,它不仅参与止血和动脉血栓的形成,还参与其他生理和疾病生理过程。目前,参与血栓形成和持续凝血的血小板群的信号转导过程已被很好地理解。且通过遗传方法可以提供于正常止血相关的多个基因信息,例如编码受体和信号或分泌蛋白的基因,决定血小板计数及反应性。作为高反应性和分泌性细胞,血小板可以通过释放生长因子、趋化因子、凝血因子、RNA种类和细胞外囊泡来改变环境。同时,血小板也会适应环境。在疾病状态下,血小板可以正式启动达到预激活状态。在发炎的血管壁,血小板与白细胞和凝血系统相互作用,相互作用可介导血栓。
近几年来,血小板治疗总是导致出血作为不良反应。如果针对特定的血小板反应、人群、相互作用或启动条件,新的治疗方法可能更加有益。因而,氨探生物组学研究中心进行血小板多组学联合实验分析,力争通过血小板获得更多与疾病相关生物标志物,为之后的疾病研究提供参考方向。
血小板样品的研究价值
01
血小板是血管疾病的枢纽中心
血小板是心血管疾病(CVD)的重要参与者。自从Olser和Bizzozero首次描述以来,血小板在许多生物过程中都引起了很多关注。血小板对人类止血至关重要的最早证据之一是基于血小板减少症患者的血小板输注,可以恢复止血功能。血小板通过维持血管的完整性在止血中起关键作用。除此之外,血小板在机体受伤后提供第一道防线,形成血栓,修补受损内皮组织,从而在止血中发挥不可或缺的作用。然而,血小板活化失调可导致血栓形成、心肌梗塞和中风。血小板还参与冠状动脉或颈动脉粥样硬化的发展,这通常是血栓形成的触发因素。目前抑制血小板聚集的抗血小板药物已被证明对CVD治疗有效。然而,出血并发症仍然是血管疾病的一个问题。因此,现阶段的主要目标还是更好地了解血栓炎症疾病中的血小板机制,并提供新的安全治疗方法。
图1:相关血管疾病中血小板机制。(图A:中风中血小板受体抑制模型;图B:参与心肌梗死的血小板受体抑制模型:图C:腹主动脉瘤中血小板受体抑制模型)
02
COVID-19
可导循环血小板表型过度活跃
COVID-19也是一个基于血小板进行研究的典型案例,其中除了标准血小板计数和聚集测定之外,基础调查还补充了临床调查,以改进诊断和治疗策略。血小板可导致病毒感染期间的整体促凝血和炎症状态,可能导致血栓形成、血管并发症和高死亡率。COVID-19与潜在内皮病、凝血障碍和炎症情况下的血小板减少症、血栓形成和出血有关。不同的基础科学血小板方法的应用突出了这些新兴检测在临床上的潜在效用。越来来多的证据表明,与血小板-白细胞相互作用、各种活化或过度激活状态、细胞凋亡和坏死性凋亡相关的COVID-19血小板促进并鼓励使用抗血小板药物来对抗COVID-19的血栓形成。这些研究成果有望改善发病率和死亡率。

图2:COVID-19血小板研究进展
目前,已经有研究提出了几种用于研究血小板减少症发展的机制:首先是血小板活化和/或消耗以及随后的网状内皮系统的清除;其次是响应内皮损伤增加时的血小板消耗、血小板自身抗体形成和随后的血小板清除;最后,炎症或直接病毒感染引起的骨髓或巨核细胞抑制。截至2022年,部分研究以阐明血小板在COVID-19血栓炎症激活反应中的可能功能:
血小板-中性粒细胞、血小板-单核细胞聚集物的形成增加,血小板活化增加,超过3000个基因的表达发生改变;
循环免疫复合物介导的COVID-19相关血小板凋亡;
COVID-19中血小板表面蛋白的独特血小板过度活化表型。
03
血小板
在癌症中的多方面关联
实验和临床证据表明,血小板通过血小板和癌细胞之间的广泛物理和功能相互促进肿瘤进展和转移。血栓形成和血栓栓塞是实体瘤患者的常见并发症,因此,癌症通过直接诱导血小板肿瘤聚集并触发血小板颗粒释放和改变血小板更新来调节血小板功能。除此之外,血小板通过激活内皮细胞功能将免疫细胞募集到原发性和转移性肿瘤部位来增强肿瘤细胞的传播。而近年来,血小板在肿瘤转移过程的的不同功能也逐渐被部分研究人员所证实,例如:
血小板增多症与多种癌症(包括结直肠癌、乳腺癌、肺癌、肾癌和胃癌)的生存率低以及肿瘤转移和静脉血栓栓塞(VTE)风险增加有关,例如:癌症患者中观察到血清中血小板生成素的水平升高;
实体瘤达到一定大小后,需要刺激血管生成,获得更多的营养和生长因子。血小板α颗粒是同时控制肿瘤微环境中止血和血管生成因子的主要储存。活化的血小板释放α颗粒驻留的促血管生长因子,并释放抗血管生长因子。根据外部刺激,血小板可以选择性地释放这些因素,以刺激或抑制肿瘤生长中的血管形成;
肿瘤转移中的血小板功能:血小板参与癌细胞的免疫逃逸、参与癌细胞重编程、参与肿瘤细胞外渗动力学、介导循环肿瘤细胞与血管的相互作用。
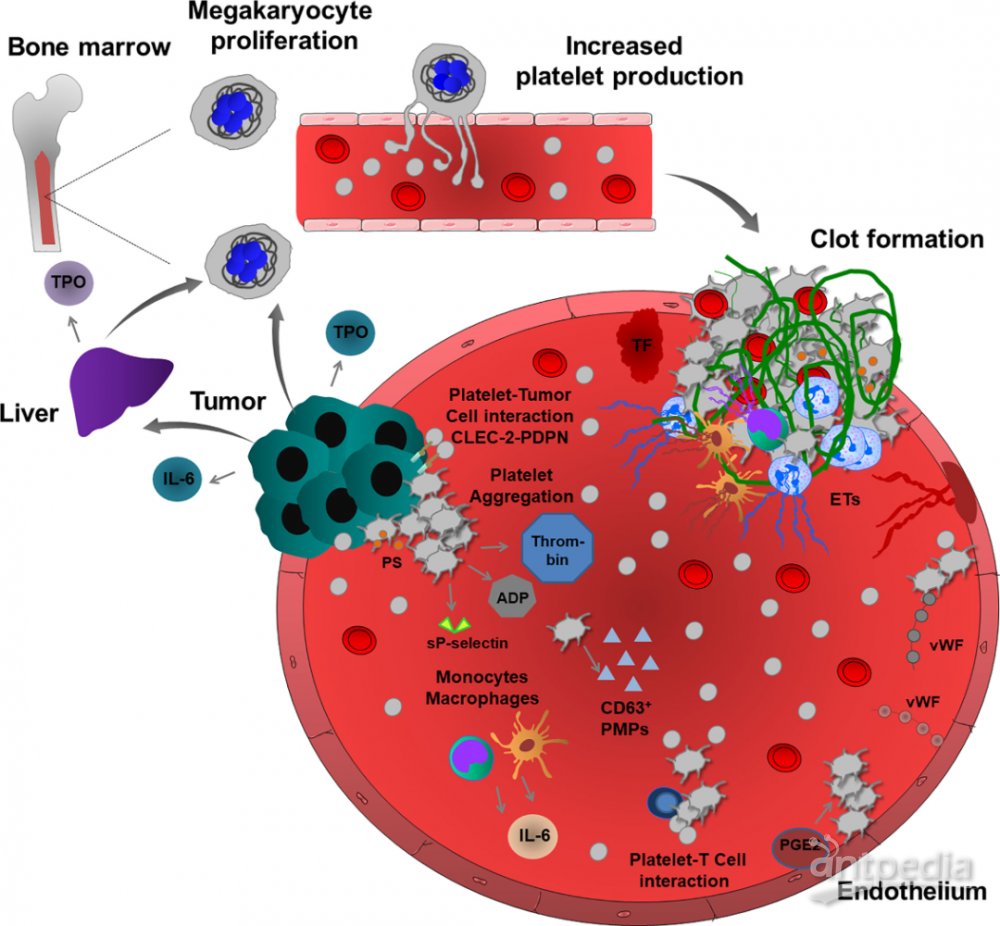
图3:癌症相关的血栓形成和血栓炎症示意图
氨探生物突破常规样品检测分析,开展血小板样品的代谢组与脂质组分析,利用自有的数据校正平台Omics Batch Correction(https://omia.untangledbio.com/obc/)。在血小板测试数据中共鉴定922种代谢物,其中Level1和Level2级别代谢物占比40%和34%。经KEGG通路富集,发现广泛的生物学事件,涉及到血小板活化(map04611)、逆行内源性大麻素信号传导(map04723)及神经退行性变的途径-多种疾病(map05022)等重要生命活动。
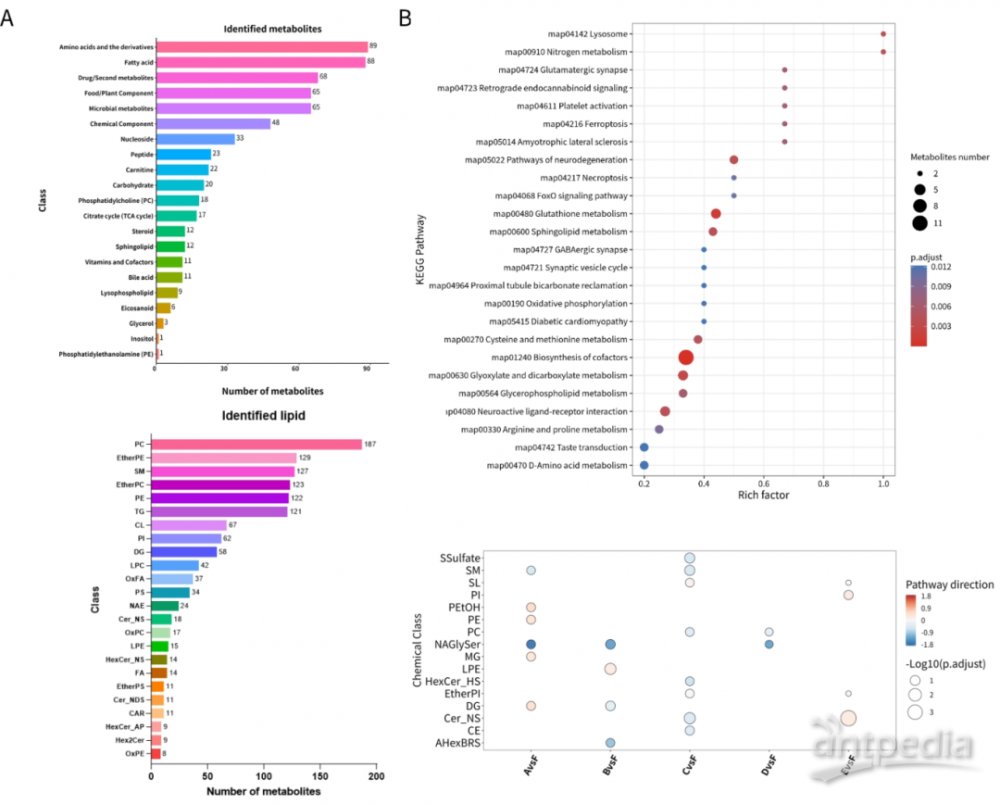
图4血小板代谢组与脂质组数据质量分析结果。(A,代谢组学与脂质组学小分子鉴定分类图:B:代谢组与脂质组差异代谢物KEGG通路富集示意图.)
总结
随着高分辨率、高灵敏度和快速扫描仪器的发展,代谢组学和脂质组学领域现在提供了多种方法来研究血小板代谢组、脂质组的许多尚未探索的方面。在不同情况下对血小板进行非靶向代谢组、脂质组以及靶向组学分析将继续揭示血小板功能的重要机制。
血小板在代谢组和脂质组具有提供生物标志物的巨大潜力,对疾病的诊断、预后以及随访和治疗具有重大意义。
参考文献
1.A guide to molecular and functional investigations of platelets to bridge basic and clinical sciences. Nat Cardiovasc Res 1, 223–237 (2022).
2.Platelet-Cancer Interplay: Molecular Mechanisms and New Therapeutic Avenues. Front Oncol. 2021 Jul 12;11:665534.
3.Platelets Are at the Nexus of Vascular Diseases. Front Cardiovasc Med. 2019 Sep 11;6:132.
4.SARS-CoV-2 interacts with platelets and megakaryocytes via ACE2-independent mechanism.
往期回顾
精准医学的“桃花源”:血小板多组学文献分享 | 基于血小板多组学的生物标志物开发文献分享 | qULTRA组学平台助力慢性偏头痛研究
Untangled Biosciences
解构健康奥秘、探寻生命答案,氨探生物以一流的分子表型组平台和成熟的临床转化应用体系,为优秀的研究团队进行技术和数据赋能,致力于实现分子表型水平的精准诊疗。
06-27 福立仪器
好礼来袭 | 分享您身边的特洁安身影06-27
大盘取厚势 落子开新局:战略聚焦开启品牌发展新篇章——访Veralto大中华区总裁秦晓培06-27 星羽
实验操作 | 质粒构建、转化、提取、鉴定、转染、测定(完整版)06-27 小 M
有投必奖 | 大家都用 MCE 产品做了啥? (感染领域)06-27 小 M
科研助攻 | 一文讲清:如何破解 PPI 靶点成药难题06-27 小 M
干货分享 | 谈谈天然产物的改构策略06-27 小 M
玉研口鼻暴露系统 | 精准、可控、高通量的动物肺部疾病造模工具,助力创新药物研发06-26 玉研仪器
高分离 高灵敏 高通量——福立液相LC5190重新定义分离需求06-26 福立仪器
医药行业指南:电位滴定仪选型攻略来啦~06-26
屹路同行 悦启新程06-26 屹尧科技
徕卡精准空间生物学解决方案 第四弹06-26 童昕、南希
【直播预告】第一届大湾区生物电镜制样讲习班06-26 徕卡显微系统
徕卡常规显微镜历经严苛的ISO9022标准测试06-26 徕卡显微系统
Viventis LS2 Live 光片显微镜发布会06-26 徕卡显微系统
前沿应用 | 经皮无创血糖检测中葡萄糖拉曼峰直接观测06-26 鉴知技术
SNEC光伏展圆满落幕 | OTT HydroMet闪耀时刻精彩回顾06-26 OTT HydroMet
激光指向稳定在光刻系统应用中的关键作用,及其优化方案!06-26 圈内人都会关注
推陈出新!通微公司携新品亮相本届CPHI06-26 Unimicro
远离氟污染!开启无氟接触前处理技术新篇章06-26